As2O3对大鼠BRL-3A和RH-35细胞TRβ1和Cyclin D1因子的影响
2023-07-07王雪飞耿敏杰郭志伟刘建平夏雅娟
王 炼,王雪飞,刘 丹,耿敏杰,郭志伟,崔 娜,刘建平,夏雅娟,杨 英
(1.河南牧业经济学院 动物医药学院,河南 郑州 450000;2.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;3.内蒙古巴彦淖尔市疾病预防控制中心,内蒙古 巴彦淖尔 014000;4.内蒙古包头市疾病预防控制中心,内蒙古 包头 014010;5.内蒙古地方病防治研究中心,内蒙古 呼和浩特 010031)
As2O3会对机体正常细胞产生毒性作用。有证据显示As2O3会因剂量不同产生复杂的双向作用。低剂量的砷剂会引起人肝脏细胞增殖,而高剂量的则抑制细胞增殖,降低细胞存活率,诱导细胞凋亡[1-2]。然而,As2O3也会对癌细胞产生毒性作用。研究发现,As2O3能够致使肝癌、头颈部鳞状细胞癌、小细胞肺癌[2-4]等多种癌细胞的存活率下降,诱导癌细胞凋亡。在临床上,As2O3已被用于肝癌、急性早幼粒细胞白血病等癌症的治疗。但是,As2O3对机体正常细胞和癌细胞的作用机制仍不清晰。近年来的研究表明砷是潜在的内分泌干扰物,可以影响机体甲状腺激素(thyroid hormone,TH)信号通路[5]。前期研究也显示,As2O3能够引起大鼠血清TH水平异常[6]。因此本研究以大鼠肝脏细胞系BRL-3A和肝癌细胞系RH-35为研究对象,通过检测不同剂量As2O3作用2种细胞后,甲状腺激素受体β1(thyroid hormone receptor β1,TRβ1)和细胞周期蛋白Dl(cyclin protein D1,Cyclin D1)基因和蛋白的变化,探索As2O3作用TH信号通路的具体机制,为As2O3的临床应用以及防治砷中毒提供理论基础。
1 材料与方法
1.1 主要试剂As2O3,分析纯(二级,北京化工厂,CAS:1327-53-3,批号890314);DMEM(Gibco,12100-046);胎牛血清FBS(Gibco,10099-133);0.25%胰酶(Gibco,25200-056);ITS(Gibco,41400-45);EGF(Sigma,E9644);HEPES粉(Sigma,H4-034);兔多克隆抗体Cyclin D1以及鼠单克隆抗体β-actin(均购于Santa Cruz 生物试剂公司);小鼠单克隆抗体TRβ1(购于Abcam生物试剂公司);HRP 标记的山羊抗鼠IgG、山羊抗兔IgG(购于优科卓业生物医学技术(北京)有限公司);兔抗山羊IgG、RIPA蛋白裂解液、蛋白酶抑制剂、4×蛋白上样缓冲液(均购于联科生物);PVDF膜(Millipore 公司);RN28 EASYspin Plus组织细胞RNA提取试剂盒(北京艾德莱);ReverAid First Strand cDNA SynthesisKit k1622(Thermo,00270332);FastStart Universal SYBR Green Master(ROX,04913914001);SuperSignalR West Femto Maximum Sensitivity Substrate(Thermo,34095);丙烯酰胺、N,N′-亚甲基双丙烯酰胺、过硫酸胺、四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)、Tris base、甘氨酸、Tween-20(Sigma公司);BCA Protein Assay试剂盒(TaKaRa,T9300A);脱脂奶粉(BD,231100)。
1.2 主要仪器荧光倒置显微镜(OLYMPUS,1×71);CO2培养箱(Thermo);低温离心机(Eppendorf,5430R);全自动酶标仪(Thermo,MK3);BIOER基因扩增仪TC-48/H(t)(BIOER,日本);实时定量PCR仪(Applied biosystems,美国);稳压稳流电泳仪DYY-6D型(北京六一仪器厂);全自动凝胶成像系统(VILBER LOURMAT,法国);超纯水机(UPH,成都超纯科技有限公司)。
1.3 试验细胞大鼠BRL-3A和RH-35细胞均购于中国科学院典型培养物保藏委员会细胞库。
1.4 As2O3的制备称取经105℃干燥2 h的As2O30.049 5 g,用7.5 mL NaOH(1 mol/L)溶解,加入32.5 mL PBS,调整pH值为7,用PBS溶液定容至50.0 mL,得到0.005 mol/L As2O3。经0.2 μm过滤器过滤除菌,分装,4℃避光保存备用。
1.5 细胞的培养BRL-3A和RH-35 2种细胞均以DMEM为基础培养基,添加10%胎牛血清、0.1 IU/L青霉素、100 mg/L链霉素,5%CO2细胞培养箱中37℃恒温培养,0.25%胰酶消化传代。取对数生长期的BRL-3A和RH-35细胞,分别用0.25%胰蛋白酶消化单层培养细胞,用DMEM培养液重悬细胞,每孔接种(2~4)×104个细胞于6孔板中培养。将培养板移入5%CO2的培养箱,37℃、饱和湿度条件下培养。待细胞约长成80%的丰度时接入不同浓度的As2O3溶液,分别培养12,24,48 h。
1.6 总RNA的提取与cDNA合成按照TaKaRa RNAiso Plus操作说明书提取细胞总RNA,按照Thermo公司的ReverAid First Strand cDNA SynthesisKit说明操作合成cDNA,-20℃保存待用。
1.7 荧光定量 PCR 检测 TRβ1、CyclinD1基因相对表达量以不同时间不同处理组及对照组的样品的反转录产物作为模板,用待测基因引物和内参基因引物进行PCR扩增,引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。反应体系见表2。Cyclin D1的反应程序参考相应文献,余下因子反应条件为:94℃ 5 min预变性;94℃ 30 s变性,60℃ 30 s退火,72℃ 30 s延伸,反应40个循环;72℃延伸10 min,4℃ 10 min。以β-actin为内参,采用2-ΔΔCt法计算TRβ1、Cyclin D1基因的相对表达量。

表1 荧光定量PCR引物

表2 荧光定量PCR扩增体系
1.8 Western blot 检测收集各处理组及对照组细胞,用预冷的PBS洗涤3次,加入适量的含蛋白酶抑制剂的RIPA裂解液(350~400)μL,冰上裂解细胞30 min,12 000 r/min,离心10 min,取上清。BCA法测定样品蛋白质浓度。加入4×蛋白上样缓冲液,煮沸10 min,-20℃保存待用。Western blot分析参照文献[10]操作。
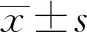
2 结果
2.1 RNA完整度检测如图1所示,提取的BRL-3A和RH-35细胞的RNA均呈现出2个条带,28S rRNA条带较18S rRNA的亮,两者的比例大于2∶1,说明所提取的RNA完整性好,能够满足后续RT-qPCR试验的需要。
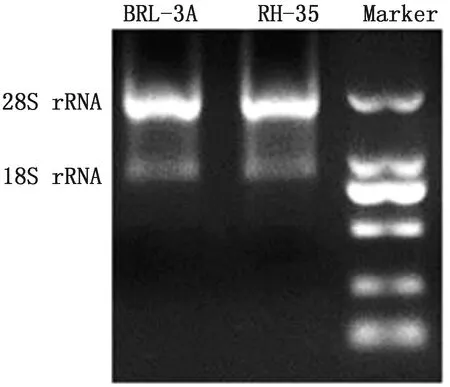
图1 BRL-3A和RH-35细胞RNA凝胶电泳图
2.2 As2O3对BRL-3A细胞TH信号通路关键因子TRβ1、Cyclin D1蛋白水平的影响如图2所示,与对照组相比,As2O3作用BRL-3A细胞12 h,各组TRβ1表达均降低,其中1.563和3.125 μmol/L组显著降低(P<0.01),6.250 μmol/L组明显降低(P<0.05)。As2O3作用24 h,1.563 μmol/L组TRβ1表达明显升高(P<0.05),6.250 μmol/L组TRβ1表达显著升高(P<0.01)。As2O3作用48 h,6.250 μmol/L组TRβ1表达显著升高(P<0.01)。
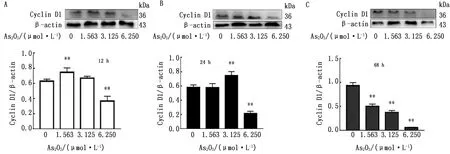
图3 蛋白质免疫印迹检测As2O3作用BRL-3A 12(A),24(B)和48 h (C) Cyclin D1的蛋白表达水平
如图3所示,与对照组相比,As2O3作用BRL-3A细胞12 h,1.563 μmol/L组Cyclin D1蛋白表达显著升高(P<0.01),6.250 μmol/L组Cyclin D1的蛋白表达显著降低(P<0.01);As2O3作用BRL-3A 24 h,3.125 μmol/L组Cyclin D1蛋白表达显著升高(P<0.01),6.250 μmol/L组Cyclin D1的蛋白表达显著降低(P<0.01);As2O3作用BRL-3A 48 h,各组Cyclin D1的蛋白表达均显著降低(P<0.01)。
2.3 As2O3对BRL-3A细胞TH信号通路关键因子TRβ1、Cyclin D1基因水平的影响如图4所示,与对照组相比,As2O3作用BRL-3A细胞12 h,1.563和6.250 μmol/L组TRβ1 mRNA表达量均显著升高(P<0.01);As2O3作用BRL-3A 24 h,各组TRβ1 mRNA表达量均显著降低(P<0.01);As2O3作用BRL-3A 48 h,6.250 μmol/L组TRβ1 mRNA表达量显著升高(P<0.01)。表明随着作用时间增加,高浓度As2O3诱导BRL-3A TRβ1 mRNA表达升高。与对照组相比,As2O3作用BRL-3A细胞12 h,1.563 μmol/L组Cyclin D1 mRNA表达量显著升高(P<0.01),而6.250 μmol/L组显著降低(P<0.01);As2O3作用BRL-3A细胞24 h,3.125 μmol/L组Cyclin D1 mRNA表达量显著升高(P<0.01),6.250 μmol/L 组显著降低(P<0.01);As2O3作用48 h,各组Cyclin D1 mRNA表达量均显著降低(P<0.01)。表明低浓度的As2O3作用12 h诱导BRL-3A Cyclin D1 mRNA异常高表达,而高浓度则引起Cyclin D1 mRNA异常低表达。
2.4 As2O3对RH-35细胞TH信号通路关键因子TRβ1、Cyclin D1蛋白水平的影响如图5所示,与对照组相比,As2O3作用RH-35细胞12 h,各组TRβ1蛋白表达量显著升高(P<0.01);As2O3作用RH-35 24 h,1.563 μmol/L组TRβ1表达量明显升高(P<0.05),其余组显著升高(P<0.01);As2O3作用RH-35 48 h,3.125和6.250 μmol/L组TRβ1表达显著升高(P<0.01),1.563 μmol/L组明显降低(P<0.05)。表明中高浓度As2O3能诱导RH-35 TRβ1异常高表达,低浓度As2O3随着作用时间的增长而诱导TRβ1表达降低。

图4 RT-qPCR法检测BRL-3A细胞TRβ1(A)和Cyclin D1(B)的基因表达水平
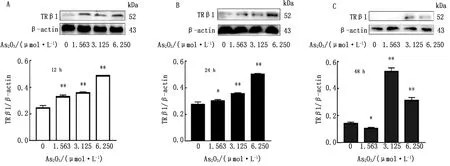
图5 蛋白质免疫印迹检测As2O3作用RH-35细胞12(A),24(B)和48 h (C) TRβ1的蛋白表达水平

图6 蛋白质免疫印迹检测As2O3作用RH-35细胞12(A),24(B)和48 h (C) Cyclin D1的蛋白表达水平
由图6可知,与对照组相比,As2O3作用大鼠RH-35细胞12,24,48 h,各组Cyclin D1 蛋白表达量均显著降低(P<0.01)。随着浓度的升高,As2O3抑制Cyclin D1蛋白表达的作用增强,表明As2O3能诱导RH-35细胞Cyclin D1异常低表达。
2.5 As2O3对RH-35细胞TH信号通路关键因子TRβ1、Cyclin D1基因水平的影响由图7可知,与对照组相比,As2O3作用RH-35细胞12,24 h,各组TRβ1 mRNA表达量显著升高(P<0.01);As2O3作用RH-35 48 h,3.125和6.250 μmol/L组TRβ1 mRNA表达量显著升高(P<0.01),1.563 μmol/L组显著降低(P<0.01)。基因结果与蛋白结果基本一致,表明中高浓度As2O3能诱导RH-35 TRβ1异常高表达,低浓度As2O3随着作用时间的增长而逐渐降低RH-35 TRβ1 mRNA的表达。与对照组相比,As2O3作用RH-35细胞12,24,48 h,各组Cyclin D1 mRNA表达量均显著降低(P<0.01)。基因结果与蛋白表达结果一致,表明As2O3能诱导RH-35细胞Cyclin D1异常低表达。

图7 RT-qPCR法检测RH-35细胞TRβ1(A)和Cyclin D1(B)的基因表达水平
3 讨论
研究显示,TH能影响多种正常细胞和癌细胞的增殖[11-14]。TRβ1是介导TH的生理作用的重要受体之一,研究发现TRβ1通过转录抑制Cyclin D1,抑制细胞增殖,改变细胞对激素的敏感性[15]。SEBASTIAN等[13]的研究也显示,TRβ1通过调控Cyclin D1,进而诱导肝脏细胞增殖。PERRI等[16]报道TRβ1介导的Cyclin D1表达异常引起甲状腺乳头状癌细胞系的增殖效应。
砷能影响TH水平,亦能对介导TH功能的甲状腺激素受体(thyroid hormone receptors,TRs)产生不良影响,从而影响TRs介导的目的基因表达。早期研究发现,砷中毒对基因转录有抑制作用[17]。进一步的研究其机制,结果显示低剂量的砷通过影响TRs转录与翻译,发挥其毒性作用[18]。砷中毒干扰小鼠TRβ1基因表达,4 mg/L AsIII能引起小鼠大脑及小脑TRβ1基因及蛋白表达均显著下降[19-20]。也有研究结果显示,0.15 mg/L的AsⅤ和AsIII均能降低鳙鱼苗TRβ1的基因转录水平[21]。斑马鱼AsIII中毒48 h后,TRβ1基因转录水平降低[18]。
研究显示,As2O3作用大鼠肝脏细胞系BRL-3A和肝癌细胞系RH-35,引起2种细胞的TRβ1基因和蛋白的异常表达。As2O3作用BRL-3A细胞,高浓度组随着作用时间的增长,引起TRβ1表达先降低后持续升高,Cyclin D1表达持续降低;低浓度的As2O3随着作用时间的增加,引起TRβ1表达先升高而后降低,Cyclin D1表达降低。As2O3作用RH-35细胞,中高浓度的As2O3诱导RH-35细胞TRβ1高表达,抑制Cyclin D1的表达。低剂量的As2O3作用RH-35细胞48 h,引起TRβ1表达降低,然而其抑制Cyclin D1表达的效应仍然非常明显。由此,本试验发现As2O3随着作用时间的增加,呈现出促进BRL-3A细胞和RH-35细胞TRβ1的表达、抑制Cyclin D1表达的作用,高浓度组作用强于低浓度组。
综上,As2O3调节BRL-3A和RH-35细胞的TRβ1,诱导Cyclin D1异常低表达,发挥其对2种细胞的毒性作用。TRβ1可能构成1个新的早期干预砷中毒的靶点。As2O3作用机制较为复杂,细胞试验与机体试验还有很大的差距,因此,As2O3的作用机制还需要进一步的动物试验深入去研究。
