车叶草苷调节NLRP3/Caspase-1/GSDMD信号通路对脓毒症大鼠肺组织细胞焦亡的影响
2023-07-06孙立燕刘泽茹苏永胜艾宏亮
孙立燕,刘泽茹,苏永胜,艾宏亮
脓毒症是以持续的过度炎症为主要特征的综合征,大多由病原体入侵、感染引起,机体因免疫应答失调诱发全身炎症反应,导致多器官功能障碍,通常肺是最先受累的器官,可发生急性肺损伤及肺功能障碍,威胁患者生命安全[1-2]。细胞焦亡又称细胞炎性坏死,为一种新型程序性细胞死亡方式,在脓毒症引发的肺损伤中发挥重要作用,可导致肺泡上皮细胞严重受损和死亡,损害正常肺功能,因此抑制细胞焦亡是减轻脓毒症诱发肺损伤的有效策略[3-4]。研究显示,细胞焦亡由核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)/胱天蛋白酶1(Caspase-1)/消皮素D(GSDMD)信号通路介导,抑制该通路激活可显著降低肿瘤坏死因子α(TNF-α)诱导的血管内皮细胞的焦亡和炎症反应[5],降低NLRP3 表达水平可通过抑制细胞焦亡而缓解脓毒症诱导的急性肺损伤[6]。车叶草苷是广泛分布在茜草科、杜仲科等植物中的环烯醚萜类化合物,具有明显的抗炎和抗氧化活性[7-8]。茜草科植物巴戟天为具有补肾益肺功效的一味药材,对慢性阻塞性肺疾病具有治疗作用[9]。因而,笔者推测车叶草苷可能对脓毒症引发的肺损伤有治疗作用。本研究通过构建脓毒症肺损伤大鼠模型,探讨车叶草苷调节NLRP3/Caspase-1/GSDMD信号通路对其肺组织细胞焦亡的影响。
1 材料与方法
1.1 材料 SPF 级雄性SD 大鼠60 只,7 周龄左右,体质量200~230 g,在潍坊医学院动物中心[动物生产许可证号:SYXK(鲁)2019-0016]适应性饲养1 周,动物房内保持屏障环境,分笼喂养,每笼不超过4只,操作遵循3R原则并严格遵循《中华人民共和国实验动物管理条例》。NLRP3 激活剂尼日利亚霉素购自美国MCE公司;脂多糖(LPS,纯度≥99%)、车叶草苷(纯度≥98%,实验时以生理盐水溶解至所需浓度)、苏木精-伊红(HE)染色试剂盒、大鼠白细胞介素(IL)-8酶联免疫吸附试验(ELISA)试剂盒、瑞氏-姬姆萨复合染液购自北京索莱宝科技有限公司;大鼠IL-6、IL-1β ELISA试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒、兔源抗大鼠NLRP3一抗、免疫荧光染色试剂盒-抗山羊Cy3、免疫荧光染色试剂盒-抗兔Alexa Fluor 488、辣根过氧化物酶(HRP)偶联山羊抗兔IgG购自上海碧云天生物技术有限公司;兔源抗大鼠GAPDH 一抗、兔源抗大鼠caspase-1 一抗、兔源抗大鼠GSDMD 一抗购自英国Abcam 公司;兔源抗大鼠GSDMD 一抗购自武汉爱博泰克生物科技有限公司;山羊源抗大鼠NLRP3一抗购自西格玛奥德里奇上海贸易有限公司等。
1.2 研究方法
1.2.1 脓毒症肺损伤大鼠模型制备及分组处理 取SD大鼠50只,腹腔内注射0.5 mL/kg的LPS溶液(药物含量10 g/L),建立脓毒症肺损伤模型[10]。大鼠出现食欲明显减退、活动减少、口鼻分泌物增多且产生呼吸窘迫症状时为造模成功。将造模成功的50只大鼠按照随机数字表法分为模型(M)组、车叶草苷低剂量(AL)组、车叶草苷中剂量(AM)组、车叶草苷高剂量(AH)组、车叶草苷高剂量+尼日利亚霉素(AH+N)组,每组10只;另取10只SD大鼠腹腔注射0.5 mL/kg剂量的生理盐水作为对照(C)组。AL组、AM组和AH组分别灌胃17.5、35、70 mg/kg[11]的车叶草苷,AH+N组在AH组的基础上腹腔注射1 mg/kg[12]的尼日利亚霉素。M 组和C 组灌胃10 mL/kg 的生理盐水,各组大鼠每天给药1次,共持续给药14 d。
1.2.2 大鼠肺功能、动脉血氧分压[p(O2)]检测 分组处理结束后24 h,采用小动物全身无创肺功能仪检测各组大鼠肺功能:每分钟通气量(MV)与吸气阻力(Ri)。以乙醚麻醉各组大鼠,取颈动脉血约0.8 mL,置于血气分析仪中测定p(O2),再次取颈动脉血约1.2 mL,3 000 r/min 离心5 min,取出上清液并于-80 ℃保存备用。通过颈椎脱臼处死大鼠,开胸后暴露游离支气管,将右主支气管结扎后切下右肺,将注射器针头插入左主支气管并结扎固定。以注射器抽取0.5 mL 无菌生理盐水灌洗左肺直至其膨起并变白,轻柔按摩后回吸灌洗液,再次注入左肺,轻柔按摩、回吸,重复3次后收集灌洗液,3 000 r/min 离心5 min 取上清液即支气管肺泡灌洗液(BALF),-80 ℃保存备用,剩余细胞沉淀以500µL磷酸盐缓冲液(PBS)重悬后备用。取0.5 g右肺组织保存在液氮中,剩余右肺组织放入冻存盒中包埋,液氮速冻后取出放入冷冻切片机中切片备用。
1.2.3 HE染色检测肺组织病理形态 取1.2.2中右肺冰冻切片、复温后浸入冰丙酮中固定,二甲苯透明后采用HE染色试剂盒进行染色,洗涤后在显微镜下观察肺组织病理形态并收集其图片。
1.2.4 瑞氏-姬姆萨染色检测BALF中性粒细胞、巨噬细胞和淋巴细胞数 取出1.2.2中收集BALF后剩余的细胞,采用细胞计数板测定细胞密度后,取约1.5×105个细胞悬浮液以瑞氏-姬姆萨复合染液孵育染色,滴入细胞计数板并在100 倍显微镜下随机读取5个视野分别计数中性粒细胞、巨噬细胞和淋巴细胞数量。
1.2.5 ELISA 检测血清炎性细胞因子 取1.2.2 中收集的各组大鼠血清,放入冰水浴中解冻,参照说明书,采用ELISA试剂盒测定其中炎性细胞因子IL-6、IL-8及IL-1β水平。
1.2.6 免疫荧光染色法检测肺组织细胞焦亡相关蛋白表达 取1.2.2 中收集的各组大鼠右肺冰冻切片,每只大鼠3张,复温后浸入冰丙酮中固定,二甲苯透明、孵育3%过氧化氢、3%脱脂奶粉、孵育山羊源抗大鼠NLRP3一抗和兔源抗大鼠GSDMD一抗(均1∶200),洗涤后孵育抗山羊Cy3二抗和抗兔Alexa Fluor 488二抗(均1∶500),并参照其试剂盒说明进行免疫荧光染色,洗涤后在荧光显微镜激发光下观察大鼠肺组织GSDMD与NLRP3共表达情况并采集其图像,用Image J软件计算相对荧光强度(即实验组荧光强度/对照组荧光强度)。
1.2.7 Western blot 法检测肺组织NLRP3/Caspase-1/GSDMD信号通路相关蛋白表达 取1.2.2中收集的各组大鼠右肺组织块,剪碎后加入RIPA 裂解液研磨匀浆后提取总蛋白。以BCA 蛋白浓度测定试剂盒测出其浓度后每组取出20 µg,100 ℃煮沸变性、120 V恒压电泳、40 mA稳流电转后,于硝酸纤维素膜上得到分离的总蛋白。以脱脂牛奶封闭后,剪下NLRP3、Caspase-1、GSDMD、GAPDH这4种蛋白条带,兔源抗大鼠NLRP3、Caspase-1、GSDMD、GAPDH 一抗(均1∶2 000)、HRP偶联山羊抗兔IgG二抗(1∶1 000)孵育,洗涤后扫描采集各组大鼠上述4种蛋白条带图像,以GAPDH 为内参,Image J软件进行量化分析。
1.3 统计学方法 采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以表示,多组间均数比较用单因素方差分析,组间多重比较用SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组肺功能指标与p(O2)比较 与C组比较,M组MV、p(O2)降低,Ri 升高(P<0.05);与M 组比较,AL、AM及AH组大鼠MV、p(O2)依次升高,Ri依次降低(P<0.05);与AH 组比较,AH+N 组大鼠MV、p(O2)降低,Ri升高(P<0.05),见表1。
Tab.1 Comparison of lung function indexes and p(O2)of rats between the six groups表1 各组大鼠肺功能指标与p(O2)比较(n=10,)

Tab.1 Comparison of lung function indexes and p(O2)of rats between the six groups表1 各组大鼠肺功能指标与p(O2)比较(n=10,)
**P<0.01;1 mmHg=0.133 kPa;a与C组比较,b与M组比较,c与AL组比较,d与AM组比较,e与AH组比较,P<0.05。
组别C组M组AL组AM组AH组AH+N组F MV(mL)7.69±0.86 2.71±0.42a 3.91±0.48b 4.80±0.51bc 7.13±0.73bcd 2.93±0.38e 129.083**Ri(kPa-1·L-1·s-1)24.97±4.65 59.68±6.80a 50.98±6.12b 42.24±5.16bc 26.43±4.52bcd 55.32±6.03e 69.525**p(O2)(mmHg)98.82±10.61 54.75±5.15a 65.12±6.24b 75.82±7.43bc 95.93±9.52bcd 58.12±5.36e 61.205**
2.2 各组肺组织病理形态变化 C组大鼠肺组织形态完好;M 组肺组织内有弥漫性出血及炎性细胞浸润,肺间质水肿,肺间隔断裂,肺泡变形塌陷且肺泡壁增厚,肺组织整体呈现严重病理损伤症状;与M组比较,车叶草苷各剂量组大鼠肺组织病理损伤症状均减轻,且AH 组大鼠肺组织病理损伤症状减轻程度更大;与AH 组比较,AH+N 组大鼠肺组织病理损伤症状加重,见图1。
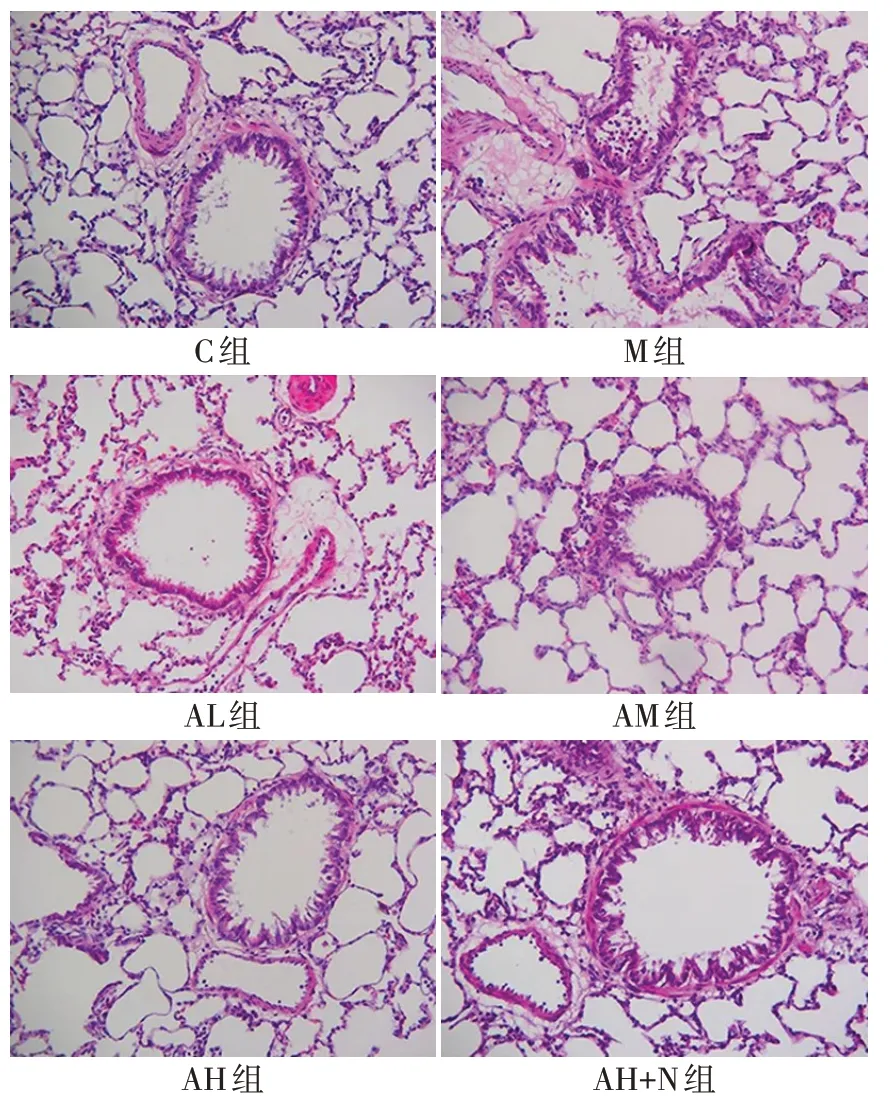
Fig.1 Pathological morphology of rat lung tissue detected by HE staining(×200)图1 HE染色检测各组大鼠肺组织病理形态(×200)
2.3 各组大鼠BALF中炎性细胞数量比较 与C组比较,M组中性粒细胞、巨噬细胞及淋巴细胞数均升高(P<0.05);与M 组比较,AL、AM 及AH 组大鼠中性粒细胞、巨噬细胞及淋巴细胞数均依次降低(P<0.05);与AH 组比较,AH+N 组大鼠中性粒细胞、巨噬细胞及淋巴细胞数均升高(P<0.05),见表2。
Tab.2 Comparison of the number of inflammatory cells in BALF between the six groups表2 各组大鼠BALF中炎性细胞数比较(n=10,×106/mL,)

Tab.2 Comparison of the number of inflammatory cells in BALF between the six groups表2 各组大鼠BALF中炎性细胞数比较(n=10,×106/mL,)
**P<0.01;a与C 组比较,b与M 组比较,c与AL 组比较,d与AM 组比较,e与AH组比较,P<0.05。
组别C组M组AL组AM组AH组AH+N组F中性粒细胞2.68±0.65 13.10±1.12a 10.68±0.95b 8.19±0.70bc 3.15±0.57bcd 12.38±1.31e 242.906**巨噬细胞22.76±2.43 54.20±6.51a 46.59±5.27b 39.84±4.25bc 25.90±2.56bcd 53.32±6.03e 80.336**淋巴细胞5.09±0.67 81.94±17.62a 64.75±13.41b 45.01±9.46bc 6.13±0.81bcd 80.61±15.73e 88.312**
2.4 各组大鼠血清炎性因子水平比较 与C 组比较,M 组血清IL-6、IL-8 及IL-1β 水平均升高(P<0.05);与M组比较,AL、AM及AH组大鼠血清IL-6、IL-8 及IL-1β 水平均依次降低(P<0.05);与AH 组比较,AH+N 组大鼠血清IL-6、IL-8 及IL-1β 水平均升高(P<0.05),见表3。
Tab.3 Comparison of serum levels of IL-6,IL-8 and IL-1β between the six groups表3 各组大鼠血清IL-6、IL-8及IL-1β水平比较(n=10,ng/L,)

Tab.3 Comparison of serum levels of IL-6,IL-8 and IL-1β between the six groups表3 各组大鼠血清IL-6、IL-8及IL-1β水平比较(n=10,ng/L,)
**P<0.01;a与C 组比较,b与M 组比较,c与AL 组比较,d与AM 组比较,e与AH组比较,P<0.05。
组别C组M组AL组AM组AH组AH+N组F TNF-α 27.35±5.02 183.46±21.53a 136.59±17.84b 107.86±13.46bc 31.12±6.32bcd 164.63±20.14e 185.239**IL-8 204.94±32.25 968.40±92.30a 761.25±77.62b 589.32±54.92bc 229.86±30.74bcd 960.11±90.58e 251.860**IL-1β 16.87±3.03 242.64±28.12a 193.45±20.51b 134.45±12.51bc 21.13±3.54bcd 230.36±25.92e 296.171**
2.5 各组大鼠肺组织细胞焦亡情况 M 组肺组织产生严重肺组织细胞焦亡,NLRP3 和GSDMD 共表达于肺泡上皮细胞,且与C组比较,M组大鼠肺组织NLRP3 和GSDMD 相对荧光强度均升高(P<0.05);与M 组比较,AL、AM 及AH 组大鼠肺组织NLRP3 和GSDMD相对荧光强度均依次降低(P<0.05);与AH组比较,AH+N组大鼠肺组织NLRP3和GSDMD相对荧光强度均升高(P<0.05),见表4、图2。
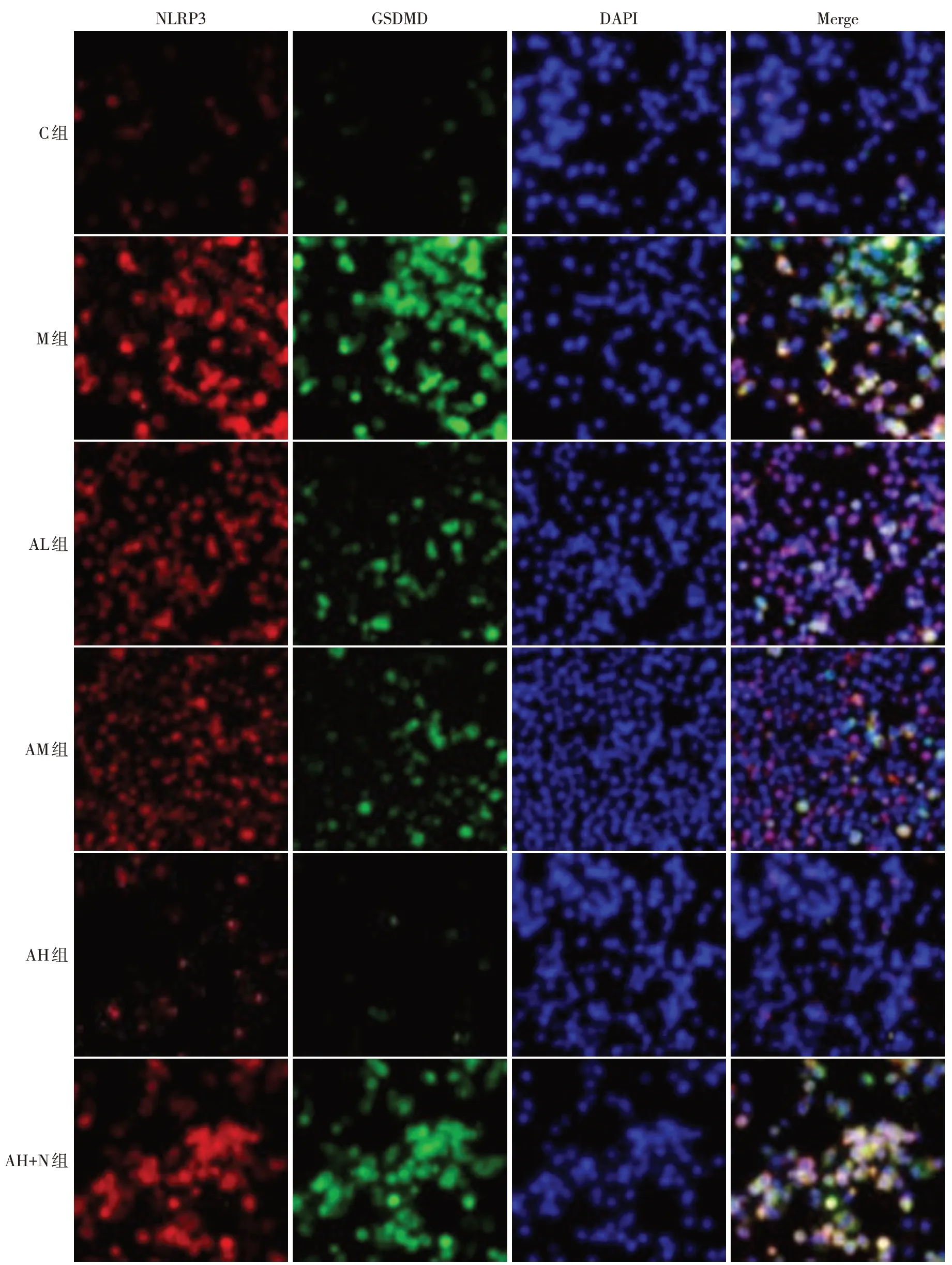
Fig.2 Co-expression of NLRP3 and GSDMD in rat lung tissue detected by immunofluorescence staining(×200)图2 免疫荧光染色检测各组大鼠肺组织NLRP3和GSDMD共表达情况(×200)
Tab.4 Comparison of relative fluorescence intensity of NLRP3 and GSDMD in lung tissue of rats between the six groups表4 各组大鼠肺组织NLRP3和GSDMD相对荧光强度比较()

Tab.4 Comparison of relative fluorescence intensity of NLRP3 and GSDMD in lung tissue of rats between the six groups表4 各组大鼠肺组织NLRP3和GSDMD相对荧光强度比较()
**P<0.01;a与C 组比较,b与M 组比较,c与AL 组比较,d与AM 组比较,e与AH组比较,P<0.05。
组别C组M组AL组AM组AH组AH+N组F n 10 10 10 10 10 10 NLRP3 1.00±0.00 2.89±0.36a 2.36±0.29b 2.02±0.25bc 1.16±0.20bcd 2.64±0.34e 84.386**GSDMD 1.00±0.00 2.57±0.32a 2.19±0.26b 1.84±0.29bc 1.13±0.17bcd 2.31±0.33e 63.873**
2.6 各组大鼠肺组织NLRP3/Caspase-1/GSDMD 信号通路相关蛋白表达水平比较 与C 组比较,M 组肺组织NLRP3、Caspase-1、GSDMD 蛋白表达升高(P<0.05);与M 组比较,AL、AM 及AH 组大鼠肺组织NLRP3、Caspase-1、GSDMD 蛋白表达依次降低(P<0.05);与AH 组比较,AH+N 组大鼠肺组织NLRP3、Caspase-1、GSDMD 蛋白表达均升高(P<0.05),见图3、表5。

Fig.3 The expression of NLRP3/Caspase-1/GSDMD signaling pathway related proteins in lung tissue of each group detected by Western blot assay图3 Wester blott检测各组大鼠肺组织NLRP3/Caspase-1/GSDMD信号通路相关蛋白表达
Tab.5 Comparison of relative expression levels of NLRP3/Caspase-1/GSDMD pathway related proteins in lung tissue of rats between the six groups表5 各组大鼠肺组织NLRP3/Caspase-1/GSDMD通路相关蛋白相对表达水平比较()
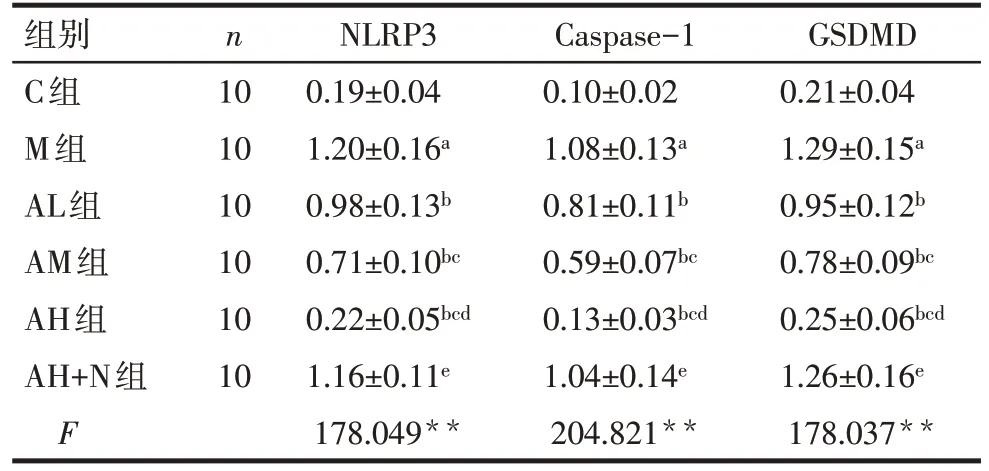
Tab.5 Comparison of relative expression levels of NLRP3/Caspase-1/GSDMD pathway related proteins in lung tissue of rats between the six groups表5 各组大鼠肺组织NLRP3/Caspase-1/GSDMD通路相关蛋白相对表达水平比较()
**P<0.01;a与C 组比较,b与M 组比较,c与AL 组比较,d与AM 组比较,e与AH组比较,P<0.05。
组别C组M组AL组AM组AH组AH+N组F n 10 10 10 10 10 10 NLRP3 0.19±0.04 1.20±0.16a 0.98±0.13b 0.71±0.10bc 0.22±0.05bcd 1.16±0.11e 178.049**Caspase-1 0.10±0.02 1.08±0.13a 0.81±0.11b 0.59±0.07bc 0.13±0.03bcd 1.04±0.14e 204.821**GSDMD 0.21±0.04 1.29±0.15a 0.95±0.12b 0.78±0.09bc 0.25±0.06bcd 1.26±0.16e 178.037**
3 讨论
脓毒症重症率和病死率均较高,而脓毒症相关肺损伤是造成患者死亡的主要原因,主要的治疗方案是应用抗生素控制感染及生命体征支持治疗,但并未从根本上解除患者死亡风险[13-14]。脓毒症引发的各种炎症介质过量生成和释放是急性肺损伤的主要致病因素,细胞焦亡在此过程中至关重要,通过减弱细胞焦亡可有效缓解脓毒症相关肺损伤[15-16]。本研究结果显示,与C组比较,M组肺组织内有弥漫性出血及炎性细胞浸润,肺间质水肿,肺间隔断裂,肺泡变形塌陷且肺泡壁增厚,肺组织整体呈现严重病理损伤症状,细胞焦亡相关蛋白NLRP3 和GSDMD于肺泡上皮细胞共同高表达,并伴随BALF 中性粒细胞、巨噬细胞、淋巴细胞数以及血清IL-6、IL-8、IL-1β 水平升高,最终导致大鼠MV、p(O2)降低,Ri升高,肺功能严重受损,表明LPS可诱导大鼠炎症反应和细胞焦亡的发生。
车叶草苷能降低肺癌荷瘤小鼠整体炎性反应并发挥抑瘤作用[11]。车叶草苷作为巴戟天的活性成分之一,还可对慢性阻塞性肺疾病起到治疗功效[9]。本研究结果显示,不同剂量的车叶草苷均可减轻脓毒症肺损伤大鼠肺组织病理损伤及肺组织细胞焦亡症状,并降低Ri,降低BALF中性粒细胞、巨噬细胞、淋巴细胞数以及血清IL-6、IL-8、IL-1β 水平,抑制肺组织NLRP3 和GSDMD 表达,同时升高MV 和p(O2),且高剂量车叶草苷对上述指标的作用效果更好,表明车叶草苷尤其是高剂量车叶草苷可降低炎性细胞因子合成释放,抑制脓毒症引发的肺组织炎性损伤,缓解肺组织细胞焦亡,修复大鼠肺功能,提示车叶草苷可通过减轻细胞焦亡来治疗脓毒症相关肺损伤。
细胞焦亡是一种依赖于NLRP3/Caspase-1/GSDMD信号通路的新型程序性细胞死亡形式,与抑郁症、脓毒症、急性肺损伤等多种炎性疾病发病有关,通过抑制NLRP3介导的Caspase-1激活,可减少促炎细胞因子产生和脾的树突状细胞焦亡,最终降低脓毒症小鼠病死率[17]。抑制NLRP3/Caspase-1/GSDMD 介导的细胞焦亡可缓解抑郁症发病机制中的星形胶质细胞丢失[18],还可减轻脓毒症诱导的肺组织炎性细胞浸润及肺损伤[19]。本研究结果显示,不同剂量的车叶草苷均可降低脓毒症肺损伤模型大鼠肺组织NLRP3、Caspase-1、GSDMD 蛋白表达,且高剂量车叶草苷对NLRP3、Caspase-1、GSDMD 蛋白表达的降低作用更好,提示NLRP3/Caspase-1/GSDMD 信号通路参与介导车叶草苷对脓毒症大鼠肺组织细胞焦亡的抑制过程。以NLRP3 激活剂尼日利亚霉素和车叶草苷联合处理脓毒症肺损伤模型大鼠后发现,NLRP3、Caspase-1、GSDMD 蛋白表达上调,大鼠肺组织病理损伤及肺组织细胞焦亡症状加重,大鼠Ri 降低,BALF 中性粒细胞和巨噬细胞、淋巴细胞数下降,血清IL-6、IL-8 及IL-1β 水平减少,肺组织NLRP3、GSDMD相对荧光强度升高,MV、p(O2)降低,表明尼日利亚霉素可减弱车叶草苷对脓毒症大鼠肺组织炎症和肺组织细胞焦亡的抑制作用,逆转其对大鼠肺功能的修复功效,提示车叶草苷抑制脓毒症大鼠肺组织细胞焦亡是通过下调NLRP3通路活性而实现的。
综上所述,车叶草苷可通过下调NLRP3/Caspase-1/GSDMD通路相关蛋白活性来降低炎性细胞因子释放水平,从而阻止脓毒症引发的大鼠体内炎症发生、发展,减轻大鼠肺组织炎性损伤,减少肺组织细胞焦亡,最终改善肺功能。车叶草苷有助于降低脓毒症患者重症率及病死率。然而,本研究未阐明车叶草苷与尿毒症大鼠氧化应激反应之间的关系,是否有其他通路参与车叶草苷改善尿毒症大鼠肺损伤这一过程也尚不明确,未来将针对这些不足之处开展实验,继续探究车叶草苷的具体调节机制。
