石煤含氟酸浸液中V(V)-Fe(III)-F-H2O系钒铁分离热力学研究
2023-07-06赖永传杨鑫龙孙建之尚鹤莫晓兰温建康
赖永传,杨鑫龙,孙建之,尚鹤,莫晓兰,温建康
(1. 中国有研科技集团有限公司高品质有色金属绿色特种冶金国家工程研究中心,北京,100088;2. 有研资源环境技术研究院(北京) 有限公司,北京,101407;3. 有研工程技术研究院有限公司,北京,101407;4. 北京有色金属研究总院,北京,100088)
石煤是我国一种主要的含钒矿物资源,广泛分布在全国20多个省(市、自治区),主要分布在长江中下游地区[1]。石煤提钒典型方法是通过焙烧使得钒转化为高价态,再采用水浸或酸浸使得钒转入溶液中[2-6]。随着人们生态环保意识的增强,石煤焙烧过程排放有毒有害气体,以及提钒尾渣减量化和资源化问题愈发突出,促使石煤提钒逐渐走向全湿法综合回收金属阶段[7-8]。传统酸性湿法提钒采用高浓度硫酸直接浸出,浸出液存在余酸高、钒浸出率低、杂质元素多等问题。为解决高酸、浸出率低的问题,学者们提出在浸出过程中添加助浸剂,促进钒转化浸出[9-11]。在众多助浸剂中,氟化物具有较好的浸出效果,可在稀酸浸出的前提下强化钒的浸出过程,提高钒浸出率[12-14]。
在钒浸出的同时,众多杂质元素也进入溶液中,从中分离富集钒难度较大,为使钒易于与杂质分离和缩短制备V2O5流程,常对浸出液进行氧化处理。铁是众多杂质元素中含量较多的一种,影响后续产品的纯度[15]。从石煤酸浸液中分离钒的方法主要有溶剂萃取法[16-18]、离子交换法[19-20],其中溶剂萃取法对钒选择性强、反应效率高。然而,在萃取过程中,三价铁常与钒一同进入有机相,造成萃取剂有效钒负载量降低以及富钒液含有杂质元素铁。因此,钒与三价铁分离成为石煤氟化浸出液中钒分离富集的难点[16,21-22]。
刘红[23]分析了石煤氟化浸出液中各元素组成分布,ZHANG 等[24]分析了V-H2O 系钒的离子组成,刘景文等[25]研究了V(V)-Fe(III)-S(VI)-H2O中钒铁分离的理论,而目前人们对于氟化浸出体系的热力学研究较少。相比于常规浸出工艺浸出液,氟化浸出添加了氟离子,因此,钒离子、铁离子的浓度分布会有较大差异。本文通过对V(V)-Fe(III)-F-H2O系中各离子间的关系式进行计算,分析含氟酸性浸出液中钒、铁的存在形态及其分布情况,揭示含氟体系主要离子随pH的变化规律,旨在找出钒铁分离pH的较优区间,并采用实验验证,从而为石煤含氟酸浸液钒铁分离工艺的优化提供理论依据。
1 实验
1.1 实验原料
V(V) -Fe(III) -F-H2O 系 由0.05 mol/L V5+、0.05 mol/L Fe3+和0.50 mol/L F-组成。所用溶液由NaVO3、 Fe2(SO4)3、 NaF 和H2SO4配 置 得 到。NaVO3和NaF 由国药集团化学试剂有限公司提供,Fe2(SO4)3由天津市科密欧化学试剂有限公司提供,H2SO4由北京化工厂有限责任公司提供。
实验所用萃取剂为三烷基胺(N235,郑州和成新材料科技有限公司),改性剂选择磷酸三丁酯(TBP,上海麦克林生化科技有限公司),稀释剂选择DT-100(重庆康普化学工业有限公司)。
实验设备有恒温水浴磁力搅拌器、pH 计和电感耦合等离子光谱发生仪(ICP-OES),分别由江苏省金坛市荣华仪器制造有限公司、Thermo Scientific、北京瑞利分析仪器公司生产。
1.2 实验步骤
取适量的NaVO3、Fe2(SO4)3、NaF 和H2SO4溶解稀释配置实验所用原液。原液中V、Fe、F浓度分别为0.05、0.05、0.50 mol/L。萃取实验前用少量盐酸或者NaOH 调控pH,萃取实验在指定pH、温度为298.15 K、有机相组成为20% N235+10%TBP+70% DT-100 (体积分数)、有机相与水相体积比为1∶1的条件下于恒温水浴磁力搅拌器中混合搅拌10 min。平衡静置分相后取液相,采用去离子水稀释至适当浓度,采用电感耦合等离子光谱发生仪(ICP-OES)测量稀释液中钒、铁的浓度,进而得出萃余液中钒、铁的浓度并计算钒、铁萃取率。
2 结果与讨论
2.1 热力学数据
根据文献调研以及查阅热力学数据库,V(V)-Fe(III)-F-H2O 系涉及反应方程式(1)~(31)、平衡常数及各离子浓度间关系式如表1 所示[24-27],其中,[V]T、[Fe]T、[F]T分别代表溶液中总钒、总铁、总氟浓度。量子化学模拟计算和配位化学研究表明,氟离子与钒结合较之硫酸根与钒结合更为紧密,在相同氟浓度和硫酸根浓度的溶液中,钒主要与氟离子进行结合[28]。在研究的溶液中,硫酸根浓度小于氟离子浓度,硫酸根对溶液中的离子分布影响极小,因此,在计算V(V)-Fe(III)-F-H2O 系热力学的过程中不包括硫酸根。

表1 298.15 K下V(V)-Fe(III)-F-H2O系反应方程式及平衡常数Table 1 V(V)-Fe(III)-F-H2O system reaction equation and equilibrium constant at 298.15 K
2.2 热力学计算
根据各元素的物料守恒定理可得:
在给定溶液总钒、总铁、总氟浓度以及溶液pH 的条件下,将各离子间关系式代入上述3 式,形成以、Fe3+、F-离子浓度为未知数的三元方程,参照周小兵等[29]的方法计算方程的解,从而得到给定条件下各离子的浓度,各含钒、含铁离子的摩尔浓度与总钒、总铁摩尔浓度之比分别为该离子占总钒、总铁的摩尔分数。考虑到pH>3.00 时铁离子易沉淀,因此,计算pH 选定在0~3.00之间。
3 结果与讨论
3.1 V(V)-Fe(III)-F-H2O系离子形态分布
设 定[V]T=0.05 mol/L、 [Fe]T=0.05 mol/L、[F]T=0.50 mol/L,计算并绘制了含钒、含铁离子占总钒、总铁的摩尔分数随pH的变化趋势图,分别如图1和图2所示。
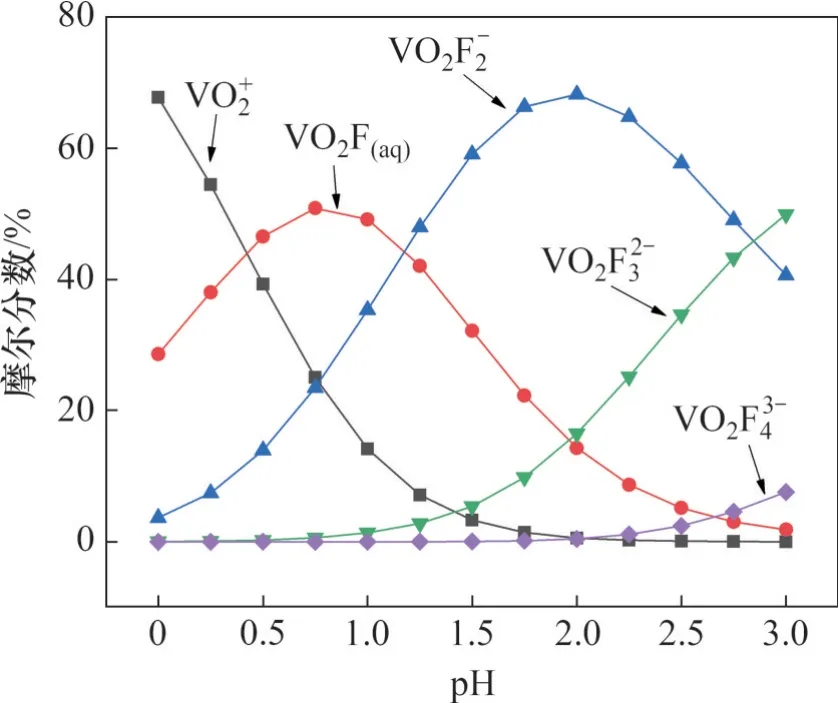
图1 V(V)-Fe(III)-F(I)-H2O系在298.15 K下主要含钒离子摩尔分数随pH的变化Fig. 1 Vanadium mole fraction of main species as function of pH in V(V)-Fe(III)-F(I)-H2O system at 298.15 K
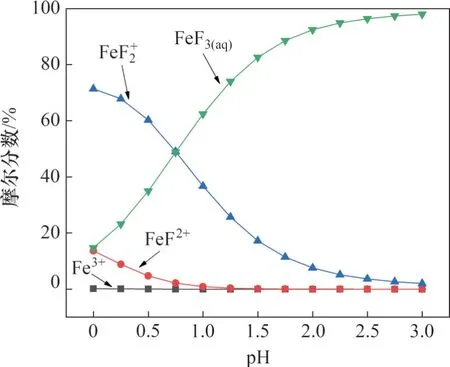
图2 V(V)-Fe(III)-F(I)-H2O系在298.15 K下主要含铁离子摩尔分数随pH的变化Fig. 2 Iron mole fraction of main species as function of pH in V(V)-Fe(III)-F(I)-H2O system at 298.15 K
从图2可以看出:在pH=0~3.00时,含铁离子主要以Fe3+、FeF2+、、FeF3(aq)形式存在,在此pH 范围内,随着pH 的升高,Fe3+摩尔分数变化较小,并保持在较低值;FeF2+、摩尔分数呈现下降趋势,摩尔分数降低较快;FeF3(aq)摩尔分数呈现增加趋势。当pH>2.00时,铁以FeF3(aq)形式存在为主。
3.2 总钒浓度对钒、铁离子分布的影响
各离子存在状态不仅受pH 的影响,还受各元素总量的影响。保持总铁浓度0.05 mol/L、总氟浓度0.50 mol/L,在不同总钒浓度下,含钒、铁阴离子占总钒、铁摩尔分数的变化如图3 所示。其中,pH50%为含钒阴离子占总钒含量的50%时的pH。从图3 可以看出,含钒阴离子摩尔分数随着pH 的升高逐渐增加,含铁阴离子摩尔分数则一直保持较低值;随着总钒浓度的升高,含钒阴离子摩尔分数逐渐降低,pH50%逐渐增加,含铁阴离子摩尔分数变化很小。当总钒浓度为0.025、0.050、0.075和0.100 mol/L 时,pH50%分别为1.186、1.236、1.294 和1.359。结合图3 可知:当pH 大于pH50%时,含钒阴离子为主,而含铁阴离子含量很低,因此,当pH 大于pH50%时,采用合适的阴离子萃取剂即可有效提取溶液中的钒。

图3 不同总钒浓度下含钒、铁阴离子摩尔分数随pH的变化Fig. 3 Mole fraction of vanadium and iron anions as a function of pH at different total vanadium concentrations
在不同总钒浓度下,含钒中性分子、阳离子摩尔分数随pH变化情况如图4所示。由图4可知:随着pH升高,含钒中性分子先增加后降低,阳离子逐渐减少,在pH=0.75时,中性分子摩尔分数最大;在pH<0.75 范围内时,随着总钒浓度的升高,含钒中性分子摩尔分数逐渐降低;在0.75<pH<3.00范围内,随着总钒浓度的升高,含钒中性分子摩尔分数逐渐升高。含钒阳离子摩尔分数则随着总钒浓度的升高一直呈升高趋势,其升高趋势又随着pH的升高逐渐降低。
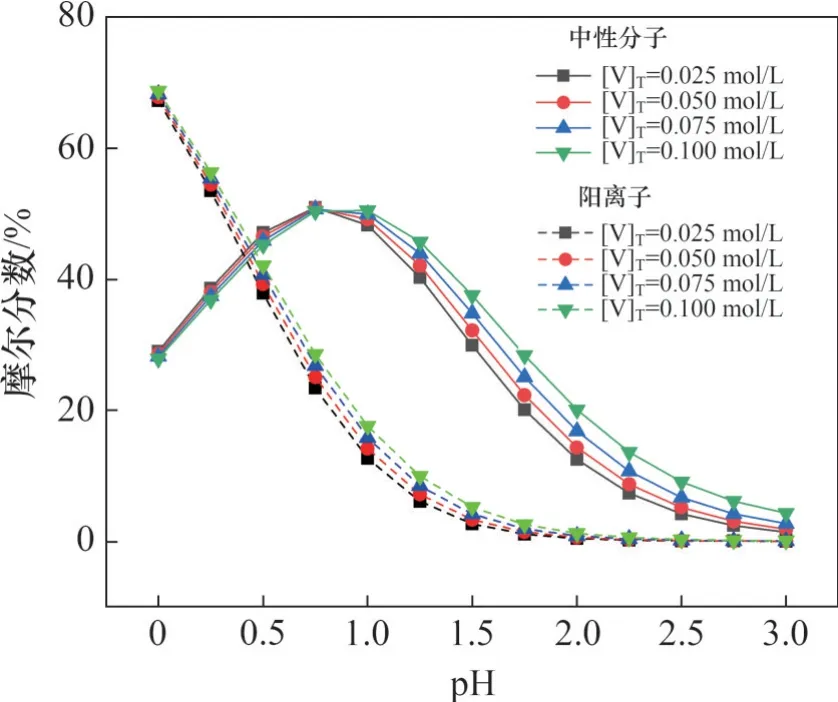
图4 不同总钒浓度下含钒中性分子、阴离子摩尔分数随pH的变化Fig.4 Mole fraction of neutral molecules and anions containing vanadium as a function of pH at different total vanadium concentrations
在不同总钒浓度下,含铁中性分子、阳离子摩尔分数随pH 变化情况如图5 所示。从图5 可以看出:随着pH的升高,含铁中性分子摩尔分数逐渐升高,含铁阳离子摩尔分数逐渐降低;在总钒浓度由0.025 mol/L 升高至0.100 mol/L 的过程中,含铁中性分子摩尔分数逐渐降低、含铁阳离子摩尔分数逐渐升高。
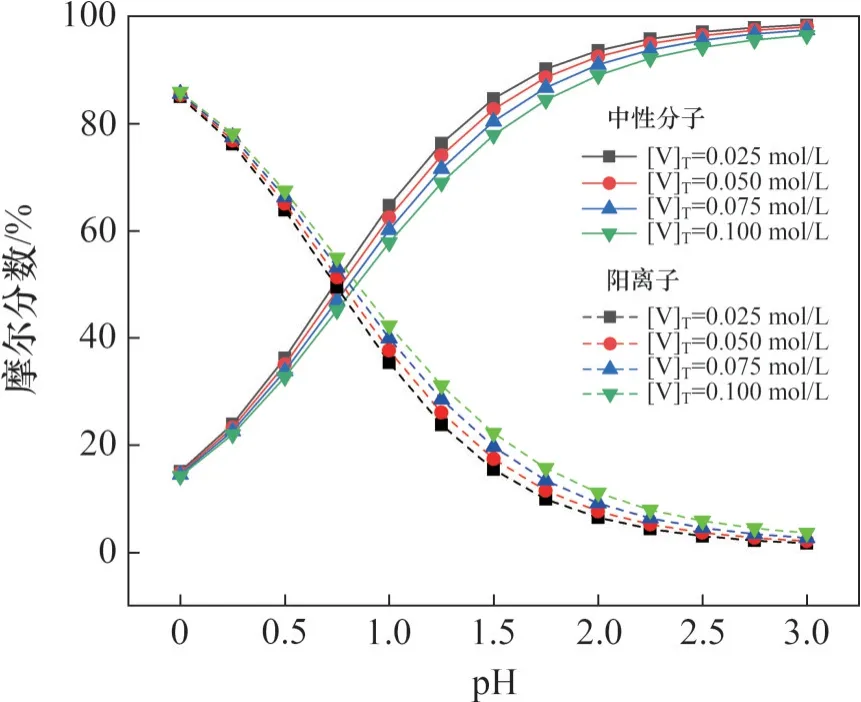
图5 不同总钒浓度下含铁中性分子、阴离子摩尔分数随pH的变化Fig.5 Mole fraction of iron-containing neutral molecules and anions as a function of pH at different total vanadium concentrations
3.3 总铁浓度对钒、铁离子分布的影响
固定总钒浓度0.05 mol/L、总氟浓度0.50 mol/L,在不同总铁浓度下,含钒、铁阴离子摩尔分数随pH的变化如图6所示。从图6可以看出,随着总铁浓度的升高,其变化趋势与总钒浓度变化相似,含钒阴离子摩尔分数逐渐降低,pH50%逐渐增加,含铁阴离子摩尔分数变化很小;当总铁浓度由0.01 mol/L 逐渐升高至0.15 mol/L 时,pH50%从1.091逐渐增加至2.335,可见总铁浓度升高,钒铁分离的最佳pH也随之升高。

图6 不同总铁浓度下含钒、铁阴离子摩尔分数随pH的变化Fig.6 Mole fraction of vanadium and iron anions as a function of pH at different total iron concentrations
在不同总铁浓度下,含钒(铁)中性分子、阳离子摩尔分数随pH变化情况分别如图7和图8所示。从图7 和图8 可知:在不同pH 范围内,含钒中性分子摩尔分数随总铁浓度变化不同;在pH=0~0.75时,含钒中性分子摩尔分数逐渐降低;在pH=1.00~3.00 时,含钒中性分子摩尔分数逐渐升高;在相同pH 下,随着总铁浓度从0.01 mol/L 升高至0.15 mol/L,含钒阳离子摩尔分数呈升高趋势,含铁中性分子摩尔分数逐渐降低,含铁阳离子摩尔分数逐渐升高。

图7 不同总铁浓度下含钒中性分子、阴离子摩尔分数随pH的变化Fig.7 Mole fraction of vanadium-containing neutral molecules and anions as a function of pH at different total iron concentrations

图8 不同总铁浓度下含铁中性分子、阴离子摩尔分数随pH的变化Fig.8 Mole fraction of iron-containing neutral molecules and anions as a function of pH at different total iron concentrations
3.4 总氟浓度对钒、铁离子分布的影响
固定总钒浓度为0.05 mol/L、总铁浓度为0.05 mol/L,当总氟浓度由0.25 mol/L 增加至0.75 mol/L 时,含钒、铁阴离子摩尔分数随pH 的变化如图9所示。从图9可见:随着总铁浓度的升高,含钒阴离子摩尔分数逐渐升高,pH50%逐渐降低,含铁阴离子摩尔分数变化依旧很小,当总氟浓度由0.25 mol/L逐渐升高至0.75 mol/L时,pH50%从2.171逐渐降低至0.943,总氟浓度升高使得钒铁实现有效分离的pH降低,在实际生产中有利于在调节pH时降低碱的用量。

图9 不同总氟浓度下含钒、铁阴离子摩尔分数随pH的变化Fig.9 Mole fraction of vanadium and iron anions as a function of pH at different concentrations of total fluorine
图10 和图11 所示分别为不同总氟浓度下,含钒(铁)中性分子、阳离子摩尔分数与pH 的关系。由图10 可知:当pH=0~0.50 时,含钒中性分子摩尔分数逐渐升高;当pH=0.50~1.50 时,含钒中性分子摩尔分数既有升高,也有降低;而当pH=1.00~3.00 时,含钒中性分子摩尔分数逐渐降低。结合图10和图11可知:在相同pH下,随着总氟浓度从0.25 mol/L 升高至0.75 mol/L,含钒阳离子摩尔分数呈降低趋势,含铁中性分子摩尔分数逐渐升高,含铁阳离子摩尔分数逐渐降低。综合总氟浓度对钒、铁离子摩尔分数分布的影响可以看出,氟浓度升高有利于降低pH50%,减少预处理过程中调节pH时碱的用量。
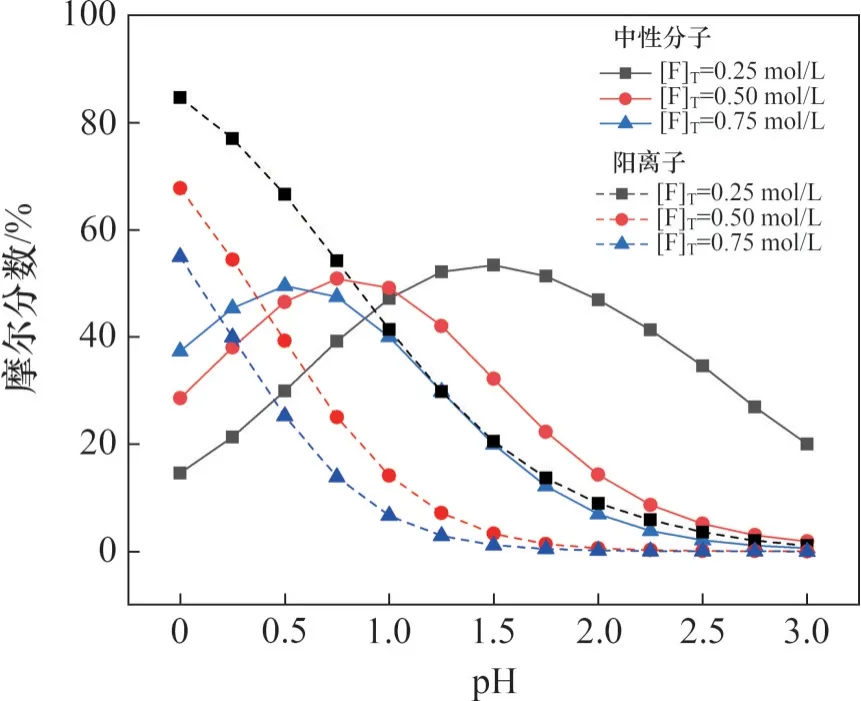
图10 不同总氟浓度下含钒中性分子、阴离子摩尔分数随pH的变化Fig.10 Mole fraction of vanadium-containing neutral molecules and anions as a function of pH at different concentrations of total fluorine

图11 不同总氟浓度下含铁中性分子、阴离子摩尔分数随pH的变化Fig.11 Mole fraction of iron-containing neutral molecules and anions as a function of pH at different concentrations of total fluorine
4 实际含氟酸性溶液中钒铁的分离特征
采用20% N235、10% TBP、70% DT-100(体积分数)为萃取有机相,用于萃取含钒溶液。萃取率计算公式为
式中:EM为M元素的萃取率(%);Ca,M为萃余液中M 元素浓度(mol/L);Va,M为萃余液体积(L);C0,M为萃原液中M 元素浓度(mol/L);V0,M为萃原液体积(L)。
萃取实验结果如图12 所示。从图12 可见:N235 作为阴离子型萃取剂,对阴离子的萃取效果比中性分子、阳离子的萃取效果更好。结合热力学分析,含钒阴离子摩尔分数随着pH的升高逐渐增加,且增加幅度较大,而含铁阴离子随pH的升高变化微小,并保持在较低值,溶液pH升高,采用阴离子型萃取剂可较好地提取钒,而将铁保留在溶液中。

图12 初始pH对钒、铁萃取率的影响Fig. 12 Effect of initial pH on extraction rate of vanadium and iron
由图3可知:在0<pH<3.00,pH大于1.236时,钒铁即可实现一定程度的分离,pH 越高,钒铁分离更完全。由图12可知:随着pH的升高,钒、铁的萃取率均升高,但钒萃取率升高幅度较大,而铁萃取率仅升高约5%,萃取率较低,此结果与热力学分析结果相吻合。同时,钒铁分离系数βV/Fe也随着pH 的升高而增大,当pH 从0.50 升高至1.61时,βV/Fe由2.69 升高至24.39,继续升高pH 至1.97时,βV/Fe急剧上升至122.86,比无氟硫酸浸出体系下的钒铁分离更为完全[16,30],此结果与热力学结果一致。钒、铁的萃取率和钒铁分离系数的标准差均较小,实验较为稳定,数据可靠。
5 结论
1) 在pH 为0~3.00 时,随着pH 升高,主要含钒离子由阳离子转变为阴离子、,主要含铁离子由阳离子FeF2+转变为中性分子FeF3(aq),基于此差异选择阴离子萃取剂选择性提取钒,为钒铁分离提供理论基础。
2) 溶液中钒浓度越高,pH50%越大;铁浓度越高,pH50%越大;而氟浓度增加,pH50%则越小。基于此变化,可通过加入一定量的氟降低钒铁分离所需的pH,减少调节pH的碱用量。
3) 采用N235 阴离子型萃取剂分离溶液中的钒、铁,可通过调节pH大于pH50%实现。pH越高,分离效果越好,这与热力学分析结果一致,且当pH 为1.97 时,钒铁分离系数βV/Fe可达122.86,可实现钒铁的较完全分离。
