氢气对HaCaT角质形成细胞增殖及炎症因子表达的影响
2023-07-06郭淑芬吴嘉惠刘伯言陈文文刘志超
郭淑芬 吴嘉惠 刘伯言 陈文文 耿 彪 刘志超
山东第一医科大学第二附属医院,泰安,271000
银屑病是一种常见的免疫介导的以角质形成细胞过度增殖、异常分化及炎症细胞浸润为主要特征的慢性炎症性皮肤病,全球发病率为0.1%~3%[1,2]。在银屑病中,以T细胞为主的免疫细胞浸润于皮肤局部,释放白细胞介素(IL)-17A、肿瘤坏死因子(TNF)-α、IL-23、IL-1β、IL-6等大量炎症因子促进角质形成细胞过度增殖,而过度增殖的角质形成细胞进而释放大量的细胞因子和趋化因子,以维持和放大炎症反应[3-5]。因此,减弱角质形成细胞过度增殖或/和炎症因子表达的策略被认为是银屑病潜在的治疗手段。
氢气(H2)是一种无色、无味且具有还原性的气体,其化学结构简单,分子量小,易于扩散,容易进入机体各部位。大量研究已经证实氢气对炎症性疾病有调控作用,在大多数炎症模型中,H2通过调节促炎细胞因子和抗炎细胞因子的水平来发挥抗炎作用[6,7,8]。我们前期探索性结果表明:氢气干预治疗斑块状银屑病,PASI75及 PASI90 应答率较传统治疗明显提高,肝肾功能未受影响,起到了良好的辅助治疗作用。据此,我们提出以下假说:氢气可能通过调控炎症因子的表达,抑制角质形成细胞的增殖及异常分化,从而起到治疗银屑病的作用。
HaCaT细胞是人永生化角质形成细胞,为进一步探索氢气作用于银屑病的靶点及可能机制,本实验以IL-17A、IL-22、肿瘤抑制素M、IL-1α和TNF-α的混合物M5[9]刺激HaCaT细胞,建立银屑病角质形成细胞过度增殖及炎症因子表达模型,探讨氢气对其影响,并与阿维A的作用进行对比分析,为氢气治疗银屑病提供科学理论依据和实验基础。
1 材料与方法
1.1 试剂与仪器 HaCaT细胞、HaCaT细胞专用培养基(MEM+15%FBS+1%P/S Solution)、胎牛血清购自武汉普诺赛生物科技有限公司,阿维A、胰蛋白酶-EDTA消化液购自北京索莱宝生物科技有限公司,IL-17A、IL-22、肿瘤抑制素M、IL-1α和TNF-α购自美国ProSpec公司,CCK-8试剂盒购自上海东仁化学科技有限公司,TRIzol试剂、HiFiScript cDNA Synthesis Kit(cDNA合成试剂盒)和UltraSYBR Mixture(实时荧光定量试剂盒)购自北京世纪康为生物科技有限公司。SpectraMax i3x多功能荧光酶标仪来自美国Molecular Devices公司,QuantStudio3实时荧光定量PCR仪来自美国ThermoFisher公司,PH-A2氢气细胞培养箱来自无锡恒缘生物医药技术有限公司。
1.2 方法
1.2.1 HaCaT细胞培养 HaCaT细胞培养于HaCaT细胞专用培养基中,置于饱和湿度、37℃、5% CO2培养箱内常规培养,取对数生长期细胞进行实验。
1.2.2 CCK-8法检测细胞增殖 细胞培养结束后取出96孔板,CCK-8法检测各孔吸光度:每孔更换新鲜培养基并加入10 μL CCK-8溶液,培养箱中反应3 h,酶标仪检测各孔在450 nm处的吸光度。
1.2.3 氢气干预正常HaCaT细胞 将HaCaT细胞以15000个/mL接种至96孔培养板,每孔100 μL,置于37℃、5% CO2培养箱内培养24 h,后将细胞分别放入0%、25%、50%浓度氢气培养箱(37℃、5% CO2)中培养72 h。培养结束后用CCK-8法检测各孔吸光度。
1.2.4 M5诱导HaCaT细胞过度增殖 将HaCaT细胞以15000个/mL接种至96孔培养板,每孔100 μL,置于37℃、5% CO2培养箱内培养24 h待细胞贴壁。后将细胞培养液分别更换成含有0、2.5、5、10 ng/mL M5的细胞培养液,分别培养24、48、72 h。培养结束后用CCK-8法检测各孔吸光度。
1.2.5 实验分组处理 将HaCaT细胞以15000个/mL接种至96孔与6孔培养板(每孔分别为100 μL及3 mL),置于37℃、5% CO2培养箱内培养24 h。后将HaCaT细胞分为4组,Control组用含0 ng/mL M5的细胞培养液培养72 h,Model组用含2.5 ng/mL M5的细胞培养液培养72 h,H2组在Model组基础上将细胞放入25%氢气培养箱中培养72 h,Acitretin组在Model组基础上加10 μmol/L阿维A培养72 h。
1.2.6 qRT-PCR检测KRT6、IL-1β、IL-6和TNF-α的mRNA表达水平 培养结束后取出6孔培养板,按照说明书使用TRIzol试剂从细胞中提取总RNA,逆转录为cDNA,荧光定量,PCR仪检测样品的CT值(反应过程为95°C预变性10 min,95℃变性15 s,60℃延伸1 min,变性延伸共40个循环),GAPDH作为内参,2-ΔΔCt法计算mRNA相对表达量。引物序列如下:
KRT6:5′-GGGTTTCAGTGCCAACTCAG-3′ (正向引物)
5′-CCAGGCCATACAGACTGCGG-3′ (反向引物)
IL-1β:5′-ATGATGGCTTATTACAGTGGCAA-3′ (正向引物)
5′-GTCGGAGATTCGTAGCTGGA-3′ (反向引物)
IL-6:5′-ACTCACCTCTTCAGAACGAATTG-3′ (正向引物)
5′-CCATCTTTGGAAGGTTCAGGTTG-3′ (反向引物)
TNF-α:5′-CCTCTCTCTAATCAGCCCTCTG-3′ (正向引物)
5′-GAGGACCTGGGAGTAGATGAG-3′ (反向引物)
GAPDH:5′-CACATGGCCTCCAAGGAGTAA-3′ (正向引物)
5′-TGAGGGTCTCTCTCTTCCTCTTGT-3′ (反向引物)
2 结果
2.1 氢气干预对正常HaCaT细胞增殖的影响 为了探究不同氢气浓度干预是否影响正常HaCaT细胞,本实验采用CCK-8法检测了不同氢气浓度(0%、25%、50%)干预72 h对正常HaCaT细胞增殖的影响。由图1可知,与无氢气相比,25%、50%浓度氢气干预72 h后细胞吸光度相对值分别为(100.51±6.98)%、(103.04±5.22)%,各组之间无显著差异,表明不同浓度氢气对正常HaCaT细胞无明显影响。本实验选用25%氢气浓度进行后续研究。
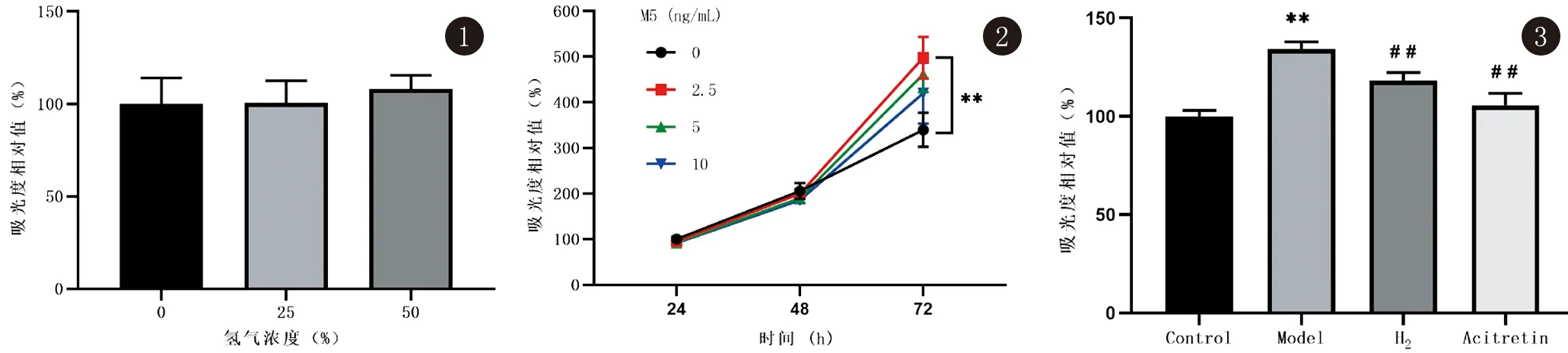
图1 不同浓度氢气干预72 h后HaCaT细胞增殖情况 图2 不同浓度M5诱导不同时间后HaCaT细胞增殖情况(**:P<0.01) 图3 不同干预方式对HaCaT细胞增殖的影响(**:vs Control,P<0.01;##:vs Model,P<0.01)
2.2 M5诱导HaCaT细胞过度增殖模型的建立 为了确定建立HaCaT细胞过度增殖模型的药物浓度及时间,本实验选用不同浓度M5(0、2.5、5、10 ng/mL)对HaCaT细胞进行24 h、48 h及72 h干预,并用CCK-8法检测细胞增殖。由图2可知,随着时间的延长,各种细胞增殖活性逐渐提高。在第72 h,与正常生长的细胞相比(M5 0 ng/mL),2.5 ng/mL M5刺激下细胞增殖显著提高(P<0.01),由此确定M5的造模浓度及时间为2.5 ng/mL刺激72 h。
2.3 氢气干预对M5刺激的HaCaT细胞增殖的影响 由图3可知,经过2.5 ng/mL的M5刺激72 h,细胞吸光度相对值显著提高(Model vs Control,P<0.01),表明HaCaT细胞过度增殖。与Model组相比,25%氢气干预可以显著降低细胞吸光度相对值(P<0.01),抑制HaCaT细胞过度增殖。与Model组相比,阳性药物阿维A干预的Acitretin组也显著抑制了细胞增殖(P<0.01)。
2.4 氢气干预对角质形成细胞过度增殖标记因子KRT6 mRNA表达的影响 KRT6被认为是角质形成细胞过度增殖的标记因子[10,11]。如图4a所示,与Control组相比,Model组KRT6的mRNA表达显著升高(P<0.001);与Model相比,25%的氢气干预及阳性药物阿维A干预对KRT6 的mRNA表达具有一定抑制作用(均P<0.001)。

图4 不同干预方式对KRT6、IL-1β、IL-6和TNF-αmRNA表达水平的影响(*** :vs Control,P<0.001;##:vs Model,P<0.01;###:vs Model,P<0.001)
2.5 氢气干预对炎症因子IL-1β、IL-6和TNF-α mRNA表达的影响 IL-1β、IL-6和TNF-α是促进银屑病发生发展的炎症因子[3-5]。与Control组相比,Model组炎症因子IL-1β、IL-6和TNF-α的mRNA表达均显著升高(均P<0.001);与Model组相比,25%氢气干预对过度增殖的HaCaT细胞上述mRNA的表达均呈现出一定的抑制作用(P<0.01或P<0.001)。阳性对照药物阿维A对相关炎症因子的mRNA表达也起到显著抑制作用(均P<0.01)。见图4。
3 讨论
银屑病是一种由多种细胞介导的复杂炎症性皮肤病,包括角质形成细胞、T细胞、内皮细胞、巨噬细胞和树突状细胞[12]。角质形成细胞是皮肤的结构细胞,在银屑病发病过程中既是参与者又是受害者。角质形成细胞增殖和凋亡之间的平衡是维持皮肤稳态的关键,银屑病发病过程中,角质形成细胞凋亡减少,导致细胞过度增殖[13,14],过度增殖的角质形成细胞又会表达大量的细胞因子来维持和放大炎症反应[3-5]。
IL-1是天然免疫和炎症反应的重要介质,IL-1β具有促炎效应,放大炎症级联反应参与银屑病的发生过程[15]。IL-6是调控多种细胞因子表达的重要诱导因子,参与了表皮和真皮细胞的生长和分化[16],IL-6异常升高将导致Treg细胞和Th17细胞之间的平衡紊乱,从而促进银屑病的发生[17]。最新研究[18]发现,银屑病患者血清IL-6浓度与患者的血沉、皮损面积及PASI指数正相关,且血清IL-6水平高的银屑病患者更容易发生关节损害,可作为银屑病炎性活动的指标。TNF-α在银屑病的发病机制中处于关键地位,可作为银屑病潜在的生物标志物和治疗反应指标[19],针对TNF-α进行干预治疗银屑病被证明是有效的,是银屑病靶向治疗的重要策略[20]。因此,减轻角质形成细胞过度增殖或/和炎症因子表达是治疗银屑病的热点之一。
氢气(H2)是一种安全、无毒的强抗氧化剂,具有选择性抗炎、抗氧化作用。已有研究表明,H2可通过调控 NF-κB、MAPK 等信号通路,降低促炎症因子 TNF-α、IL-1β、IL-6、IL-12、IL-17、IL-23、干扰素-γ[21]等的释放而发挥抗炎、抗氧化应激作用。而这些信号通路在银屑病的发病中亦起着关键作用。近年来有关氢气治疗银屑病的研究不断报道。Zhu等报道,在氢水中洗澡可以显著改善患者的银屑病皮损[22]。另一项针对银屑病相关关节炎和皮损患者的临床研究也显示,氢气治疗后炎症减轻[23]。氢气在各种损伤模型中可通过抑制炎症因子(如L-1β、IL-6、TNF-α等),表现出抗炎活性[24]。因此,氢气的使用可能成为一种新型的安全的皮肤疾病疗法,改善银屑病皮损,提高患者的生活质量。
本研究通过体外试验初步发现,M5诱导72 h后HaCaT细胞增殖及KRT6、IL-1β、IL-6、TNF-α的mRNA 表达水平明显升高;氢气干预后上述指标显著降低,表明氢气能够抑制银屑病角质形成细胞模型过度增殖及IL-1β、IL-6、TNF-α等炎症因子的表达。
综上认为,氢气可能是通过抑制银屑病角质形成细胞的过度增殖及IL-1β、IL-6、TNF-α等炎症因子的表达而发挥治疗银屑病的作用,但其具体机制及信号通路有待进一步探索。
