刺槐素调控NF-κB/NFATc1信号轴抑制破骨细胞分化的机制研究
2023-07-06陈真顾娉郡何安妮雷新环郭宇华章礼炜
陈真 顾娉郡 何安妮 雷新环 郭宇华 章礼炜
机体骨骼系统的稳态有赖于成骨细胞的骨形成作用与破骨细胞的骨吸收作用之间的动态平衡。若出现成骨细胞数目下降、成骨能力减弱,或破骨细胞数目增多、破骨能力增强,可导致机体骨密度和骨质量下降、骨微结构破坏、骨脆性增加等,最终引发骨质疏松症或继发性骨破坏的发生[1]。骨质疏松性骨折是骨质疏松症最严重的后果,预计我国2050 年主要骨质疏松性骨折(腕部、椎体和髋部)约达599 万例次,单单由此产生的医疗费用将高达1 630 亿元[2]。双膦酸盐(如唑来膦酸、阿仑膦酸钠)可靶向抑制骨吸收,甲状旁腺激素类似物(如特立帕肽)可促进骨形成,雌激素替代疗法可抑制破骨细胞驱动的骨吸收和降低骨重塑率,均被广泛应用于骨质疏松症防治领域,但这些药物往往伴随着诸如一过性发热、胃肠道不适、心血管风险等不良反应[3]。目前,针对骨质疏松症防治的研究已成为国内外的热点之一。刺槐素是一种提取自豇豆等植物的天然黄酮类化合物,具有抗肿瘤、抗炎等药理作用[4],但在骨代谢中的作用尚缺乏相关报道。既往研究显示,NF-κB 受体活化因子配体(recep‐tor activator of NF-κB ligand,RANKL)刺激下NF-κB/活化T-细胞核因子1(nuclear factor of activated T cells c1,NFATc1)信号轴的激活,在破骨细胞分化过程中发挥着重要作用[5]。与此同时,刺槐素可在细胞内发挥抑制NF-κB 信号通路的作用,而该通路是RANKL 结合NF-κB 受体活化因子(receptor activator of NF-κB,RANK)受体后重要的下游信号通路之一[6]。本研究旨在探讨刺槐素对破骨细胞分化过程的影响,并明确其作用机制是否与NF-κB/NFATc1 信号轴有关。
1 材料和方法
1.1 实验动物 6~8 周龄SPF 级C57BL/6 小鼠20 只,购于上海杰思捷实验动物有限公司[生产许可证号:SCXK(沪)2018-0004],饲养于浙江省台州医院公共科研平台SPF 动物房[使用许可证号:SYXK(浙)2019-0030]。小鼠在室温20~25 ℃,湿度40%~60%,24 h 自然光暗循环条件下饲养,不限制饮水及进食。本研究相关动物饲养及操作已获得本院动物伦理委员会审查通过(批准文号:tzyy-2019033)。
1.2 试剂和仪器 刺槐素(货号:HY-N1346)购于美国MedChemExpress 公司,高速离心后使用二甲基亚砜(货号:ST038,上海碧云天生物技术有限公司)溶解制成100 mmol/L 母液,分装后置于-80 ℃冰箱保存。巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)(货号:315-02)购于美国Peprotech 公司;RANKL(货号:P00226)、总RNA 提取试剂(货号:R1100)均购于北京索莱宝科技有限公司;α-改良型MEM 完全培养基(货号:SH30265.01)购于美国Hy‐clone 公司;澳洲特级FBS(货号:10099-141)购于美国Gibco 公司;细胞计数试剂盒-8(cell count kit 8,CCK-8)试剂盒(货号:K1018)购于美国APExBIO 公司;cDNA 第一链合成试剂盒(货号:R123-01)、SYBR Green 荧光实时定量PCR 试剂盒(货号:Q121-02)均购于南京诺唯赞生物科技股份有限公司;PBS(货号:C0221)、胰酶细胞消化液(货号:C0201)、青霉素-链霉素双抗溶液(货号:C0222)、DAPI 染色液(货号:C1005)、非离子性去垢剂Triton X-100(货号:ST795)、牛血清白蛋白(bovine serum albumin,BSA)(货号:ST2249)、BCA 蛋白浓度测定试剂盒(货号:P0010)、超敏ECL 化学发光试剂盒(货号:P0018)、Tris 缓冲+聚山梨酯-20 洗涤液(TBSTw)(货号:ST671)均购于上海碧云天生物技术有限公司;抗酒石酸酸性磷酸酶(tar‐trate resistant acid phosphatase,TRAP)染色试剂盒(货号:BZ-OC02)购于苏州必中生物科技有限公司;鬼笔环肽(FITC 标记,货号:MF8203)购于上海维琨生物科技有限公司;p65 抗体(货号:8242,兔抗)、Ser536位点磷酸化p65(phosphorylation-p65Ser536,p-p65Ser536)抗体(货号:3033,兔抗)、甘油醛-3-磷酸脱氢酶(glyceralde‐hyde-3-phosphate dehydrogenase,GAPDH)抗体(货号:5174,兔抗)均购于美国Cell Signaling Technology 公司。HRP 标记的山羊抗兔IgG 抗体(货号:GB23303)购于湖北武汉赛维尔生物科技有限公司;NFATc1(货号:ab25916,兔抗)、基质金属蛋白酶-9(matrix metallopro‐teinase-9,MMP-9)(货号:ab228402,兔抗)抗体均购于英国Abcam 公司。Multiskan SkyHigh 全波长酶标仪购于美国Thermo Fisher 公司;ABI 7500 实时荧光定量PCR 仪购于美国Applied Biosystems 公司;DM IL LED倒置实验室显微镜购于德国Leica 公司;ChemiDoc Touch 化学发光成像系统购于美国Bio-Rad 公司。
1.3 方法
1.3.1 小鼠骨髓来源单核巨噬细胞(bone marrow-de‐rived monocyte/macrophage,BMMs)提取与培养 将小鼠麻醉后脱颈处死,分离小鼠双下肢踝关节、膝关节、髋关节,取出胫骨、股骨放置于装有PBS 的细菌皿中,剔净骨表面残留物,并漂洗,随后剪去股骨近端、胫骨远端小部分骨组织以暴露骨髓腔。使用1 ml 针筒抽取PBS 反复冲洗骨髓腔,将得到的骨髓使用α-改良型MEM 完全培养基重悬后1 500 r/min 离心4 min,倒掉上清液后使用含30 ng/ml M-CSF 的完全培养基重悬,接种于10 cm 细胞培养皿中,过夜。第2 天去除细胞培养皿中的培养液,并用无菌PBS 冲洗3 次,加入适量含30 ng/ml M-CSF 的完全培养基,将仍贴壁的细胞继续培养2 d,可见细胞呈短梭形,密度80%~90%。随后去除培养液并使用PBS 冲洗3 次,胰酶消化,计数后备用,即为BMMs。后续BMMs 培养均使用含30 ng/ml M-CSF 的完全培养基,进行破骨分化诱导时采用含50 ng/ml RANKL、30 ng/ml M-CSF 的完全培养基。
1.3.2 BMMs增殖活性检测 采用CCK-8法。将BMMs按0.4×104细胞/孔的密度种于96 孔板,设置1 个对照组和9 个浓度(0.25、0.5、1、2、5、10、25、50、100 μmol/L)刺槐素处理组,共10 组,每组3 个重复孔。待细胞过夜贴壁后,将孔内液体更换为对应组别包含不同浓度刺槐素的完全培养基进一步培养,隔天换液1 次。分别培养48、72、96 h 后,向每孔中加入10 μl CCK-8试剂,于细胞培养箱中继续培养2 h,使用酶标仪测定各孔450 nm波长处吸光度(optical density,OD)值。
1.3.3 BMMs 破骨分化诱导 将BMMs 分别按10×104、40×104细胞/孔的密度种于24、6 孔板内。过夜贴壁后,使用破骨诱导培养基(完全培养基+50 ng/ml RANKL +30 ng/ml M-CSF)进行破骨分化诱导,隔天换液。在破骨分化诱导过程中,第4 天可在显微镜下观察到BMMs 开始汇聚、融合,出现3 个细胞核以上的细胞,第6 天观察到边界清晰、巨大、煎饼样的成熟破骨细胞。
1.3.4 BMMs 破骨分化能力检测 采用TRAP 染色。TRAP 作为破骨细胞特征性标志酶,分布于细胞质中,可反映破骨细胞活性和骨吸收状态。经过6 d 破骨细胞诱导分化后,对照组中可出现大量边界清晰、巨大、煎饼样的成熟破骨细胞。此时,吸去24 孔板中各个培养孔中的培养基,PBS 冲洗1 遍后加入500 μl 4%多聚甲醛固定细胞10 min,随后PBS 冲洗2 遍,按照试剂盒说明书进行TRAP 染色。随后使用倒置显微镜观察并拍照,TRAP 阳性且细胞核数目≥3 个的细胞计为破骨细胞,并通过Image J 软件进行破骨细胞相对大小的计算,破骨细胞相对大小=各组破骨细胞大小/溶剂对照组中破骨细胞大小的平均值。
1.3.5 破骨细胞特征结构伪足小体检测 采用破骨细胞伪足小体免疫荧光染色。伪足小体是构成成熟破骨细胞在非矿化界面上所形成的封闭带状结构的重要组成部分,发挥着黏附、力学感知等功能。经过6 d破骨细胞诱导分化后,可在成熟破骨细胞周围观察到较为立体、边界清晰的封闭带状结构,吸去24 孔板中各个培养孔中的培养基,PBS 冲洗1 遍后加入300 μl 4%多聚甲醛固定细胞10 min,随后PBS 冲洗2 遍。在染色阶段,首先向每孔加入300 μl 含0.1% Triton X-100的PBS 溶液,室温孵育3 min 进行胞膜通透,PBS 冲洗2 遍后加入300 μl 含1% BSA 的PBS 溶液进行封闭20 min。随后PBS 冲洗2 遍后加入200 μl 含1%鬼笔环肽的PBS 溶液避光孵育20 min 后,再次使用PBS 冲洗2 遍。最后加入200 μl DAPI 染色液避光孵育3 min后,使用PBS 冲洗2 遍并置于倒置荧光显微镜中拍照。此外,在评价破骨细胞活性的指标中,单个伪足小体所围成的封闭带(即单个破骨细胞)内所含细胞核数目与破骨细胞的大小、活性密切相关。基于各组免疫荧光染色结果,计算统计单个破骨细胞内所含细胞核数目,以反映破骨细胞成熟度。
1.3.6 BMMs 破骨分化过程中核心转录因子NFATc1及相关特征基因耐酒石酸酸性磷酸酶(acid phospha‐tase 5,tartrate resistant,ACP5)、破骨细胞相关受体(os‐teoclast associated receptor,OSCAR)、组织蛋白酶K(ca‐thepsin K,CTSK)、MMP-9 mRNA 表达水平检测 采用qRT-PCR 法。将BMMs 按40×104细胞/孔的密度种于6 孔板,过夜贴壁后,将培养基更换为含有对应组别药物的破骨诱导分化完全培养基,进行破骨诱导,隔天换液。6 d 后吸去各个培养孔中的培养基,预冷的PBS冲洗1 次后每孔加入500 μl 总RNA 提取试剂,置于冰上按说明书提取细胞总RNA。RNA 样品使用RNA/DNA 紫外可见光度法定量测定浓度后,使用cDNA 第一链合成试剂盒反转录合成cDNA(1 μg RNA,使用20 μl 反转录体系,反应结束后使用双蒸水稀释至100 μl 备用)。后续qPCR 所用引物序列如下:NFATc1上游:5'-CAACGCCCTGACCACCGATAG-3',下游:5'-GGCTGCCTTCCGTCTCATAGT-3';ACP5 上游:5'-TGT‐GGCCATCTTTATGCT- 3',下游:5'- GTCATTTCTTT‐GGGGCTT-3';OSCAR 上游:5'-CTGCTGGTAACGGAT‐CAGCTCCCCAGA-3',下游:5'-CCAAGGAGCCAGAACCTTCGAAACT-3';CTSK 上游:5'-ACGGAGGCATT‐GACTCTGAAGATG-3',下游:5'-GGAAGCACCAAC‐GAGAGGAGAAAT-3';MMP-9 上游:5'-GTCCAGAC‐CAAGGGTACAGC-3',下游:5'-ATACAGCGGGTACAT‐GAGCG-3';18S 核糖体RNA 上游:5'-CGGCTACCA‐CATCCAAGGAA-3',下游:5'-GCTGGAATTACCGCG‐GCT-3'。所使用的qPCR反应体系为20 μl(SYBR Green 10 μl,cDNA 2 μl,前后链引物mix 0.5 μl,ddH2O 7.5 μl),反应条件为95 ℃5 min 预变性,随后95 ℃10 s 变性,65 ℃30 s 扩增共循环40 次。分析结果时,以18S核糖体RNA为内参,使用2-ΔΔCt法计算各个基因转录水平的相对表达水平。
1.3.7 BMMs 破骨分化过程中NFATc1、MMP-9、pp65Ser536、p65 蛋白表达水平检测 采用Western blot 法。为了进一步明确刺槐素抑制BMMs 破骨分化的作用及机制,本研究收集BMMs 破骨诱导分化第0、4、6 天时对照组、2 μmol/L 刺槐素处理组的蛋白样本,用于检测NFATc1、MMP-9 蛋白表达水平。与此同时,本研究也收集了对照组及2 μmol/L 刺槐素处理组(预处理2 h)BMMs 在RANKL 刺激下第0、5、15、30、60 分钟时的蛋白样本,用于检测p-p65Ser536、p65 的表达水平,以评估刺槐素对RANKL 刺激下NF-κB 信号通路活性的影响。所收集的各组细胞吸弃培养液后使用PBS清洗1次,分别加入150 μl 蛋白裂解液后在冰上静置10 min。随后将蛋白裂解液以12 000 r/min 离心15 min,取上清液并测定总蛋白浓度。将所配得的蛋白体系通过10%分离胶跑开后,在300 mA 恒定电流下转膜90 min,用5%脱脂奶粉封闭2 h,分别加入一抗MMP-9(1∶1 000)、NFATc1(1∶1 000)、p-p65Ser536(1∶1 000)、p65(1∶1 000)、GAPDH(1∶5 000)在4 ℃冰箱中孵育过夜。第2 天取出孵育盒后使用TBSTw 洗涤3 次,10 min/次,在相应的二抗中孵育2 h,再次用TBSTw 洗3 次,曝光、显影,得到对应条带,并使用Image J 软件评估各个泳道的灰度值进行分析。蛋白相对表达水平=各组灰度值/第1 泳道对照组平均灰度值。
1.4 统计学处理 采用SPSS 18.0 统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 刺槐素对BMMs 增殖活性的影响 在使用不同浓度刺槐素处理BMMs 细胞48 h 后,10 μmol/L 刺槐素处理组OD450值由对照组的0.80±0.03 降低至0.62±0.04(P<0.01);72 h 后,5 μmol/L 刺槐素处理组OD450值由对照组的1.39±0.05 降低至1.16±0.05(P<0.01);96 h 后,5 μmol/L 刺槐素处理组OD450值由对照组的1.81±0.05 降低至1.38±0.05(P<0.01),见图1。CCK-8 实验提示5 μmol/L 及以上浓度的刺槐素可显著抑制BMMs 增殖活性,而2 μmol/L 及以下浓度的刺槐素对BMMs 无明显毒性。
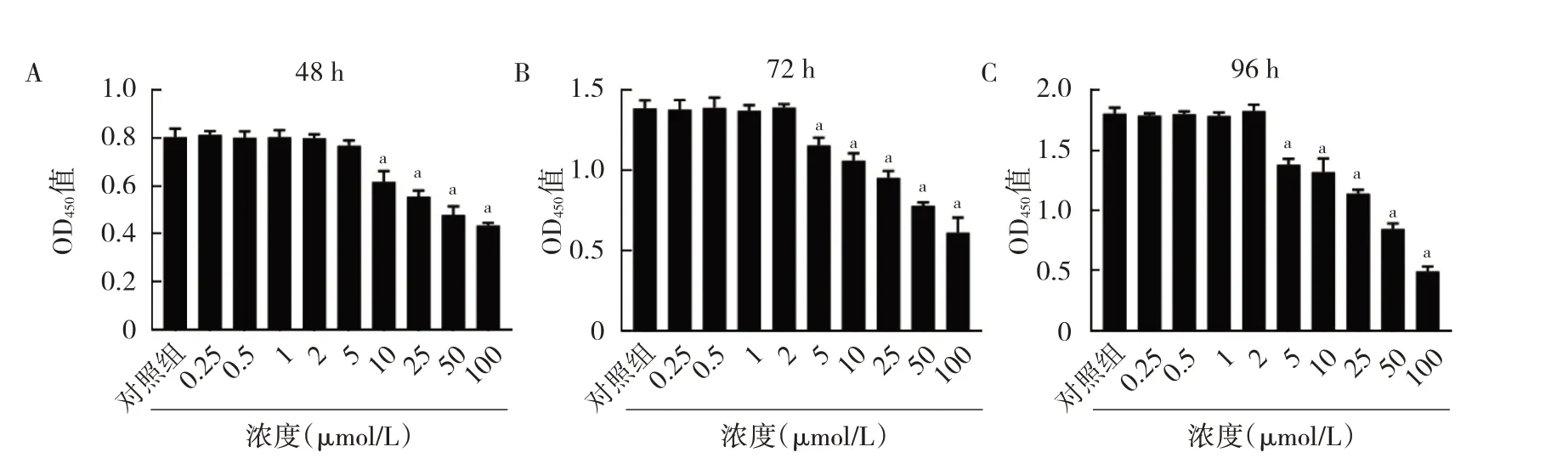
图1 刺槐素对BMMs 增殖活性的影响(A:不同浓度刺槐素处理48 h 后对BMMs 增殖活性的影响;B:不同浓度刺槐素处理72 h 后对BMMs 增殖活性的影响;C:不同浓度刺槐素处理96 h 后对BMMs 增殖活性的影响)
2.2 刺槐素对BMMs 破骨分化的影响 通过检测刺槐素对BMMs 增殖活性的影响,发现2 μmol/L 及以下浓度的刺槐素对BMMs 增殖无明显抑制作用,随后进一步探究了刺槐素在无细胞毒性的浓度范围内对BMMs 破骨分化的影响。在1、2 μmol/L 刺槐素处理下,BMMs 破骨分化受到了明显的抑制,见图2A(插页)。进一步统计分析显示,与对照组破骨细胞数目(186.67±7.51)个/孔比较,1 μmol/L 刺槐素处理组减少至(105.67±8.62)个/孔,而2 μmol/L 刺槐素处理组中仅有(28.67±4.51)个/孔,差异均有统计学意义(均P<0.01),见图2B(插页)。为进一步明确刺槐素对BMMs 破骨分化的抑制作用,本实验统计了破骨细胞相对大小,与对照组的1.00±0.11 比较,1 μmol/L 刺槐素处理组破骨细胞相对大小减少至0.27±0.04,而2 μmol/L 刺槐素处理组中仅为0.05±0.01,差异均有统计学意义(均P<0.01),见图2C(插页)。

图2 刺槐素对BMMs 破骨分化的影响(A:刺槐素对BMMs 破骨分化影响的TRAP 染色图,×50;B:刺槐素对BMMs 破骨分化过程中破骨细胞数目的影响,与对照组比较,aP<0.01;C:刺槐素对BMMs 破骨分化过程中破骨细胞相对大小的影响,与对照组比较,aP<0.01)
2.3 刺槐素对BMMs 破骨分化过程中伪足小体形成的影响 破骨细胞伪足小体免疫荧光染色提示在1 μmol/L 刺槐素处理下,伪足小体所围成的封闭带(即破骨细胞)数目较对照组明显减少,而在2 μmol/L 刺槐素处理组中仅有少量封闭带形成,见图3A(插页)。进一步统计分析显示,与对照组的(50.29±8.56)个比较,1 μmol/L 刺槐素处理组单个破骨细胞内所含细胞核数目降低至(10.86±2.41)个,而在2 μmol/L 刺槐素处理组中仅为(3.43±0.79)个,差异均有统计学意义(均P<0.01),见图3B(插页)。
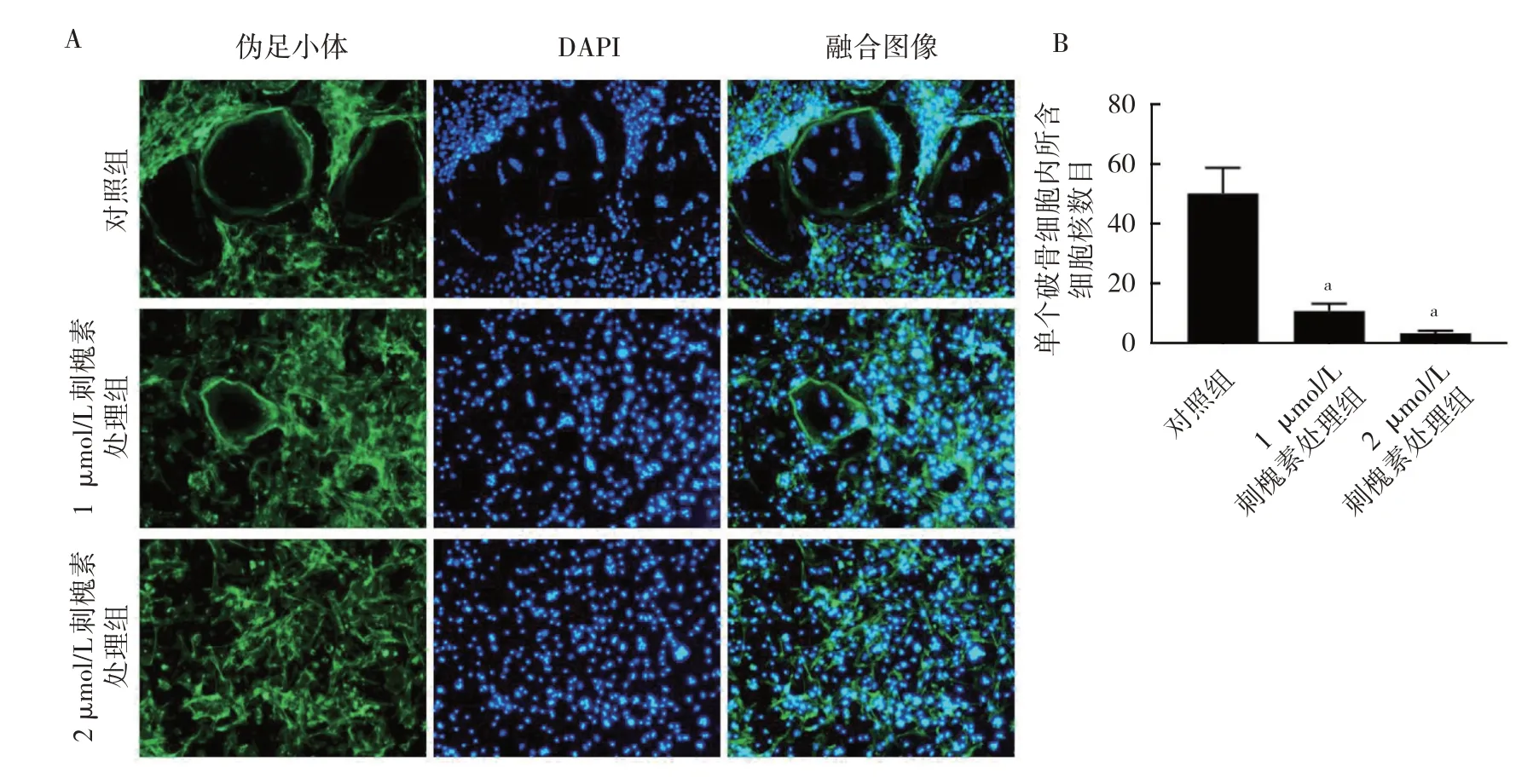
图3 刺槐素对BMMs 破骨分化过程中伪足小体生成的影响(A:刺槐素对BMMs 破骨分化过程中伪足小体生成影响的破骨细胞伪足小体免疫荧光染色图,×100;B:刺槐素对BMMs 破骨分化过程中单个破骨细胞内所含细胞核数目的影响,与对照组比较,aP<0.01)
2.4 刺槐素对BMMs 破骨分化过程中核心转录因子及特征基因mRNA 表达水平的影响 在刺槐素处理后,与对照组比较,1 μmol/L 刺槐素处理组、2 μmol/L刺槐素处理组破骨分化核心转录因子NFATc1 和ACP5、OSCAR、CTSK、MMP-9 mRNA 表达水平均下调(均P<0.01),见图4。
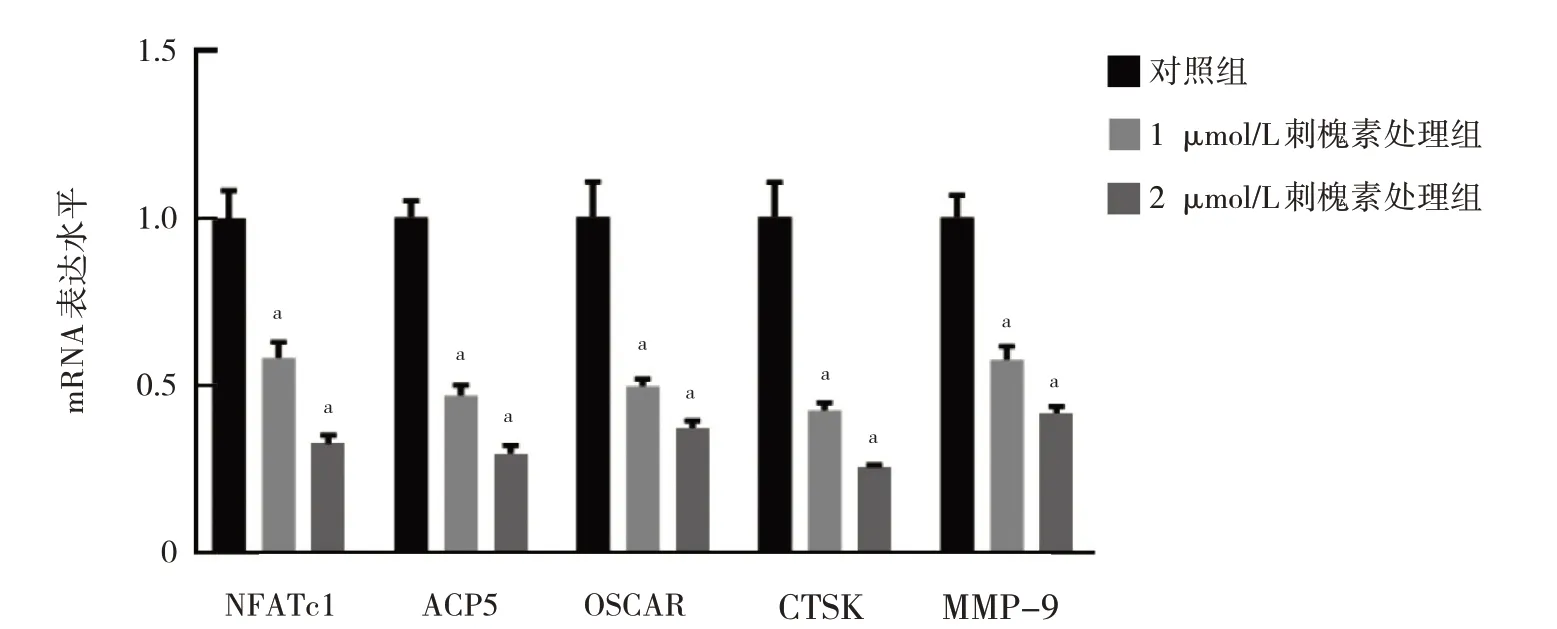
图4 刺槐素对BMMs 破骨分化过程中核心转录因子及特征基因mRNA 表达水平的影响
2.5 刺槐素对BMMs 破骨分化过程中核心转录因子NFATc1、特征蛋白MMP-9 表达和NF-κB 信号通路活性的影响 随着RANKL 处理时间的增加,对照组中NFATc1、MMP-9 蛋白表达水平逐渐升高,第6 天时表达水平最高。而在2 μmol/L 刺槐素处理下,第4、6 天时2 μmol/L 刺槐素处理组中NFATc1、MMP-9 表达水平均较对照组降低,结合前述qRT-PCR 结果,进一步提示刺槐素可通过降低RANKL 刺激下BMMs 细胞内NFATc1、MMP-9 的表达,抑制其破骨分化过程,见图5。随后本研究进一步检测刺槐素是否可以影响RANKL 刺激下NF-κB 信号通路中p65Ser536磷酸化过程。RANKL 刺激下可显著引起对照组中BMMs 内p65Ser536位点的磷酸化,以第5、15 分钟最为明显。而在使用2 μmol/L 刺槐素预处理2 h 后,BMMs 内p65Ser536位点在RANKL 刺激下的磷酸化水平较同时间对照组出现显著抑制,见图6。本部分实验结果提示,刺槐素可通过下调RANKL 刺激下NF-κB 信号通路活性及其下游核心转录因子NFATc1 的表达,从而抑制BMMs 破骨分化过程。

图5 刺槐素对BMMs 破骨分化过程中核心转录因子NFATc1、特征蛋白MMP-9 表达的影响(A:对照组及2 μmol/L 刺槐素处理组BMMs 进行破骨诱导第0、4、6 天后NFATc1、MMP-9 蛋白表达的电泳图;B:对照组及2 μmol/L 刺槐素处理组BMMs 进行破骨诱导第0、4、6 天后NFATc1、MMP-9 蛋白表达水平比较,与对照组比较,a P<0.05,b P<0.01)
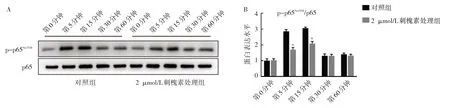
图6 刺槐素对BMMs 在RANKL 刺激下NF-κB 信号通路活性的影响(A:对照组及2 μmol/L 刺槐素预处理组BMMs 在RANKL 刺激第0、5、15、30、60 分钟后p65Ser536位点磷酸化及总p65 表达的电泳图;B:对照组及2 μmol/L 刺槐素预处理组BMMs 在RANKL 刺激第0、5、15、30、60 分钟后p65Ser536位点磷酸化表达水平比较,与对照组比较,a P<0.01)
3 讨论
破骨细胞作为体内一种高度分化的终末细胞,是体内唯一可以进行骨吸收的细胞,以TRAP 阳性且细胞核数目≥3 个为显著特征。当配体RANKL 与细胞表明的受体RANK 结合后,可触发肿瘤坏死因子受体相关因子6,引发下游丝裂原活化蛋白激酶信号通路(p38、JNK、ERK)、NF-κB 等信号通路的激活。在NFκB 信号通路中,NF-κB 抑制物激酶(IκB kinase,IKKs)被激活,活化的IKKs(IKKα 和IKKβ)可使NF-κB 特异性抑制因子IκB 特定部位的丝氨酸磷酸化,激活NFκB(p50 和p65 特定位点磷酸化)。活化的NF-κB 转移到细胞核内,p50 和p65 引起原癌基因蛋白(c-fos)、NFATc1 表达增加,c-fos 与NFATc1 相互作用,引起更下游破骨细胞相关基因的转录。正常情况下,NF-κB以p65-p50 异二聚体的形式存在于细胞质中,两个亚基于N 端共享一个同源区,以确保其二聚化并与DNA结合,同源区内同时也包含核定位信号(nuclear local‐ization signal,NLS)[4-6]。在经典的NF-κB 信号通路中,NF-κB 在静息状态下与细胞质中IκBα 结合而处于非活化状态,同源区的NLS 也被IκBα 所掩盖。当细胞受到外界信号刺激后,胞质中异三聚体IκB 激酶(IKK1、IKK2、IKKγ)激活并磷酸化IκBα N 端2 个丝氨酸残基,随后E3 泛素连接酶识别该残基并使IκBα 发生多聚泛素化,进而被泛素依赖性蛋白酶体降解。伴随着IκBα 的降解,NF-κB 暴露出NLS 后转位进入细胞核内激活下游基因的转录[7-8]。
既往文献报道刺槐素具有抗炎、抗氧化、预防心血管疾病、保护胃肠道黏膜及抗诱变等多种作用[4]。在体内外抗肿瘤作用方面,刺槐素可抑制肿瘤细胞生长与增殖、诱导肿瘤细胞凋亡、抑制肿瘤侵袭转移、调节免疫与端粒位置效应、逆转多药耐药[9]。Janeesh等[10]研究发现刺槐素在mRNA 水平抑制氧化型低密度脂蛋白诱导的Toll 样受体(Toll-like receptor,TLR)2 和TLR4 表达,并通过调节TLR-NF-κB 信号通路抑制NF-κB p65 的易位,从而抑制细胞因子的产生并下调炎症酶如环氧合酶、脂氧合酶、一氧化氮合酶和前列腺素E2。钱艳等[11]研究表明刺槐素可通过抑制NF-κB信号通路活化减少TNF-α 诱导气道平滑肌细胞表达、分泌单核细胞趋化蛋白1。刺槐素具有多种较为有效的药理作用,但其在骨代谢相关领域的功能国内外尚未研究。本研究利用TRAP 染色发现刺槐素可在无明显细胞毒性的浓度区间内(1 及2 μmol/L)浓度依赖性地抑制BMMs 在RANKL 诱导下的破骨细胞分化。在BMMs 破骨分化过程中,伪足小体的形成及结构完整性直接影响着破骨细胞的分化及其骨吸收活性,且伪足小体主要由肌动蛋白组成,可被鬼笔环肽特异性结合而在荧光显微镜中显影。在TRAP 染色的基础之上,本研究进一步利用破骨细胞伪足小体免疫荧光染色明确了刺槐素对伪足小体形成过程中的抑制作用,并显著降低单个破骨细胞内所含细胞核数目,减少了破骨细胞分化的成熟度。最后,利用Western blot 法发现在刺槐素处理下,NF-κB 信号通路中p65 蛋白在Ser536 位点的磷酸化水平得到显著的抑制,进而下调了下游核心转录因子NFATc1 和特征蛋白MMP-9 的表达,进一步明确了其抑制破骨分化的机制。
本研究结果表明,刺槐素可在无明显细胞毒性的浓度区间内,通过抑制RANKL 刺激NF-κB 通路的活化,下调核心转录因子NFATc1 的表达,显著抑制BMMs 破骨分化诱导过程及相关特征基因表达。刺槐素可起到防治破骨细胞分化过度或功能活跃所导致的骨质疏松、假体周围骨溶解、肿瘤骨破坏等骨量丢失疾病,但尚需更进一步的机制研究及动物体内实验结果论证。
