不同产地蒙古黄芪茎叶UPLC指纹图谱建立及化学模式识别研究
2023-07-06王强雄李会伟谢逸俊尚尔鑫段金廒
王强雄,郭 盛,李会伟,谢逸俊,尚尔鑫,段金廒
不同产地蒙古黄芪茎叶UPLC指纹图谱建立及化学模式识别研究
王强雄,郭 盛*,李会伟,谢逸俊,尚尔鑫,段金廒*
南京中医药大学 中药资源产业化与方剂创新药物国家地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心/国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023
建立蒙古黄芪茎叶UPLC指纹图谱及含量测定方法,并对不同产地多个批次蒙古黄芪茎叶样品进行比较分析,为蒙古黄芪茎叶资源的利用与质量控制提供参考。采用ACQUITYTMUPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 µm),以0.1%甲酸水-乙腈为流动相,梯度洗脱,检测波长为350 nm,建立蒙古黄芪茎叶指纹图谱;采用电喷雾离子源-四极杆-飞行时间质谱(ESI-Q-TOF/MS)对共有峰进行鉴定;同时建立其含量测定方法。结合聚类分析和主成分分析法,对不同批次蒙古黄芪茎叶进行质量评价。建立了蒙古黄芪茎叶UPLC指纹图谱,共标定了25个共有峰,并鉴定了其中13个色谱峰,均为黄酮类成分;建立了异槲皮苷、紫云英苷、异鼠李素-3--葡萄糖苷的含量测定方法;17批黄芪茎叶的相似度在0.933~0.987;通过聚类分析将样品分为2大类;主成分分析与聚类分析结果一致。通过UPLC指纹图谱结合化学模式识别方法,建立了一种快速、有效的蒙古黄芪茎叶品质评价方法,可为蒙古黄芪茎叶的资源化利用提供客观依据。
黄芪;蒙古黄芪茎叶;品质评价;异槲皮苷;紫云英苷;异鼠李素-3--葡萄糖苷;资源化利用
黄芪为我国常用大宗药材,截至2019年,全国黄芪种植面积已超6.5万km2,年产量约7万t[11]。据不完全统计,作为黄芪药材的主要基原植物,蒙古黄芪(Fisch.) Bunge var.(Bge.) Hsiao,每年在药材的种植和采收过程中会产生近20万t的茎叶资源,长久以来未得到有效利用,造成资源浪费和环境污染[22]。事实上早在汉末的《名医别录》中就记载了黄芪茎叶具有“疗渴及筋挛,痈肿疽疮”的功效[33];清代《本草正义》中也记载:“黄耆茎叶疗渴,亦升清滋液之功。治筋挛者,亦禀温和之性,而且有宣通络咏之力也。其治痈肿疽疮,则茎叶有外行性,乃能疏通气血,而消肿化壅,与根之偏于补益者,固自有别耳”[44]。现代研究表明,蒙古黄芪茎叶中含有黄酮类、皂苷类、多糖类等多种活性成分[55-66],具有调节免疫、抗氧化、改善胃肠道功能等生物学作用[77-88]。近年来, 人们逐渐发现蒙古黄芪茎叶资源的潜在价值,并已将其开发为茶饮[99]、功能性食品[1010]、畜禽饲料、中兽药[1111]等产品,应用于食品、保健品、畜禽养殖等多个领域。其中,蒙古黄芪茎叶作为饲料原料用于畜禽养殖,呈现出促进畜禽生长繁殖、提高免疫性能、调节肠道健康等多种功能,并可改善畜禽产品品质[1212],是目前蒙古黄芪茎叶资源的主要利用形式。
随着蒙古黄芪茎叶资源价值的逐渐发现和开发利用,有效保证其资源品质、控制其产品质量将成为蒙古黄芪茎叶资源可持续利用的重要环节,因此亟需建立其质量控制和品质评价方法。据此,本研究采用超高效液相色谱(UPLC)法建立蒙古黄芪茎叶的指纹图谱及含量测定方法,并采用超高效液相色谱串联四极杆飞行时间质谱法(UPLC-Q- TOF/MS)对共有峰进行定性鉴别。结合聚类分析、主成分分析等化学模式识别技术,探讨不同产地蒙古黄芪茎叶的品质差异。
1 仪器与材料
1.1 仪器
Waters ACQUITY UPLC系统(美国Waters公司),SynaptTMQ-TOF质谱仪(美国Waters公司),MassLynxTM4.1质谱工作站软件(美国Waters公司),Milli-Q超纯水制备仪(美国Milli-pore公司),BSA224S-CN万分之一天平(德国赛多利斯公司),DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司),MicroCL17R型高速冷冻离心机(赛默飞世尔科技有限公司),KH-500型超声波清洗器(昆山禾创超声仪器有限公司)。
1.2 材料
对照品异鼠李素-3--葡萄糖苷(批号CFS202102)购自武汉天植生物技术有限公司;异槲皮苷(批号PRF8030703)、紫云英苷(批号PRF9072622)购自成都普瑞法科技开发有限公司;山柰素(批号Y05J9H63012)购自上海源叶生物科技有限公司,质量分数均大于98%。乙腈和甲酸均为色谱纯,均购自德国Merck公司,超纯水为实验室自制,其他化学试剂均为分析纯(南化试剂公司)。17批黄芪茎叶样品信息见表1,经南京中医药大学段金廒教授鉴定为豆科植物蒙古黄芪(Fisch.) Bunge var.(Bge.) Hsiao的茎和叶。17批样品均置于热风烘箱55 ℃烘干,粉碎后过40目筛,于阴凉干燥处保存备用。
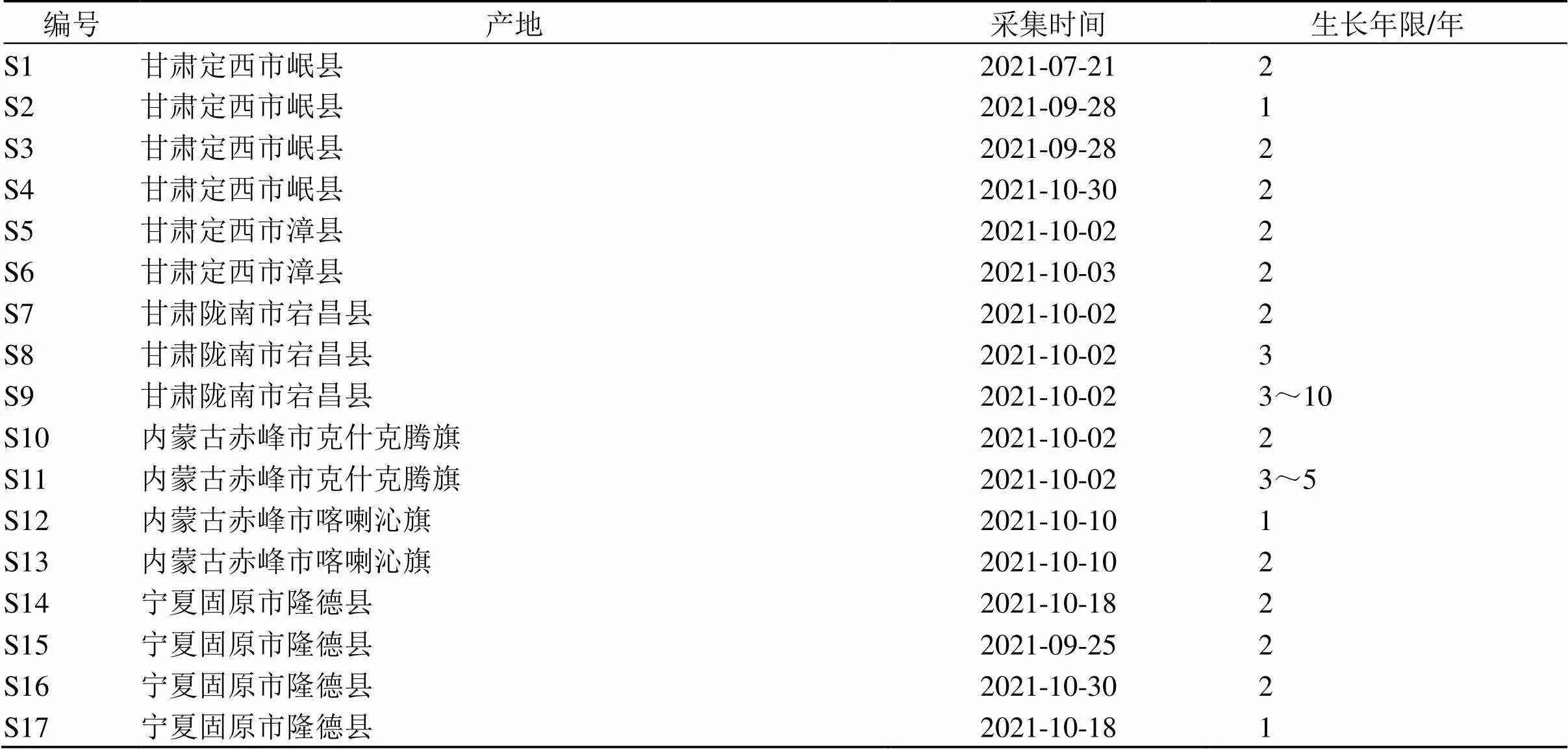
表1 不同批次蒙古黄芪茎叶样品信息
2 方法与结果
2.1 对照品溶液的制备
精密称取干燥至恒定质量的异鼠李素-3--葡萄糖苷、异槲皮苷、紫云英苷、山柰素对照品适量,用甲醇分别配成质量浓度为0.192、0.106、0.149、0.218 mg/mL的对照品溶液。
2.2 供试品溶液的制备
精密称取上述不同批次蒙古黄芪茎叶样品粉末2.0 g,置于100 mL具塞锥形瓶中,精密加入40 mL 75%乙醇,静置30 min后室温超声(40 kHz)提取1 h,放至室温后补足减失质量,13 000 r/min离心10 min,取上清液,经0.22 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.3 色谱条件
色谱柱:ACQUITYTMUPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 µm),流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱:0~1 min,95%~90% A;1~31 min,90%~75% A;31~36 min,75%~55% A;36~37 min,55%~20% A;37~38 min,20%~5% A;38~39 min,5%~95% A;体积流量0.4 mL/min,柱温30 ℃,进样量2 µL,检测波长为350 nm。
2.4 质谱条件
ESI源;扫描方式:ESI+、ESI-模式;萃取电压4.0 V;锥孔电压30 V;毛细管电压3.0 kV;脱溶剂气温度400 ℃;离子源温度120 ℃;脱溶剂气流量800 L/h;锥孔气流量50 L/h;碰撞能量6~40 eV,离子能量1 V;质量扫描范围100~1000。
2.5 UPLC指纹图谱方法学考察
2.5.1 精密度试验 取S1号样品,按照“2.2”项下方法制备供试品溶液,连续进样6次,按“2.3”项色谱条件进行分析,计算各色谱峰的保留时间和峰面积。结果表明,各共有峰保留时间的RSD值均小于0.21%,峰面积的RSD值均小于2.73%,说明仪器精密度良好。
2.5.2 重复性试验 取S1号样品6份,按照“2.2”项下方法分别制备供试品溶液,按“2.3”项色谱条件进行分析,计算各色谱峰保留时间和峰面积。结果表明,各共有峰保留时间的RSD值均小于0.16%,峰面积的RSD值均小于2.82%,说明该方法重复性良好。
2.5.3 稳定性试验 取S1号样品,按照“2.2”项下方法制备供试品溶液,分别在0、2、4、8、12、24 h进样,按“2.3”项色谱条件进行分析,计算各色谱峰的保留时间和峰面积。结果表明,各共有峰保留时间的RSD值均小于0.28%,峰面积的RSD值均小于2.87%,说明样品在24 h内具有较好的稳定性。
2.6 蒙古黄芪茎叶UPLC指纹图谱的建立及相似度评价
2.6.1 指纹图谱的建立及参照峰的确定 取17批蒙古黄芪茎叶样品,按“2.2”项制备供试品溶液,按“2.3”项色谱条件进行分析,记录色谱图,并导入中药色谱指纹图谱相似度评价系统(国家药典委员会,2012.130723版),去除溶剂峰(0~3 min)及尾部杂峰(37~40 min),以S1分析得到的图谱为参照图谱,设置时间窗宽度为0.1,采用中位数法生成叠加指纹图谱(图1-A),采用多点校正,经全谱峰匹配后生成对照图谱,结果见图1-B。在所有样品图谱中19号峰分离度良好,位置较为居中,峰面积较大且稳定,因此选择19号峰为参照峰。
2.6.2 共有峰的指认 根据所有蒙古黄芪茎叶样品的UPLC图谱分析,指认了25个共有峰(图1-B),共有峰的峰面积之和大于90%。共有峰的相对保留时间RSD值在0~0.903%,相差较小;相对峰面积的RSD值相差较大,在0~80.578%,表明不同批次蒙古黄芪茎叶中的化学成分含量差异较大。
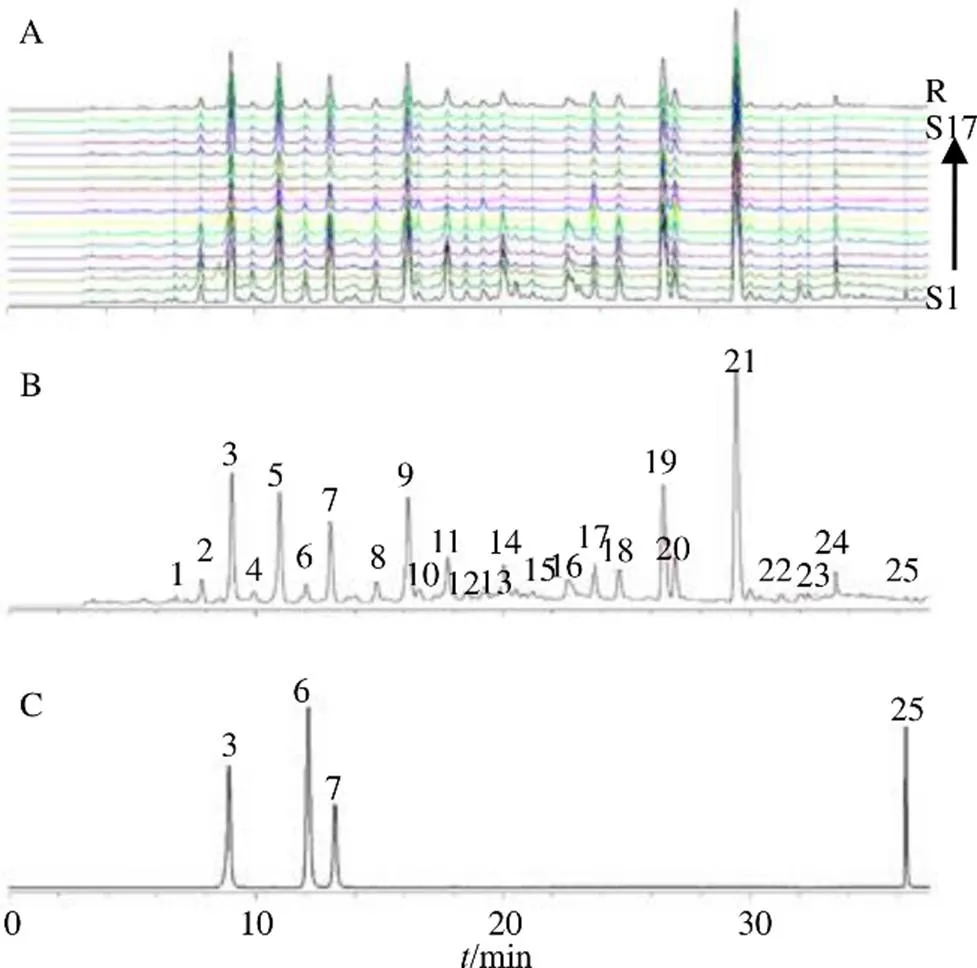
3-异槲皮苷 6-紫云英苷 7-异鼠李素-3-O-葡萄糖苷 25-山柰素
2.6.3 共有峰的鉴定 通过UPLC-Q-TOF/MS分析,共鉴定出13个共有峰(表2),分别为异槲皮苷(峰3)、槲皮素-3--(6''--丙二酰基)-β--葡萄糖苷(峰5)、紫云英苷(峰6)、异鼠李素---葡萄糖苷(7)、山柰酚-3--(6''--丙二酰基)-葡萄糖苷(峰8)、异鼠李素-3--(6''--丙二酰基)-葡萄糖苷(峰9)、沙苑子苷(峰10)、6''-丙二酸沙苑子苷单酯(峰13)、isorhamnetin-3--robinobioside-7--glucoside(峰14)、rhamnocitrin-3--β- neohesperidoside(峰17)、kaempferol-4¢-methylether- 3-β--glucoside(峰19)、kaempferol-4¢- methylether-3-β--malonylglucoside (峰21)、山柰素(峰25)。其中峰3、6、7、25经对照品品指认(图1-C),其余共有峰通过质谱信息结合参考文献推测得出。通过紫外吸收特征可推测25个共有峰均为黄酮类化合物(最大吸收波长在250 nm和350 nm附近)。从质谱信息中进一步发现多数化合物有162、146、308等糖基碎片离子掉落,因此可推测多为黄酮苷类化合物[1313]。此外,中性丢失、C环的重排和开裂得到的特征性碎片离子可以进一步帮助推测环上的取代基以及苷元母核结构[1414]。以峰10为例,其在负离子模式下有623.158 8的准分子离子峰,可初步推测该化合物相对分子质量为624,分子式为C28H32O16,碎片离子461.110 3是由其失去1个六碳糖基所得,再失去1个六碳糖基得到碎片299.055 0,依据文献报道推测其为沙苑子苷。
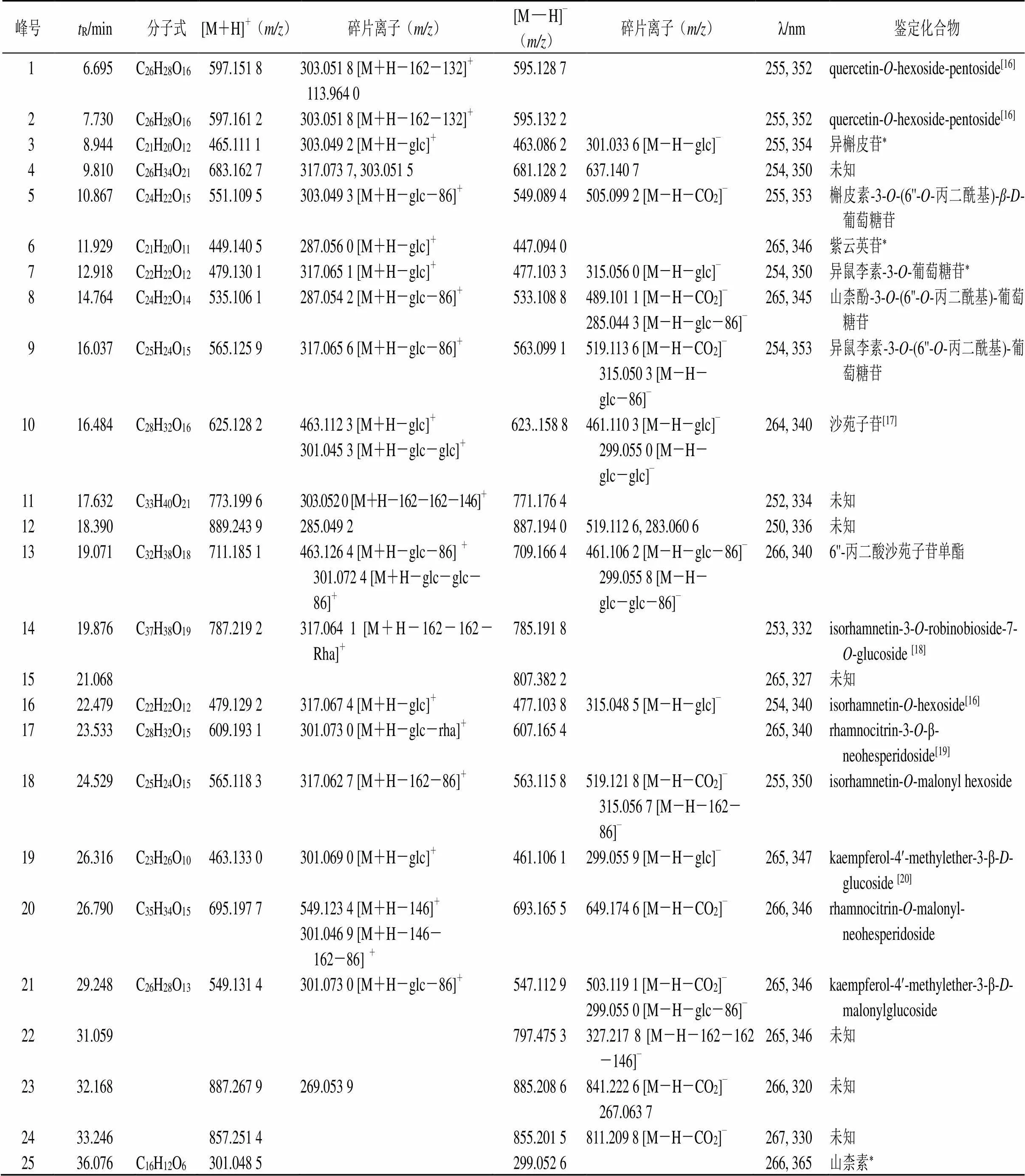
表2 蒙古黄芪茎叶样品UPLC指纹图谱共有峰的鉴定
*表示通过对照品确认
*means that confirmed by reference substance
已有研究显示黄芪植物中分布着大量的丙二酰基型黄酮苷类化合物[1515]。以峰8为例,其紫外吸收特征与紫云英苷(峰6)基本一致,在负离子模式下有533.108 8的准分子离子峰,可初步推测该化合物相对分子质量为534,分子式为C24H22O14,碎片离子489.101 1为其脱羧产生[M-H-CO2]−,碎片离子285.044 3则是准分子离子失去1分子六碳糖基以及碎片86(推测其为丙二酰基)所得,因此推测该化合物为山柰酚-3--(6''--丙二酰基)-葡萄糖苷。
此外,还有5个共有峰代表的化合物由于质谱信息不足,暂时无法确定糖苷键的取代位置及糖的种类。分别为quercetin--hexoside-pentoside(峰1)、quercetin--hexoside-pentoside(峰2)、 isorhamnetin--hexoside(峰16)、isorhamnetin--malonyl-hexoside(峰18)、rhamnocitrin-- malonyl-neohesperidoside(峰20)。具体结果及质谱信息见表2及图2。
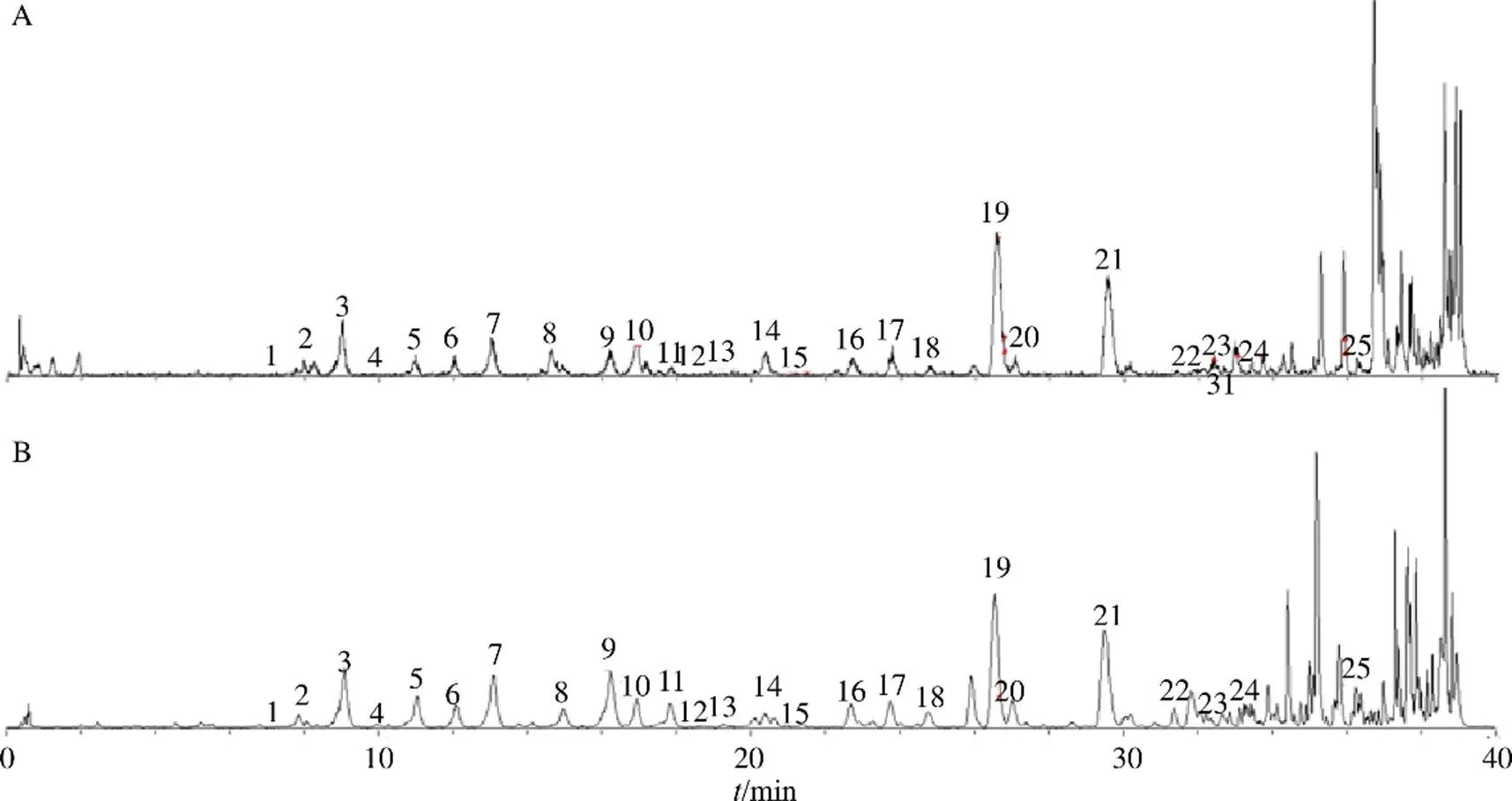
图2 蒙古黄芪茎叶正离子(A) 和负离子(B) 模式下总离子流图
2.6.4 相似度计算 以对照图谱为参照(设置为1),计算各批次样品相似度,结果见表3。17批蒙古黄芪茎叶样品的相似度在0.933~0.987,提示这17批蒙古黄芪茎叶样品的化学成分组成基本相似。
2.7 3个主要成分含量测定
在前期实验中用对照品共比对出蒙古黄芪茎叶指纹图谱共有峰中的4个峰,分别为异槲皮苷(峰3)、紫云英苷(峰6)、异鼠李素-3--葡萄糖苷(峰7)和山柰素(峰25),其中前3个成分含量相对较高,因此选择这3个成分建立其含量测定方法并测定17批样品中含量。
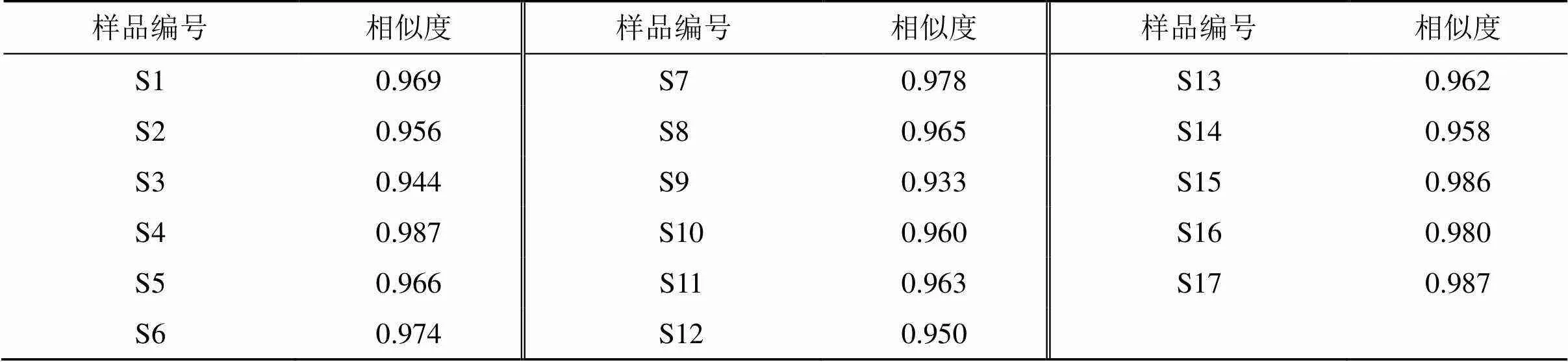
表3 17批蒙古黄芪茎叶样品相似度分析结果
2.7.1 对照品溶液制备 精密称取干燥至恒定质量的异槲皮苷、紫云英苷、异鼠李素-3--葡萄糖苷标准品适量,用甲醇配成质量浓度分别为0.212、0.298、0.192 mg/mL的混合对照品溶液贮备液。
2.7.2 供试品溶液制备及色谱条件 供试品溶液制备方法同“2.2”项,色谱条件同“2.3”项。
2.7.3 线性关系考察 取适量混合对照品溶液贮备液,用甲醇稀释成系列浓度的混合对照品溶液,按“2.3”项色谱条件测定,以质量浓度为横坐标(),峰面积为纵坐标(),计算线性回归方程和相关系数()。结果见表4,所有标准曲线在线性范围内均呈良好的线性关系(均≥0.999 5)。

表4 蒙古黄芪茎叶3个成分线性方程及相关系数
2.7.4 精密度试验 取混合对照品溶液,按“2.3”项色谱条件连续进样6次,记录各成分的峰面积,并计算RSD值。RSD值均小于0.74%,表明仪器精密性良好。
2.7.5 重复性试验 取S1号样品6份,按照“2.2”项下方法分别制备供试品溶液,按“2.3”项色谱条件连续进样分析,记录各色谱峰峰面积,并计算RSD值。RSD值均小于2.62%,表明该方法重复性良好。
2.7.6 稳定性试验 取S1号样品,按照“2.2”项下方法制备供试品溶液,分别在0、2、4、8、12、24 h进样,按“2.3”项色谱条件进行分析,记录各色谱峰的峰面积,并计算RSD值。RSD值均小于2.42%,表明供试品溶液在24 h内稳定。
2.7.7 加样回收率试验 分别称取S1号样品6份,每份1.0 g,按照对照品量-样品中含量约1∶1的比例分别加入3个对照品粉末,按照“2.2”项下方法制备供试品溶液,按“2.3”项色谱条件进行分析,记录各色谱峰的峰面积,并计算回收率和RSD值。异鼠李素-3--葡萄糖苷、异槲皮苷、紫云英苷的加样回收率分别为100.97%、102.34%、102.59%,RSD值均小于1.99%,表明本方法准确度良好。
2.7.8 样品含量测定 取17批蒙古黄芪茎叶样品,按照“2.2”项下方法制备供试品溶液,按“2.3”项色谱条件进行测定,记录峰面积,并根据线性回归方程计算各样品中3个成分的含量,结果见表5,17批样品中异鼠李素-3--葡萄糖苷、异槲皮苷、紫云英苷的质量分数分别为0.121 5~1.068 6、0.203 2~1.603 7、0.068 3~0.260 0 mg/g。不同产地蒙古黄芪茎叶中3个黄酮类成分含量无显著差异,但不同生长时期的样品间存在较大差异,如甘肃岷县产的2年生蒙古黄芪茎叶,9月底采收的样品(S3)中异鼠李素-3--葡萄糖苷、异槲皮苷、紫云英苷含量分别为10月底采收样品(S4)的2.1、2.8、1.5倍;10月上旬在甘肃宕昌县采收的2年生蒙古黄芪茎叶(S7)中异鼠李素-3--葡萄糖苷、异槲皮苷、紫云英苷含量分别为3年生蒙古黄芪茎叶(S8)的2.0、1.8、1.3倍。
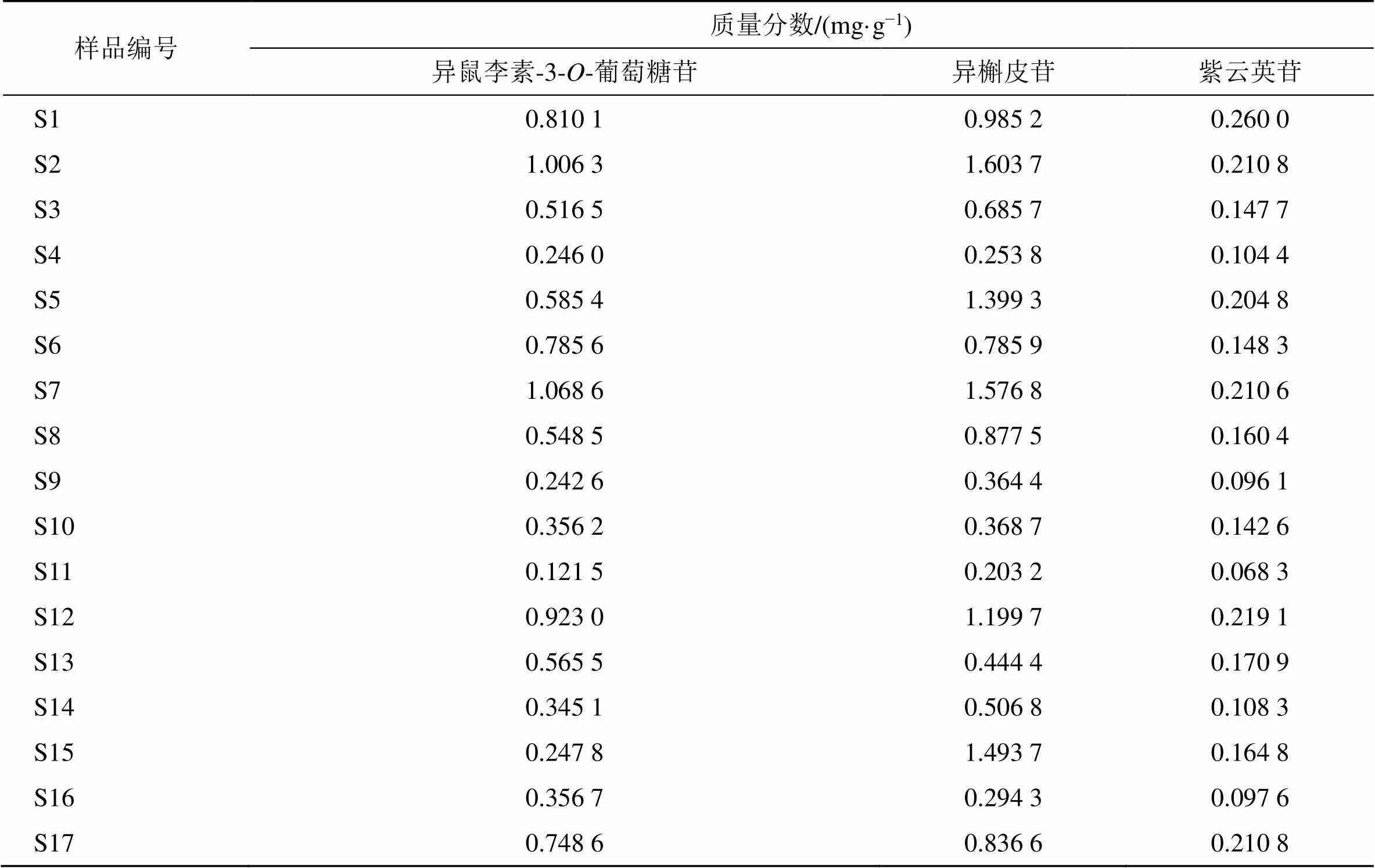
表5 17批蒙古黄芪茎叶样品中3个成分的含量测定结果
2.8 化学模式识别分析
2.8.1 聚类分析 将17批蒙古黄芪茎叶的25个共有峰的峰面积数据导入SPSS 21.0统计软件,采用组间联接的聚类方法,以平方欧氏距离为样品间距离进行聚类分析,结果见图3。从图中可知,当距离为25时,17批蒙古黄芪茎叶样品可以分成2大类,产地为甘肃的S1、S2、S3、S5、S6、S7号样品归为I类,剩余的3个甘肃产样品(S4、S8、S9)与其他2个产地的样品归为II类。当距离为15时,I类样品又可以分为a、b 2小类,其中S1号样品为一类,S2、S3、S5、S6、S7号样品分为一类。S1号样品采收时间为7月,其余样品则集中在9月下旬至10月,由此推测采收时间跨度大导致了S1号样品与其他样品出现差异。当距离为5时,产地为内蒙古的S10、S11、S12、S13号样品可以分为一小类,甘肃产的S4、S8、S9号样品与产地为宁夏的4个样品为另一小类。造成部分甘肃产的蒙古黄芪茎叶样品无法与宁夏产蒙古黄芪茎叶样品区分开的原因可能是宁夏与甘肃在地理位置上相邻,纬度相近,气候条件相似,因此蒙古黄芪茎叶的品质相对接近。以上结果表明聚类分析可在一定程度上区分不同产地蒙古黄芪茎叶,推测产地是引起蒙古黄芪茎叶出现质量差异的重要因素之一,除产地因素外,采收时间等因素也会在一定程度上影响蒙古黄芪茎叶的质量差异。
2.8.2 主成分分析 将17批蒙古黄芪茎叶样品共有峰的峰面积结果导入SIMCA 14.1软件,进行主成分分析。以特征值大于1为提取标准[2121],得到3个主成分(PC1、PC2、PC3),PC1的方差贡献率最高,为74%,PC2和PC3的贡献率分别为9.5%和7.3%,三者累积方差贡献率达90.8%,可以解释绝大部分变量信息。以PC1和PC2为坐标轴建立坐标系进行投影,得到17批蒙古黄芪茎叶样品的PCA得分散点图(图4),从图中可以较为明显地区分3个产地的蒙古黄芪茎叶样品,这与聚类分析结果一致。此外,从图中发现产地为甘肃的9个批次样品较为分散,推测基于这9个批次样品的采收时间(7、9、10月)和种植年限(1、2、3、3~10年)相差较大,由此提示蒙古黄芪茎叶的品质可能与采收时间及种植年限相关。根据各个批次蒙古黄芪茎叶样品的主成分得分,结合3个主成分的方差贡献率,可计算出各批次蒙古黄芪茎叶的综合得分(乙醇),公式为综=0.741+0.0952+0.0733,结果见表6。综合得分越高,表明峰面积相对越大,对应的成分含量相对越高[2222]。由结果可知,甘肃产蒙古黄芪茎叶排名靠前,宁夏产蒙古黄芪茎叶次之,而内蒙古产蒙古黄芪茎叶排名较后。出现此差异的原因可能是内蒙古平均纬度较高,入冬较早,蒙古黄芪地上部分提前枯萎,从而导致活性成分含量下降。在甘肃所有样品中S4、S8、S9号样品排名最后,其中S4号样品采收时间为10月底,S8号样品种植年限为3年,S9号样品种植年限为3~10年。在宁夏的4个样品中,S16号样品排在最后,其采收时间也为10月底,再次提示蒙古黄芪茎叶的质量可能与采收时间以及种植年限相关。
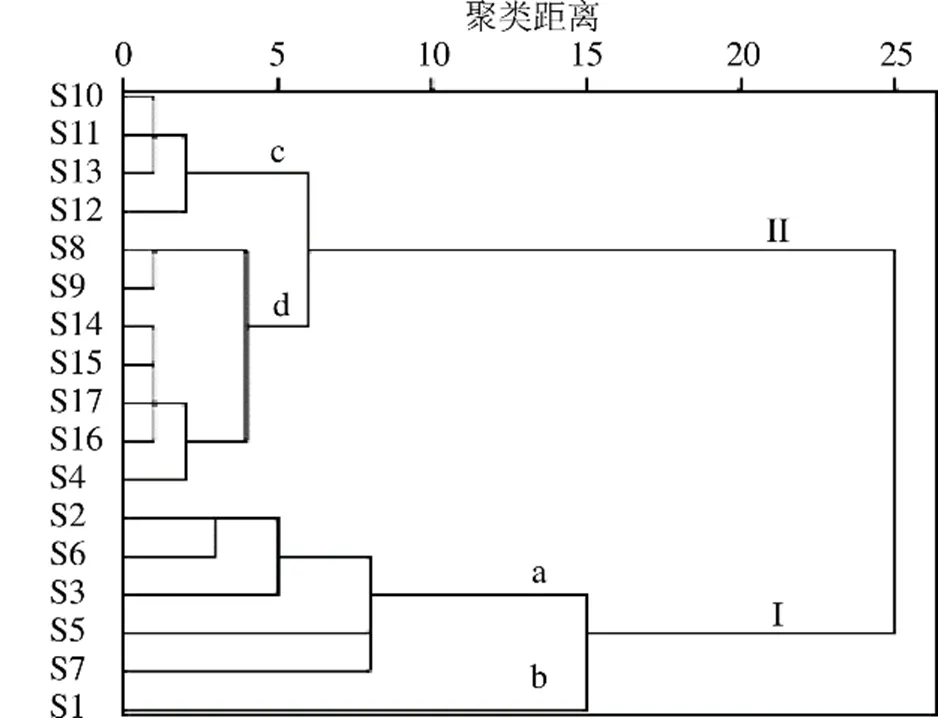
图3 17批蒙古黄芪茎叶样品聚类分析树状图

图4 17批蒙古黄芪茎叶样品PCA得分图
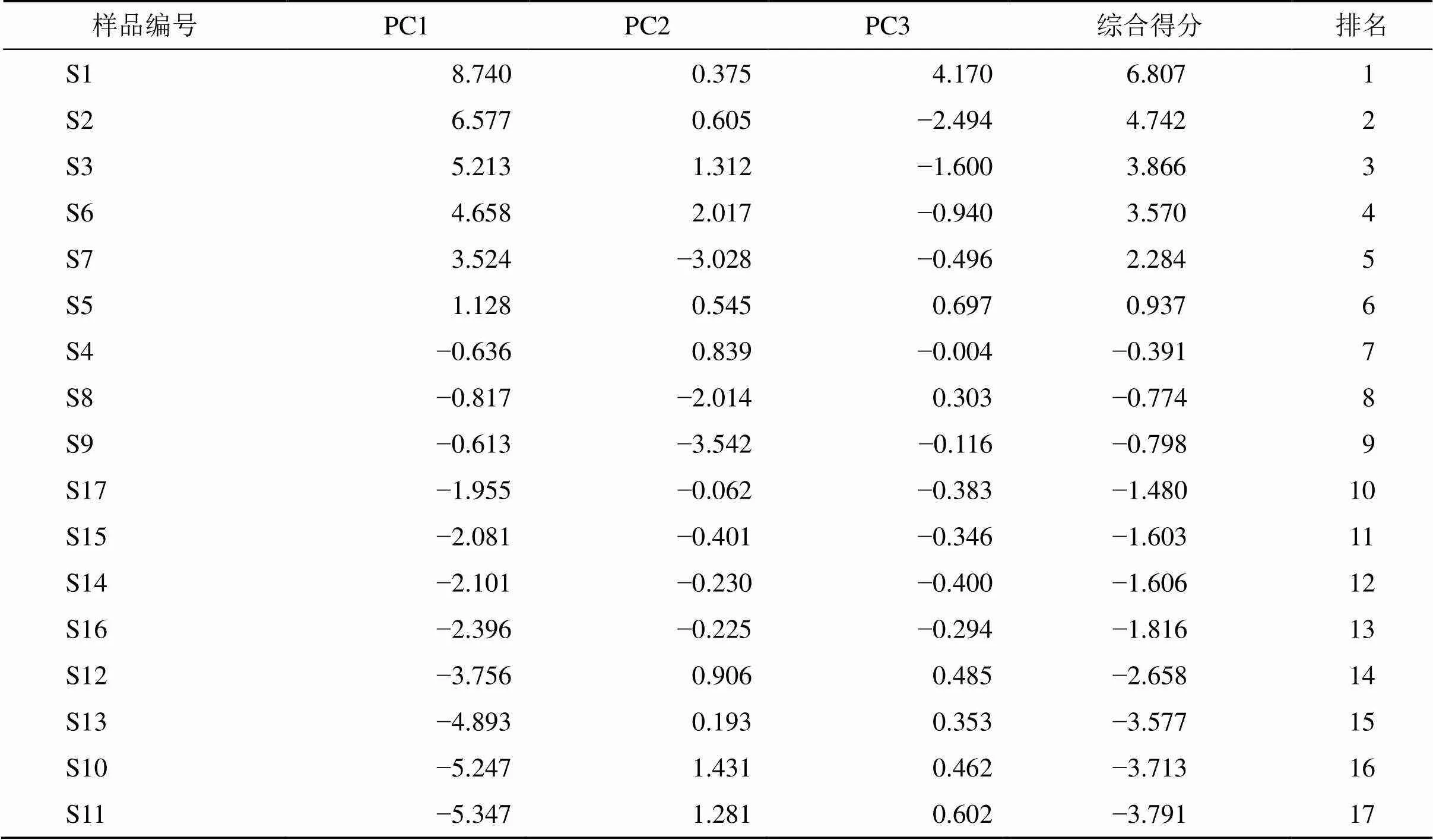
表6 17批蒙古黄芪茎叶样品主成分得分和综合得分
3 讨论
在黄芪药材的种植及采收过程中,大量的茎叶资源常被遗弃或者就地焚烧,造成资源浪费。近年来,蒙古黄芪茎叶的资源价值逐步被发现,并被开发为茶饮、功能性食品、畜禽饲料及中兽药等产品,但由于缺少质量控制方法,导致其原料质量参差不齐。为建立蒙古黄芪茎叶质量控制方法,本研究通过考察提取溶剂、提取方式、料液比、流动相体系、检测波长等条件,首次建立了蒙古黄芪茎叶UPLC指纹图谱及含量测定方法,并对指纹图谱共有峰进行了定性鉴别。同时结合聚类分析、主成分分析等化学模式识别技术,进一步分析了不同产地、不同批次蒙古黄芪茎叶样品间的化学组分差异。
本课题组前期研究[6]及文献报道[2323]显示,蒙古黄芪茎叶中次生代谢产物以黄酮类成分居多,且含量高于皂苷类、酚酸类等化学成分。据此,本研究选择黄酮类成分作为蒙古黄芪茎叶质量评价的依据。本研究从蒙古黄芪茎叶中共鉴定出13个黄酮类成分的化学结构,其中包括5个丙二酰基黄酮类化合物。有研究表明,多种豆科植物可以通过连接丙二酰基来储存不易溶解的黄酮苷或苷元类成分,当植物细胞受到侵害时易水解其储存形式释放苷或苷元[2424],且在提取过程中,丙二酰基黄酮苷及其水解后的黄酮苷总量不会发生明显变化[2525]。上述研究结果提示可以其总量来评价蒙古黄芪茎叶的质量。同时,采用聚类分析和主成分分析对17批蒙古黄芪茎叶样品的指纹图谱数据进行处理,从一定程度上区分了内蒙古、甘肃以及宁夏3个产地的蒙古黄芪茎叶,并推测产地、采收时间等因素均会对蒙古黄芪茎叶的聚类结果产生影响,但限于样本数量及代表性有限,相关结果仍需进一步验证。此外,发现甘肃产蒙古黄芪茎叶质量较优,内蒙古产蒙古黄芪茎叶质量稍差,推测这可能与地理位置以及气候等环境因素相关。目前,人工栽培的蒙古黄芪种植年限多为2年,采收时间为9月下旬至10月上旬,本研究发现采收时间晚于药材采收期、种植年限超过2年均会对蒙古黄芪茎叶的质量产生较大影响,具体表现为黄酮类成分含量显著下降。提示在利用蒙古黄芪茎叶资源时,应在采收1年生、2年生黄芪根部后及时收集其茎叶,避免资源的低效利用。
综上,本实验建立了一种快速、稳定的蒙古黄芪茎叶品质评价及含量测定方法,为蒙古黄芪茎叶资源的精细化利用和开发提供了客观依据,并为控制和评价蒙古黄芪茎叶品质提供了参考。同时,后续研究还可基于蒙古黄芪茎叶指纹图谱信息与其生物学活性进行关联分析,通过谱-效关系分析建立反映其内在质量的品质评价方法[2626]。此外,本研究主要以黄酮类成分为依据对蒙古黄芪茎叶进行质量评价,后续可结合蒙古黄芪茎叶中的皂苷类、多糖类等其他活性成分,对其质量进行综合评价。
利益冲突 所有作者均声明不存在利益冲突
[1] 万修福, 王升, 康传志, 等. “十四五”期间中药材产业趋势与发展建议 [J]. 中国中药杂志, 2022, 47(5): 1144-1152.
[2]段金廒. 中药废弃物的资源化利用 [M]. 北京: 化学工业出版社, 2013: 56.
[3]梁·陶弘景集. 尚志钧辑校. 名医别录 [M]. 北京: 人民卫生出版社, 1986: 26-29.
[4]张山雷著. 程东旗点校. 本草正义 [M]. 福州: 福建科学技术出版社, 2006: 36.
[5]Wang T T, Ruan J Y, Li X X,. Bioactive cyclolanstane-type saponins from the stems of(Fisch.) Bge. var.(Bge.) Hsiao [J]., 2016, 70(2): 198-206.
[6]Li Y, Guo S, Zhu Y,. Comparative analysis of twenty-five compounds in different parts ofvarandby UPLC-MS/MS [J]., 2019, 9(6): 392-399.
[7]韩宪忠, 沈正泽, 袁文霄, 等. 黄芪地上、地下部分对免疫低下模型小鼠保护作用的比较研究 [J]. 中国药房, 2020, 31(24): 2981-2986.
[8]郭丽丽, 王小敏, 秦楠, 等. 黄芪茎叶总皂苷提取物的抑菌活性研究 [J]. 现代食品科技, 2019, 35(1): 82-88.
[9]王福元, 蔺兴遥, 王爱玉, 等. 一种黄芪叶茶的制作方法: CN110810576A [P]. 2020-02-21.
[10]李慧, 李静辉, 崔莹, 等. 黄芪茎叶的安全性毒理学评价 [J]. 现代食品科技, 2021, 37(10): 332-339.
[11]丛晶男. 中兽药黄芪茎叶散临床前研究 [D]. 佳木斯: 佳木斯大学, 2020.
[12]Guo L L, Hua J, Luan Z H,. Effects of the stems and leaves ofon growth performance, immunological parameters, antioxidant status, and intestinal bacteria of quail [J]., 2019, 90(6): 747-756.
[13]朱赟斐, 谭善忠, 王洪兰, 等. 基于UPLC-Q-TOF- MS/MS技术的益气健脾颗粒化学成分分析 [J]. 中草药, 2022, 53(12): 3601-3613.
[14]雷冬梅, 姚长良, 陈雪冰, 等. 基于RP-Q-TOF-MS和HILIC-Q-TOF-MS的经典名方当归补血汤成分分析 [J]. 中国中药杂志, 2022, 47(8): 2109-2120.
[15]Chu C, Cai H X, Ren M T,. Characterization of novel astragaloside malonates fromastragali by HPLC with ESI quadrupole TOF MS [J]., 2010, 33(4/5): 570-581.
[16]Li Y, Guo S, Zhu Y,. Flowers ofvar.as a novel high potential by-product: Phytochemical characterization and antioxidant activity [J]., 2019, 24(3): 434.
[17]毕志明, 余庆涛, 李萍, 等. 蒙古黄芪地上部分的黄酮类成分 [J]. 中国天然药物, 2007, 5(4): 263-265.
[18]Vasilev H, Ross S, Šmejkal K,. Flavonoid glycosides from endemic Bulgarian(ivanisch.) [J]., 2019, 24(7): 1419.
[19]Wang Z B, Zhai Y D, Ma Z P,. Triterpenoids and flavonoids from the leaves ofand their inhibitory effects on nitric oxide production [J]., 2015, 12(10): 1575-1584.
[20]Yu Q T, Qi L W, Li P,. Determination of seventeen main flavonoids and saponins in the medicinal plant Huang-qi (astragali) by HPLC-DAD-ELSD [J]., 2007, 30(9): 1292-1299.
[21]周冰倩, 高喜梅, 杨颖, 等. 不同来源竹茹药材HPLC指纹图谱和化学计量学分析 [J]. 中草药, 2022, 53(3): 853-857.
[22]谢苏梦, 季巧遇, 吕尚, 等. 不同产地野菊花HPLC指纹图谱建立及化学模式识别研究 [J]. 中草药, 2021, 52(24): 7616-7623.
[23]Hao J, Li J, Li X X,. Aromatic constituents from the stems of(Fisch.) Bge. var.(Bge.) Hsiao [J]., 2016, 21(3): 354.
[24]Lin L Z. Liquid chromatography-electrospray ionization mass spectrometry study of the flavonoids of the roots ofand[J]., 2000, 876(1/2): 87-95.
[25]Zheng Y F, Duan W P, Sun J,. Structural identification and conversion analysis of malonyl isoflavonoid glycosides in astragaliby HPLC coupled with ESI-Q TOF/MS [J]., 2019, 24(21): 3929.
[26]佘一鸣, 胡永慧, 韩立云, 等. 中药质量控制的研究进展 [J]. 中草药, 2017, 48(12): 2557-2563.
Study on establishment of UPLC fingerprints and chemical pattern recognition of the stems and leaves ofvar.(Bge.) Hsiao from different regions
WANG Qiang-xiong, GUO Sheng, LI Hui-wei, XIE Yi-jun, SHANG Er-xin, DUAN Jin-ao
National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, State Administration of Traditional Chinese Medicine Key Laboratory of Chinese Medicinal Resources Recycling Utilization, Nanjing University of Chinese Medicine, Nanjing, 210023, China
To establish the UPLC fingerprint and content determination method of the stems and leaves ofvar.(Bge.)Hsiao(SLAM), and to compare and analyze multiple batches of SLAM from different origins, so as to provide reference for the utilization and quality control of SLAM resources.ACQUITYTMUPLC BEH C18column (100 mm×2.1 mm, 1.7 µm) was used. Mobile phase was 0.1% formic acid water and acetonitrile, gradient elution, detection wavelength was 350 nm; The common peaks were identified by electrospray ion source-quadrupole-time-of-flight mass spectrometry (ESI-Q-TOF/MS); At the same time, the content determination method was established. Cluster analysis and principal component analysis were used to evaluate the quality of SLAM of different batches.The UPLC fingerprint of SLAM was established, 25 common peaks were calibrated, and 13 chromatographic peaks were identified, all of which were flavonoids; The content determination method of isoquercitrin, astragalin and isorhamnetin-3--glucopyranoside was established; The similarities of 17 batches of SLAM were in the range of 0.933—0.987. The samples were divided into two categories by cluster analysis. The results of principal component analysis and cluster analysis are consistent.A rapid and effective method for quality evaluation of SLAM was established by UPLC fingerprint and chemical pattern recognition method, which can provide objective basis for the resource utilization of SLAM.
Radix Astragali; stems and leaves ofvar.; quality evaluation; resource utilization; isoquercitrin; astragalin; isorhamnetin-3--glucopyranoside
R286.2
A
0253 - 2670(2023)13 - 4312 - 09
10.7501/j.issn.0253-2670.2023.13.024
2022-12-09
国家中医药管理局中医药创新团队及人才支持计划项目(ZYYCXTD-D-202005);中央本级重大增减支项目(2060302);宁夏重点研发计划(2017BY079)
王强雄(1997—),男,硕士研究生,从事中药资源化学与资源循环利用研究。E-mail: wqx0906@163.com
通信作者:郭 盛,副研究员。E-mail: guosheng@njucm.edu.cn
段金廒,教授。E-mail: dja@njucm.edu.cn
[责任编辑 时圣明]
