基于定量磁共振波谱探讨重度抑郁症患者海马代谢与治疗反应的关系
2023-07-05任红娜朱翔谢宇航郭小燕
任红娜 朱翔 谢宇航 郭小燕
治疗反应是重度抑郁症患者诊疗中最重要的临床指标,其不仅决定了治疗方案的敏感性,也决定着重度抑郁症患者的转归[1]。磁共振波谱(magnetic resonance spectroscopy,MRS)是一种用于检测活体内细胞水平局部脑组织代谢变化的无创分子成像方法,可以测定某些神经递质的水平和代谢[2]。尽管MRS 已在抑郁疾病中广泛应用,并取得丰富的成果[3-4],但关于其在治疗反应中的研究报道较少,尤其是定量波谱技术。因此,本研究采用定量MRS 对重度抑郁症患者海马代谢进行随访研究,探讨海马代谢与治疗反应的关系,现将结果报道如下。
1 对象和方法
1.1 对象 收集2018 年3 月至2020 年3 月江苏大学附属医院神经内科门诊重度抑郁症患者45 例和2020年8 月至2022 年8 月嘉兴市第一医院神经内科门诊重度抑郁症患者8 例共53 例(重度抑郁组),均符合美国精神障碍诊断与统计手册第4 版[5]中的抑郁症诊断标准。收集2018 年3 月至2020 年3 月江苏大学附属医院的健康志愿者20 名和2020 年8 月至2022 年8 月嘉兴市第一医院健康志愿者7 名共27 名作为健康对照组。纳入标准:(1)汉族;(2)18 周岁以上;(3)右利手。排除标准:(1)患过脑器质性疾病精神疾病;(2)患有严重的躯体疾病;(3)有严重的药物过敏或者依赖;(4)其他影响脑代谢的疾病;(5)任何的MRI 检查禁忌证等。本研究经江苏大学附属医院医学伦理学委员会(批准文号:UJS-LAER-AP-2018022606)及嘉兴市第一医院医学伦理学委员会(2023-LY-266)审查通过,所有受试者均签署知情同意书。两组对象一般资料比较差异均无统计学意义(均P>0.05),见表1。
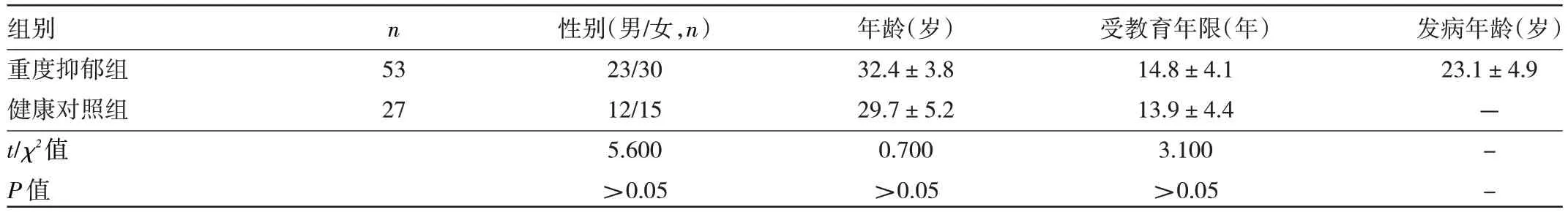
表1 两组对象一般资料的比较
1.2 方法 抑郁症患者MRS 检查于门诊当天或第2 天(基线状态)完成,并在MRS 检查当天采用17 项汉密尔顿抑郁量表(Hamilton depression rating scale-17,HDRS-17)评估抑郁患者的抑郁程度,且患者自述就诊2 周前未服用过任何抗抑郁药物。所有患者均遵医嘱口服抗抑郁药物(氟西汀,国药准字:H19980114,规格:20 mg/支;帕罗西汀,国药准字:H20031106,规格:20 mg/支)进行治疗(治疗剂量均为20 mg/d,1 次/d),并于治疗8 周后再次行MRS 检查,同时采用HDRS-17再次评估(由同1 位医师对所有患者进行评估)。其中,29 例重度抑郁症患者由于治疗8 周后HDRS-17 评分比基线时降低了50%而被诊断为难治性抑郁,另24例重度抑郁症患者在治疗8 周后符合非难治性抑郁症诊断标准。健康对照组于入组当天行MRS 检查。
采用西门子3.0T MR扫描仪,使用8通道头部线圈。在扫描期间,用软垫固定头部,同时采用软耳塞降低扫描仪的噪声干扰。要求所有受试者放松,闭上眼睛,保持清醒,尽量不要思考。初始图像采集包括高分辨率的T1加权扫描,该扫描采用磁化准备的快速梯度回波序列进行采集,重复时间(repetition time,TR)=20 s,回波时间(echo time,TE)=5 ms,翻转角=9°,层厚=10 mm,矩阵=512×512,视野(field of view,FOV)=256 mm×256 mm。基于矢状位图像重建轴向和冠状位图像,以实现感兴趣区域(region of interest,ROI)的三维视图,用于目标体积(volume of interest,VOI)的定位和图像分割。所有VOI放置于双侧海马体中并且使用以下参数获得具有化学位移成像(chemical shift imaging,CSI)定位的MRS:TR/TE = 3 800 ms/160 ms,在单个5.0 mm切面上进行5 次采集,并进行加权相位编码,FOV=256 mm×256 mm,矩阵=256×256,VOI=100 mm×100 mm,采集框=10 mm×10 mm×15 mm,变化频率=22.7 Hz,采集带宽=1 200 Hz,采集持续时间=1 024 ms,激发数=128,执行自动和手动匀场程序。进行MRS扫描后,获得位于MRS 体素中另一个T1加权切面,以评估对象在MRS 扫描期间是否移动。所有对象MRI检查均为阴性。如果存在任何不确定性,则执行其他序列(例如T2-FLAIR)以确保所有对象MRI 检查阴性。MRS 扫描采集时间为16 min,包括T1WI 在内的总扫描时间为23 min。
1.3 图像处理 经MRI 工作站及商用的计算机软件分析获得的MRS 光谱。代谢物信号的时域量化是使用AMARES 算法进行。在纳入分析之前,所有数据均经过质量控制。所有光谱均满足以下质量标准:信噪比(signal to noise ratio,SNR)必须≥15,半峰全宽(full width at half maximum,FWHM)必须≤0.08 ppm,并且只有Cramér-Rao 下限(所有患者的平均CRLBs是可靠的)≤20%时被纳入统计分析。在每个单独的ROI 中,代谢物的绝对定量值是由组织中未抑制的水信号作为内部参考,对受光谱质量控制的双侧海马体素中代谢物水平的平均值进行定量分析。由具有至少5 年工作经验的放射科医师进行基础数据采集和MRS 模型分析,MRS 分析窗口定义为0~4.0 ppm,见图1。

图1 头颅MRI 定位图与MRS 谱线图[A:MRI 定位图,圆点部分代表个体的双侧海马;B:从个体水平上的体素获得的MRS光谱和光谱拟合的叠加图]
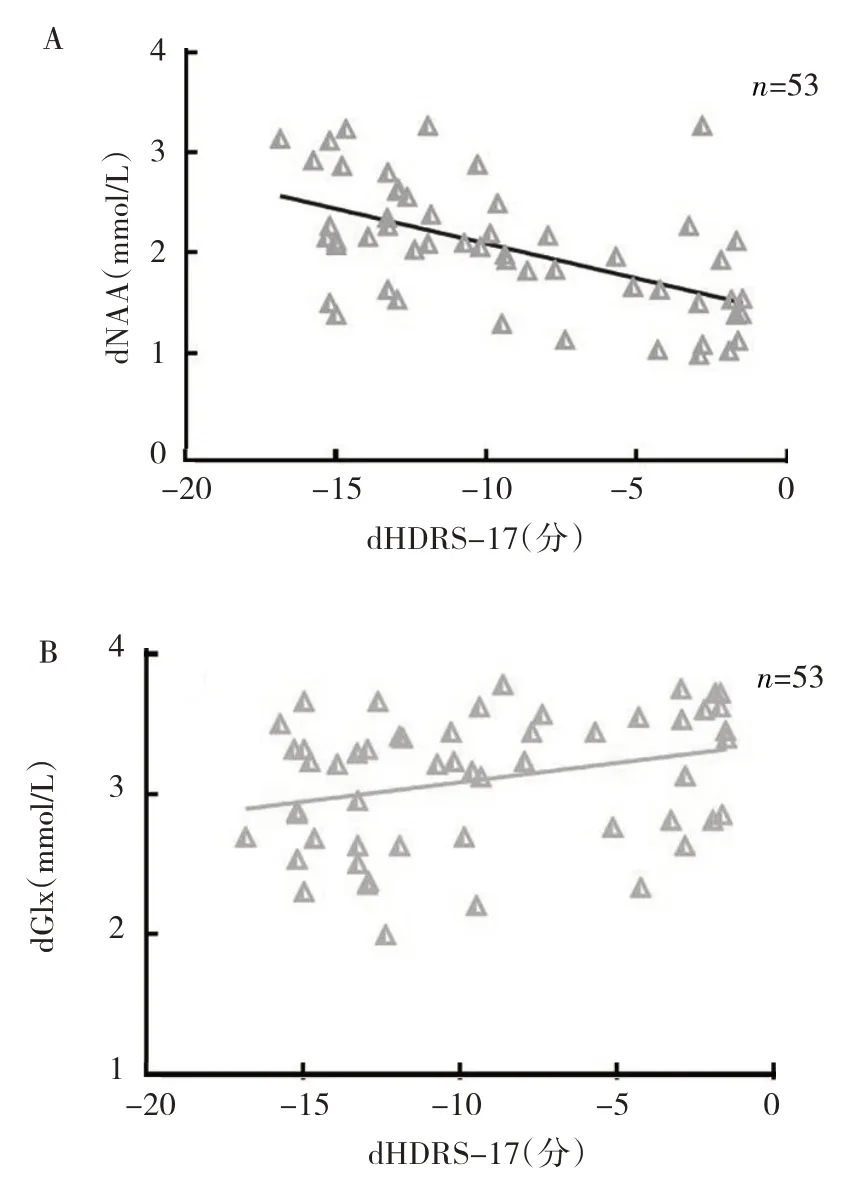
图3 治疗后代谢物水平差值与HDRS-17评分差值的散点图(A:dNAA与dHDRS-17的散点图;B:dGlx与dHDRS-17的散点图)
1.4 观察指标 通过观察HDRS-17 治疗前后的变化评估有无治疗反应,治疗后HDRS-17 较治疗前有所降低,即其差值(dHDRS-17)为负值,代表治疗有效,视为有治疗反应,反之视为无治疗反应。治疗前观察重度抑郁症患者海马中NAA、Cho、Cr、Glx 水平及HDRS-17 评分,并与健康对照组进行比较;治疗后,观察难治性抑郁组与非难治性抑郁组治疗前后NAA、Cho、Cr、Glx 水平及HDRS-17 评分的变化与差值,并对治疗前后组内代谢物水平变化的差值(dNAA、dCho、dCr、dGlx)与dHDRS-17 作相关分析,评估代谢物水平变化与治疗反应之间的关系。
1.5 统计学处理 采用SPSS 24.0 统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验,治疗前后组内比较采用配对t检验。计数资料组间比较采用χ2检验。采用Pearson 相关分析治疗前后代谢物水平变化与dHDRS-17 之间的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 重度抑郁症组与健康对照组治疗前代谢物水平及HDRS-17 评分的比较 重度抑郁症患者海马中Cho、NAA 及Glx 水平均明显低于健康对照组(均P<0.05),而Cr 水平与健康对照组比较差异无统计学意义(P>0.05),重度抑郁症患者HDRS-17 明显高于健康对照组(P<0.05),见表2。
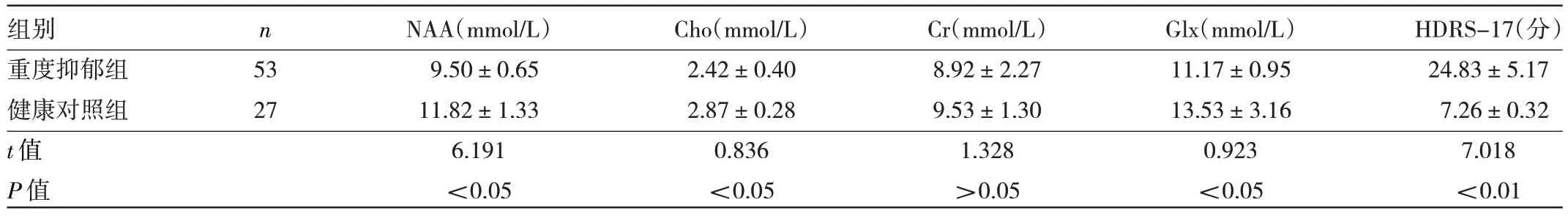
表2 重度抑郁症组与健康对照组治疗前代谢物水平及HDRS-17评分的比较
2.2 难治性与非难治性抑郁患者治疗前后各代谢物水平及HDRS-17 评分的变化与比较 治疗后难治性抑郁患者HDRS-17 评分高于非难治性患者,NAA 和Glx 水平均明显低于非难治性抑郁组(P<0.05),而Cho、Cr 水平的差异均无统计学意义(均P>0.05)。此外,非难治性抑郁组NAA、Cho 及Glx 水平治疗后出现了逆转,均较治疗前有所升高(均P<0.05),而难治性抑郁组中,除Cho 水平较治疗前升高以外,NAA、Glx 及Cr 与治疗前比较差异均无统计学意义(均P>0.05),见表3。

表3 难治性与非难治性抑郁症患者治疗前后各代谢物水平及HDRS-17评分的变化与比较
2.3 治疗反应评估 因难治性抑郁组和非难治性抑郁组治疗后Cho 均升高,而Cr 治疗前后组间、组内比较差异均无统计学意义,故不用于评估治疗反应。治疗前后NAA 水平变化(dNAA)与dHDRS-17 呈负相关(r=-0.632,P<0.05),见图2A,而治疗前后Glx水平变化(dGlx)与dHDRS-17 无明显相关(r=0.295,P>0.05),见图2B,预示dNAA 可能是评估重度抑郁患者治疗反应的有效指标。
3 讨论
抑郁症因其机制未明,一直是学界关注的难点和热点。临床中,常规MRI 检查对抑郁症患者的诊断缺乏特异性。本研究通过定量MRS 技术对53 例重度抑郁症患者和27 例健康受试者进行对比分析,观察重度抑郁症患者8 周抗抑郁治疗后其神经学代谢指标的变化特点,并分析其与临床治疗反应的相关性,为临床治疗效果提供有力的评估手段。
笔者首先发现,重度抑郁症患者的NAA、Cho及Glx水平均较健康对照组明显降低,这一结果不仅与已有文献一致[6],且在病理机制上亦获得理论支撑[7]。NAA是神经元活性的代表性指标,其显著减低充分提示神经元的凋亡增加、活性降低及功能损害[8];Cho(磷酸胆碱和甘油磷酸胆碱的总和)作为病理膜更新和炎症的标记,其减低与细胞膜磷脂新陈代谢抑制密切相关;而Glx水平降低则反应了脑实质的缺血缺氧损伤[9-10]。
在随后的治疗随访结果中,根据HDRS-17 变化差异将重度抑郁患者分化为难治性患者和非难治性患者,且其MRS 代谢也对应发生了差异性的变化。而NAA、Glx 水平增高仅出现在非难治性患者中,提示抗抑郁治疗有效的改善了神经元活性和脑组织缺血缺氧,而前者的变化与dHDRS-17 评分又有相关性。这一结果为临床评估抑郁疗效提供了评分之外可靠的体内指标。值得注意的是,Cho 在难治性抑郁组中也呈现了增高,侧面提示抑郁治疗中并无存在完全的药物抵抗,其相关改善机制或许可为难治性抑郁的诊疗提供参考思路。
近年来,MRS 技术从半定量层面正逐渐发展至绝对定量。作为光谱研究的重要部分,准确可靠的定量分析是MRS 从推广到临床应用的先决条件。半定量研究认为Cr 的代谢水平相对恒定,故一直以Cr 水平的比值作为内标。事实上,Cr 是一种通过储存ATP 和二磷酸腺苷来维持脑细胞能量依赖系统的缓冲液体,在重度抑郁症中Cr 水平可因线粒体ATP 产量和线粒体减少而发生减低[11],这一结果在本文中亦得到印证。因此,以组织中未被抑制的水为内部参考的绝对定量法可以获得更为准确的代谢物水平。综上,本研究通过MRS 纵向分析了重度抑郁患者海马中代谢物绝对水平,并对其与治疗反应的关系做了探索,其结果具有较高的可信度及稳定性。
虽然已有的海量神经影像学研究以结构和功能磁共振为手段对抑郁疾病的脑功能、临床指标相关性以及可能机制进行了探索,然鲜有报道聚焦于治疗反应。本课题组一直致力于抑郁疾病的临床和基础,在前期成果的基础上[12-14],首次应用定量MRS 技术对重度抑郁患者的治疗反应进行了初步探索,取得了肯定性结果。由此可见,定量MRS 技术在辅助评估抑郁症治疗反应中发挥极大的优势和显著作用。
本研究仍存在一些局限,如样本量相对不足,抑郁症患者对治疗药物的态度及依从性差异对结果的影响[15]、海马的侧别代谢差异未被考虑,治疗反应与物质代谢的深层次关系等,相关研究仍需跟进。
综上所述,MRS 技术对观察重度抑郁症患者治疗前后海马代谢水平变化有重要的价值。治疗前,重度抑郁组海马中的Cho、NAA 及Glx 水平明显低于健康对照组;治疗后,非难治性抑郁患者海马中NAA、Cho 及Glx 水平均出现了逆转,而难治性抑郁患者中仅Cho 水平较治疗前升高。另外发现dNAA 与dHDRS-17 呈负相关,预示着dNAA 可能是观察治疗反应的主要神经影像学指标,为重度抑郁患者治疗后海马神经修复效应提供了在体证据。
