UV-B辐射下叶绿素和微囊藻毒素的协同降解效应研究
2023-07-04沈强李嗣新冷博涵
沈强 李嗣新 冷博涵




摘要 [目的]探讨水体微囊藻毒素无二次污染的高效降解方法。[方法]通过开展国内富营养化水体中常见的藻毒素异构体MC-RR、MC-LR在叶绿素的添加与否条件下,研究UV-B对富营养化水体中叶绿素和微囊藻毒素的协同降解效应。[结果]2 mW/cm2的UV-B照射1 h,MC-RR、MC-LR降解率分别为29.8%和16.9%,而添加叶绿素后MC-RR、MC-LR的降解率分别高达99.8%和100.0%;2 mW/cm2的UV-B照射2 h,MC-RR、MC-LR均产生大量的光降解异构体产物,异构体产物与残余MC的色谱面积比分别为28.9%和21.7%,而添加叶绿素后MC-RR、MC-LR均被完全降解,MC和异构体产物均未检出。添加叶绿素后MC呈现出高效完全光降解,避免了常规光降解产生大量潜在毒性的异构体产物的缺点;2 mW/cm2的UV-B照射1 h,对Chla、Chla与MC-RR混合溶液、Chla与MC-LR混合溶液中的叶绿素a的降解率分别为86.7%、18.9%和70.3%。[结论]叶绿素能高效催化UV-B对微囊藻毒素的光降解;水体添加叶绿素后MC呈现高效完全光降解,避免了常规光降解产生大量潜在毒性的异构体产物的缺点;微囊藻毒素的添加延缓了UV-B对叶绿素的光降解,值得进一步深入研究。
关键词 微囊藻毒素;葉绿素;UV-B;协同降解
中图分类号 X 52 文献标识码 A 文章编号 0517-6611(2023)05-0051-05
doi: 10.3969/j.issn.0517-6611.2023.05.013
开放科学(资源服务)标识码(OSID):
Study on the Synergistic Degradation of Chlorophyll and Microcystins under UV-B Radiation
SHEN Qiang, LI Si-xin, LENG Bo-han
(Key Laboratory of Ecological Impacts of Hydraulic-Projects and Restoration of Aquatic Ecosystem of Ministry of Water Resources/Institute of Hydroecology, Ministry of Water Resources and Chinese Academy of Sciences,Wuhan,Hubei 430079)
Abstract [Objective]To explore the degradation method of microcystins without secondary pollution.[Method] The synergistic degradation effect of UV-B on chlorophyll and microcystin in eutrophic water was studied by carrying out the research on the common cyanotoxin isomers MC-RR and MC-LR in eutrophic water in China with or without chlorophyll.[Result] After UV-B irradiation at 2 mW/cm2 for 1 h, the degradation rates of MC-RR and MC-LR were 29.8% and 16.9% respectively, while the degradation rates of MC-RR and MC-LR were 99.8% and 100% after chlorophyll was added. Photodegradation isomers were found from MC-RR and MC-LR after UV-B irradiation for 1 h, the proportion of isomers and residual MC-RR and MC-LR were 28.9 % and 21.7%, respectively. However, after adding chlorophyll, MC-RR and MC-LR were completely degraded, MC and isomers were not detected.After UV-B irradiation at 2 mW/cm2 for 1 h, the degradation rates of chlorophyll a in chlorophyll, chlorophyll and MC-RR mixed solution, chlorophyll and MC-LR mixed solution were 86.7%, 18.9% and 70.3% respectively. [Conclusion]After adding chlorophyll, chlorophyll could efficiently catalyze the photodegradation of microcystin by UV-B. MC showed efficient and complete photodegradation, avoiding the shortcomings of conventional photodegradation producing potentially toxic isomers. The addition of microcystins delayed the photodegradation of chlorophyll by UV-B, which was worthy of further study.
Key words Microcysitins;Chlorophyll;UV-B;Synergistic degradation
近年来随着人类活动增加和水体富营养化,我国湖泊水库蓝藻水华频繁发生。太湖、滇池和巢湖蓝藻大面积的暴发进一步引起了人們对水体富营养化的关注。蓝藻水华的暴发,不仅破坏了水生生态系统的多样性,而且产生大量微囊藻毒素(MC),对水环境造成严重污染[1]。如太湖水华暴发期间,水源水中胞内MC平均浓度7.165 μg/L,胞外MC浓度可高达5.128 μg/L[2],远远超过WHO标准[3],给人类健康带来潜在威胁。
鉴于水体中微囊藻毒素带来的巨大危害,水体中微囊藻毒素的消除成为当前水环境保护研究的重要问题之一。目前常用水体MC消除方法有活性炭吸附[4]、絮凝吸附[5]、超滤膜分离[6]、光降解[7]、微生物降解[8]等,上述方法往往具有一定局限性,有必要进一步发展高效率、无污染的毒素降解方法[9]。研究表明,MC在太阳光和紫外线照射下的光降解现象,未加光催化剂的光降解效率低[10],而TiO2等催化剂的加入对水体有带来二次污染的风险;且MC的光降解中许多 研究采用UV-C照射[11],而由于臭氧层阻挡,达到地面的日光中的紫外线波段中能量较强的为UV-B,不存在UV-C[12]。研究UV-B波段下MC的降解特征意义更为重要。此外,富营养化水体中含有有色可溶性有机物等天然有机物,能吸收太阳光而自然降解[13]。鉴于天然富营养化水体中普遍存在大量的叶绿素和MC,且二者均具有明显的光降解效应,在UV-B照射下富营养化水体中叶绿素和MC很有可能表现出协同作用的降解特征,因此,在水体中添加叶绿素等天然有机物的方法可能是大幅提升MC的UV-B光降解效率的可行途径之一。基于上述问题,笔者通过开展国内富营养化水体中常见的藻毒素异构体MC-RR、MC-LR在叶绿素的添加与否条件下,研究UV-B照射下的降解特征,探讨蓝藻毒素降解的可能机制以及安全、无二次污染的去除水华MC的光降解方法。
1 材料与方法
1.1 试验材料
1.1.1 叶绿素的制备。
取60 g新鲜菠菜,按1 ∶ 4加入丙酮,在4 ℃下搅拌抽提30 min后,7 320 r/min下15 min离心,得到200 mL提取液,旋转蒸发器蒸干后,用适量丙酮溶液溶解,用超纯水稀释100倍以上后用0.22 μm针头过滤器过滤,配制成叶绿素a含量为17.48 μg/mL的水溶液,即刻用于试验。
1.1.2 微囊藻毒素纯品的制备。
微囊藻毒素MC-LR和MC-RR的纯化参照Shen等[1]和Lawton等[14]的方法。产毒微囊藻采用孔径60 μm浮游生物网采集自武汉市微囊藻水华严重暴发的池塘,经显微镜镜检,藻样的铜绿微囊藻优势度在98%以上。经晒干、粉碎后加入5%的乙酸4 L,用搅拌器搅拌抽提3 h。 提取液在6 900 r/min下离心20 min取上清;沉渣再用5%乙酸重复抽提2次,合并上清液,过C18柱分离纯化。纯化的洗脱液干燥后得到微囊藻毒素粗提物。毒素粗提物用10%乙腈(0.1%TFA)溶解后,用Gilson制备型HPLC,采用乙腈流动相、梯度淋洗技术进行纯化。收集毒素出峰中段,旋转蒸发器蒸干后再次加10%乙腈(0.1%TFA)溶解,反复制备2次,即纯化得到MC-RR和MC-LR的纯品。经分析型HPLC检测,MC-RR和MC-LR纯度均大于95%。用超纯水溶液将毒素稀释,分别配成MC-RR含量190 μg/mL、MC-LR含量34.5 μg/mL的水溶液。
1.2 试验方法
1.2.1 UV-B辐射试验。
UV-B光源为功率15 W的Cole-Parmer型紫外灯(波长312 nm)。取10个容量约4 mL的石英比色皿,分为对照组和处理组。每组石英比色皿中分别依次加入叶绿素水溶液、叶绿素+MC-RR水溶液、叶绿素+MC-LR水溶液、MC-RR水溶液、MC-LR水溶液。叶绿素和微囊藻毒素水溶液的比例为1 ∶1。
对照组在完全避光黑暗的环境下存放(室温25 ℃),以避免可见光对叶绿素的降解效应。处理组另采用辐射强度为2.0 mW/cm2的UV-B从石英比色皿的一侧水平方向照射(其他条件与对照组相同,完全避光)。UV-B的辐射强度通过调节紫外灯与比色皿距离的方法实现。每隔1 h对所有培养皿中的溶液取样,每次取溶液1.0 mL,用于微囊藻毒素和叶绿素含量测定。
1.2.2 反应溶液的吸收光谱检测。
取一定体积的MC-LR和叶绿素相关试验的反应溶液,用紫外分光光度计(Pharmacia Biotech,Ultrospec 3000)在400~800 nm扫描,扫描间距1 nm,作出其吸收光谱,观察UV-B辐射和MC-LR存在与否条件下叶绿素特征峰的变化规律。
1.2.3 微囊藻毒素检测。
微囊藻毒素检测方法参照沈强等[15]的方法,采用岛津LC-20A型HPLC测定毒素浓度。微囊藻毒素标准样品MC-RR、MC-LR购自SIGMA公司。HPLC色谱条件:检测波长238 nm;检测器为紫外检测器;流动相为KH2PO4(pH 3.0) ∶ CH3OH=40 ∶ 60(v/v);流速 1 mL/min;炉温 40 ℃;色谱柱为岛津ODS色谱柱(4.6 mm ×150 mm)。
1.2.4 叶绿素含量测定。
采用Parsons等[16]的方法测定叶绿素含量。取1 mL反应溶液加入4 mL丙酮,配成80%丙酮溶液,在分光光度仪(Pharmacia Biotech,Ultrospec 3000)上测定 663、646、470 nm下吸光度(以80%丙酮为空白)。
1.3 数据处理
试验数据采用Origin 9.0进行绘图与分析。微囊藻毒素降解率的计算公式:降解率=(A0-A)/A0×100%,式中,A0为起始浓度;A为反应溶液中浓度。
2 结果与分析
2.1 UV-B对MC的光降解
2.1.1 MC的降解。
在MC-RR、MC-LR的起始浓度分别为9.50和17.25 μg/mL、UV-B光强为2.0 mW/cm2、室温25 ℃的条件下,考察反应时间和添加8.74 μg/mL叶绿素a对UV-B降解微囊藻毒素的影响,结果如图1所示。
在无UV-B照射的避光室温条件下,无论有无叶绿素的添加,MC-RR和MC-LR水溶液均无降解;无添加叶绿素的微囊藻毒素水溶液,在UV-B照射下呈现较弱程度的光降解现象。其中,MC-RR水溶液经光强2.0 mW/cm2的UV-B照射1、2 h后,微囊藻毒素浓度从9.50 μg/mL分别降低至667、5.46 μg/mL,毒素降解率分别为29.8%和42.5%;MC-LR水溶液经光强2.0 mW/cm2的UV-B照射1、2 h后,微囊藻毒素浓度从17.25 μg/mL分别降低至14.33、11.85 μg/mL,毒素降解率分别为16.9%和31.3%。
而添加叶绿素a后,微囊藻毒素的UV-B光降解表现出显著的变化特征。在加入8.74 μg/mL叶绿素a后,MC-RR水溶液经光强2.0 mW/cm2的UV-B照射1、2 h后,毒素浓度分别降至0.02和0 μg/mL,毒素降解率分别为99.8%和100.0%;MC-LR水溶液在2.0 mW/cm2的UV-B照射1 h 后,毒素浓度也从17.25 μg/mL快速降至0,照射1 h后毒素降解率已达100.0%。
上述结果表明,浓度高达9.50~17.25 μg/mL的微囊藻毒素在叶绿素a的催化下,2.0 mW/cm2的UV-B照射2 h后,水中微囊藻毒素含量即降至HPLC的最低检出限以下,小于1.0 μg/L,达到WHO和《地表水环境质量标准》(GB 3838—2002)的要求。添加8.74 μg/mL叶绿素a后,微囊藻毒素的UV-B光降解速度可得到数量级的提升。
2.1.2 UV-B辐射下微囊藻毒素的光降解與异构化。
微囊藻毒素水溶液经UV-B(波长312 nm)照射后,毒素MC-RR、MC-LR的浓度逐渐降低,同时经HPLC检测发现,在MC-RR和MC-LR毒素峰后,分别出现了2个光降解产物峰,MC-RR和MC-LR的光降解产物保留时间分别为6.13、8.41 min。这2种物质与MC-RR和MC-LR有相似的色谱保留行为(图2~3)。
研究毒素的UV-B光降解异构体产物的浓度变化规律可见,在未添加叶绿素a的单一微囊藻毒素水溶液中,经光强高达2.0 mW/cm2的UV-B照射2 h后,MC-RR和MC-LR的光降解异构体和残余毒素的光谱面积比分别高达289%和217%,且浓度随着反应时间延迟有进一步逐渐升高的趋势(图2)。
进一步对比研究添加叶绿素a后的微囊藻毒素水溶液,经2.0 mW/cm2的UV-B照射1 h后,MC-RR和MC-LR降 解率分别高达99.8%和100.0%,2 h后所有毒素浓度均降低至HPLC的检测限以下;同时添加叶绿素a后,MC-RR和MC-LR溶液经UV-B照射1 h后,也均无微囊藻毒素的光降解异构体检出(图2~3)。
2.2 UV-B对叶绿素的光降解
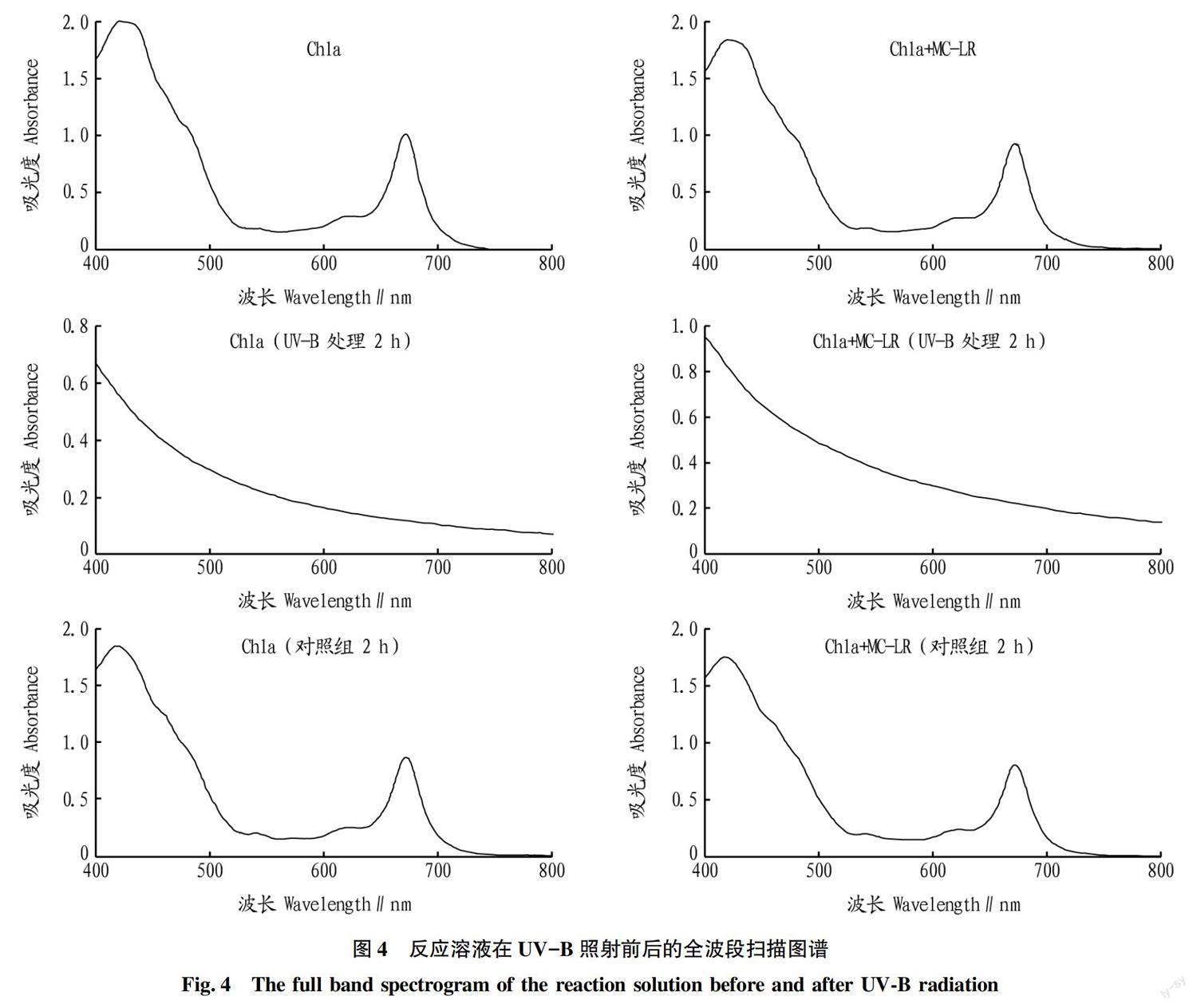
2.2.1 反应溶液的吸收光谱变动特征。
从图4可以看出,水溶液中的叶绿素a在蓝光区和红光区各有1个最大吸收峰,经过2 mW/cm2的 UV-B照射2 h 后,反应溶液的吸收光谱均发生了显著变化。叶绿素a水溶液的2个特征峰均完全消失,表明UV-B的能量可被叶绿素a吸收并导致叶绿素降解。而根据对溶液颜色的观察结果,UV-B照射后2 h的Chla和Chla+MC-LR这2个石英皿中溶液的绿色基本消失,变成微白色,该变化与色素吸收光谱的变化相同。
2.2.2 叶绿素在微囊藻毒素协同作用下的UV-B光降解。
从图5可以看出,
叶绿素溶液在黑暗避光的自然条件下,也存在缓慢的降解现象,单一的叶绿素溶液、添加MC-RR和MC-LR的叶绿素溶液在2 h内均有降解,自然降解率分别为8.2%、16.7%、11.5%;单一的8.74 μg/mL叶绿素a溶液,在光强2.0 mW/cm2的UV-B照射1、2 h后,叶绿素a发生快速降解, 其浓度由8.74 μg/mL分别迅速降至1.16、1.10 μg/mL, 叶绿素a的降解率分别高达86.7%和87.4%。可见,水体中的叶绿素a在UV-B照射下非常不稳定,迅速发生降解。
添加MC-RR、MC-LR的叶绿素a溶液,在2.0 mW/cm2的UV-B照射也发生不同程度的降解。添加MC-RR的叶绿素a溶液,UV-B照射1、2 h后,叶绿素a浓度从8.74 μg/mL分别降至7.09、5.90 μg/mL,叶绿素a的光降解率分别为189%和32.5%;添加MC-LR的叶绿素a溶液,UV-B照射1、2 h后,叶绿素a分别降至2.59、2.39 μg/mL,叶绿素a的光降解率分别为70.3%和72.7%。据此,该研究发现在叶绿素a的UV-B光降解试验中,微囊藻毒素MC-RR、MC-LR的添加明显延缓了溶液中叶绿素a光降解速率。
3 讨论
3.1 叶绿素高效催化微囊藻毒素UV-B降解的原理
不添加叶绿素情况下,微囊藻毒素水溶液在UV-B照射下呈现较弱程度的光降解,该原因可能是UV-B对微囊藻毒素的直接光降解的效率较低导致。光降解产物与MC相似的色谱保留峰表明微囊藻毒素光降解后产生异构化过程,与陈伟等[17]的试验结果类似。鉴于微囊藻毒素的异构化是一种可逆反应,光降解异构体仍然具有潜在的危害性[18],在无催化剂的条件下,仅采用高光强的UV-B无法达到高效消除水体中微囊藻毒素的目的。
添加叶绿素a后,微囊藻毒素浓度明显降低,无微囊藻毒素的光降解异构体检出,表明叶绿素a的添加极大效率低提升了微囊藻毒素的UV-B降解效率;其次,微囊藻毒素被完全降解,没有异构化产物的存在。紫外线可直接作用于微囊藻毒素Adda基团上的β、γ双键,导致微囊藻毒素的光降解和异构化[19-20],但紫外线直接光降解的效率低下,光强高达3 mW/cm2的UV-B照射下微囊藻毒素降解的半衰期超过20 h [17]。
叶绿素可作为一类天然的光敏催化物,叶绿素的加入可极大提升水体吸收紫外光能的效率,且叶绿素吸收光能后可发生光氧化,在水溶液中形成单线态氧,同时可形成有害的超氧离子、羟基自由基等[21]。该类物质可以高效地氧化攻击溶液中微囊藻毒素分子中的双键结构,从而导致微囊藻毒素产生了完全降解,有效避免了在单纯的UV-B照射下,微囊藻毒素光异构化产物的形成,及其造成二次污染的弊端。
3.2 微囊藻毒素对叶绿素a的UV-B光降解的保护效应
经过照射2 h 后,叶绿素a水溶液的2个特征峰及特征色彩的消失表明UV-B的能量可被叶绿素a吸收并导致叶绿素降解,该不稳定的特性与水体微囊藻毒素在UV-B照射下的特性相似。根据吸收光谱的变化特征推断,叶绿素高效催化微囊藻毒素的UV-B光降解的原因可能是叶绿素可以有效吸收UV-B光能量,并高效传导至微囊藻毒素分子的缘故。
该研究同时发现,微囊藻毒素的存在可延缓叶绿素a的光降解,对叶绿素a的UV-B光降解表现出一定保护作用,该现象目前鲜见同类的文献报道。推测微囊藻毒素在通过自身被氧化降解的同时,有效地清除了反应系统中的有害超氧离子、羟基自由基,通过牺牲自己充当了氧自由基清除剂的角色,从而一定程度保护了叶绿素的氧化降解,该类角色与植物体内的类胡萝卜、生育酚等的作用类似[21]。相关机理有待进一步研究。
3.3 研究与应用前景
该研究提出了叶绿素催化下的UV-B光降解体系,在1 h内降解微囊藻毒素的效率达到998%以上,且无潜在毒性的光异构体产生,催化效率高于UV/Fenton方法[22]、也远高于短波段的UV-C消除微囊藻毒素的效率[17]。同时,该试验中采用的UV-B在太阳光中天然存在,催化使用的催化剂叶绿素是天然富营养化水体的天然物质,该试验研究了UV-B辐射下微囊藻毒素和叶绿素a的协同降解特征,为野外环境条件下开展水体中微囊藻毒素的无污染降解提供了新方向。该研究的方法消除水体微囊藻毒素,不会对产生环境二次污染,对开发水体微囊藻毒素的消除新技术、提升饮用水的水质安全研究具有一定的应用价值。
4 结论
该研究以微囊藻毒素和叶绿素a为对象,研究了UV-B辐射下二者协同降解特征,为在野外环境中开展水体中微囊藻毒素的无污染消解提供新的探索方向。主要结论如下:
(1)2 mW/cm2的UV-B照射1 h,MC-RR、MC-LR的降解率分别为29.8%和16.9%,而添加叶绿素a后MC-RR、MC-LR降解率分别高达99.8%和100.0%。叶绿素a的催化可极大提高UV-B对微囊藻毒素的光降解能力。
(2)2 mW/cm2的UV-B照射1 h对叶绿素a、叶绿素a与MC-RR、MC-LR的混合溶液中叶绿素a的降解率分别为86.7%、18.9%和70.3%;照射2 h降解率分别为87.4%、325%和72.7%。微囊藻毒素的存在可延缓叶绿素a的光降解,对叶绿素a的UV-B光降解表现出一定保护作用。
(3)2 mW/cm2的UV-B照射2 h,MC-RR、MC-LR均产生大量的光降解异构体产物,异构体产物与残余微囊藻毒素的色谱面积比分别为28.9%和21.7%,而添加叶绿素a后MC-RR、MC-LR均被完全降解,微囊藻毒素和异构体产物均未检出。添加叶绿素a后微囊藻毒素可被完全光降解,避免了常规光降解产生大量潜在毒性的异构体产物的缺点。
(4)叶绿素对微囊藻毒素在UV-B照射下的降解速度具有显著的催化效应。该现象值得进一步深入研究,以应用于在野外環境中开展水体中微囊藻毒素的高效消除的研究。
参考文献
[1] SHEN Q,LI D W,LI D H,et al.Study on the safe disposal and resource utilization of cyanobacterial bloom biomass in Dianchi Lake,China[J].Journal of applied phycology,2020,32(2):1201-1213.
[2] 范亚民,姜伟立,刘宝贵,等.蓝藻水华暴发期间太湖贡湖湾某水厂水源水及出厂水中微囊藻毒素污染分析及健康风险评价[J].湖泊科学,2018,30(1):25-33.
[3] CHORUS I,BARTRAM J.Toxic cyanobacteria in water:A guide to their public health consequences,monitoring,and management[M].London:E&FN Spon,1999:60-62.
[4] 李响,寻昊,赵梦,等.粉末活性炭-超滤膜组合工艺去除水体中藻类及微囊藻毒素[J].净水技术,2017,36(2):62-68.
[5] 戴国飞,方少文,彭宁彦,等.Fe(Ⅲ)改性土壤用于微囊藻细胞及微囊藻毒素的去除[J].湖泊科学,2016,28(2):263-270.
[6] 赵勇,李伟英,张明,等.超滤膜对水中微囊藻毒素去除机理及影响因素研究[J].工业水处理,2010,30(4):26-29.
[7] 彭晓叶,汤嘉雯,杨钧岩,等.硫掺杂二氧化钛的光催化活性及其对微囊藻毒素的降解[J].水生态学杂志,2018,39(5):95-103.
[8] 赵漫,李冰,马燕天,等.应用环境微生物治理淡水湖泊微囊藻毒素污染的研究进展[J].微生物学通报,2018,45(4):893-899.
[9] 江敏,王婧,许慧.蓝藻毒素去除方法研究进展[J].生态学杂志,2014,33(12):3455-3462.
[10] TRIANTIS T M,FOTIOU T,KALOUDIS T,et al.Photocatalytic degradation and mineralization of microcystin-LR under UV-A,solar and visible light using nanostructured nitrogen doped TiO2[J].Journal of hazardous materials,2012,211/212:196-202.
[11] LIU X W,CHEN Z L,ZHOU N,et al.Degradation and detoxification of microcystin-LR in drinking water by sequential use of UV and ozone[J].Journal of environmental sciences,2010,22(12):1897-1902.
[12] 王晶,侯红英.青岛地区太阳紫外线辐射研究[J].中国海洋大学学报(自然科学版),2006,36(4):671-676.
[13] 王福利,郭卫东.秋季南海珠江口和北部湾溶解有机物的光降解[J].环境科学学报,2010,30(3):606-613.
[14] LAWTON L A,EDWARDS C.Purification of microcystins[J].Journal of chromatography A,2001,912(2):191-209.
[15] 沈强,李嗣新,胡俊,等.微囊藻胞内毒素的批量快速提取方法研究[J].环境科学与技术,2018,41(2):1-7.
[16] PARSONS T R,STRICKLAND J D H.Discussion of spectrophotometric determination of marine-plant pigments,with revised equations for ascertaining chlorophylls and carotenoids[J].Journal of marine research,1963,21(3):155-163.
[17] 陈伟,甘南琴,宋立荣.微囊藻毒素在单波长紫外光照射下的光降解动态研究[J].化学学报,2004,62(2):142-147,100.
[18] 陈晓国,肖邦定,徐小清,等.不同波段紫外光对微囊藻毒素光降解的影响[J].中国环境科学,2004,24(1):1-5.
[19] TSUJI K,WATANUKI T,KONDO F,et al.Stability of microcystins from cyanobacteria:II.Effect of UV light on decomposition and isomerization[J].Toxicon,1995,33(12):1619-1631.
[20] LIU I,LAWTON L A,ROBERTSON P K.Mechanistic studies of the photocatalytic oxidation of microcystin-LR:An investigation of byproducts of the decomposition process[J].Environmental science & technology,2003,37(14):3214-3219.
[21] RONTANI J F.Visible light-dependent degradation of lipidic phytoplanktonic components during senescence:A review[J].Phytochemistry,2001,58(2):187-202.
[22] 徐明芳,毛雪慧,曾樂,等.光反应器中UV/Fenton光降解湖水中微囊藻毒素的研究[J].环境工程学报,2008,2(7):932-937.
