射血分数保留的心力衰竭患者心肌纵向收缩力与动脉僵硬度关系的初步研究
2023-07-03李景植吴凌恒陈建雄沈崔琴孙佳丽杜联芳李朝军
李景植 吴凌恒 陈建雄 沈崔琴 孙佳丽 杜联芳 李朝军
射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)是指心肌主动松弛功能障碍、弹性恢复力降低及左室僵硬度增加等多种因素导致的心室充盈压升高、左室舒张功能障碍的一种复杂临床综合征,其发病隐匿,长期预后不良[1]。HFpEF发病率随年龄增长而增加,且其与高血压、糖尿病及心房颤动等密切相关[2]。既往研究[3]发现,心脏与动脉耦联发病,即收缩性心力衰竭(以下简称心衰)与动脉僵硬度增加同步出现,互为因果,推测HFpEF患者动脉僵硬度增加会增大HFpEF 的发生风险,同时可能存在部分心肌收缩功能障碍。动脉波速指数(AVI)是通过分析肱动脉震荡波获取的能反映中心大动脉僵硬度的新指标,可独立预测心血管事件的发生[4]。本研究通过获取HFpEF患者动脉僵硬度指标AVI,以及左室结构、功能及血流动力学指标,初步探讨其心肌纵向收缩力与动脉僵硬度的关系,为临床诊治提供参考依据。
资料与方法
一、研究对象
选取2022年1~10月于我院就诊的HFpEF患者29例(HFpEF 组),男12 例,女17 例,年龄39~69 岁,平均(59.0±7.4)岁。纳入标准:HFpEF 依据2021 年欧洲心脏病学会诊断指南[5],即存在心衰的体征和症状、左室射血分数(LVEF)≥50%,以及左室舒张功能不全或舒张末压增高。排除标准:①既往有严重的心血管疾病史,包括冠心病、中重度瓣膜反流、心律失常、心肌病等;②先天性心脏病;③近3 个月存在活动性出血或伴血液病、恶性肿瘤、严重肝肾肺疾病。另选同期年龄、性别与之匹配的健康受试者53 例为对照组,男17 例,女36 例,年龄39~68 岁,平均(57.2±7.6)岁。本研究经我院医学伦理委员会批准,所有受试者均签署知情同意书。
二、仪器与方法
1.仪器:使用Philips EPIQ 7 彩色多普勒超声诊断仪,S5-1 探头,频率1~5 MHz,帧频≥60 帧/s;配备QLAB 13.0图像分析工作站。
2.超声心动图检查:参照《中国成年人超声心动图检查测量指南》[6],受试者取平卧位或左侧卧位,平静呼吸,同步记录胸导联心电图。使用M 型超声心动图获取室间隔舒张末期厚度(IVSD)、左室后壁舒张末期厚度(LVPWD)、左室舒张末期内径(LVEDD)和左室收缩末期内径(LVESD);使用脉冲多普勒获取二尖瓣口舒张早期和晚期血流速度峰值(E、A),计算E/A;使用组织多普勒获取二尖瓣环侧壁瓣舒张早期和晚期运动速度峰值(e’、a),计算E/e’;应用双平面Simpson 法测量左室射血分数(LVEF)。于心尖四腔心、心尖三腔心、心尖两腔心、心底水平、乳头肌水平及心尖水平切面分别获取心率稳定的连续3个心动周期的左室长轴和短轴观动态图像并储存,导入QLAB 13.0 图像分析工作站,使用二维斑点追踪技术行二维应变分析,系统自动于收缩末期勾画心内膜、心外膜环状感兴趣区,勾画不满意时可手动调整其边界,使其与心肌厚度一致,自动计算左室整体环向应变(GCS)和整体纵向应变(GLS)。以上所有指标均重复测量3次取平均值。
3.一般资料获取:收集受试者一般资料及病史,计算体质量指数(BMI)。受试者均采集清晨空腹静脉血,检测B 型利钠肽(BNP)、肌酐、肾小球滤过率(GFR)、肌酸激酶同工酶(CK-MB);于平静状态下使用中国深圳兆和PASESA 便携式动脉脉搏波速率检测仪(AVE-2000Pro)获取收缩压(SBP)、舒张压(DBP)和动脉波速指数(AVI),均重复测量3 次取平均值。
4.重复性检验:随机抽取15 例HFpEF 患者,间隔1 周后由同一观察者使用相同方法再次测量AVI 和GLS,检验其在观察者内重复性。
三、统计学处理
结果
一、两组一般资料比较
与对照组比较,HFpEF 组AVI 和CK-MB 均增大,差异均有统计学意义(均P<0.05);两组其余一般资料比较差异均无统计学意义。见表1。

表1 两组一般资料比较
二、两组超声心动图指标比较
与对照组比较,HFpEF 组IVSD、LVPWD、E/e’均增大,E/A、E、e’及GLS 均减低,差异均有统计学意义(均P<0.05);两组其余超声心动图指标比较差异均无统计学意义。见图1和表2。
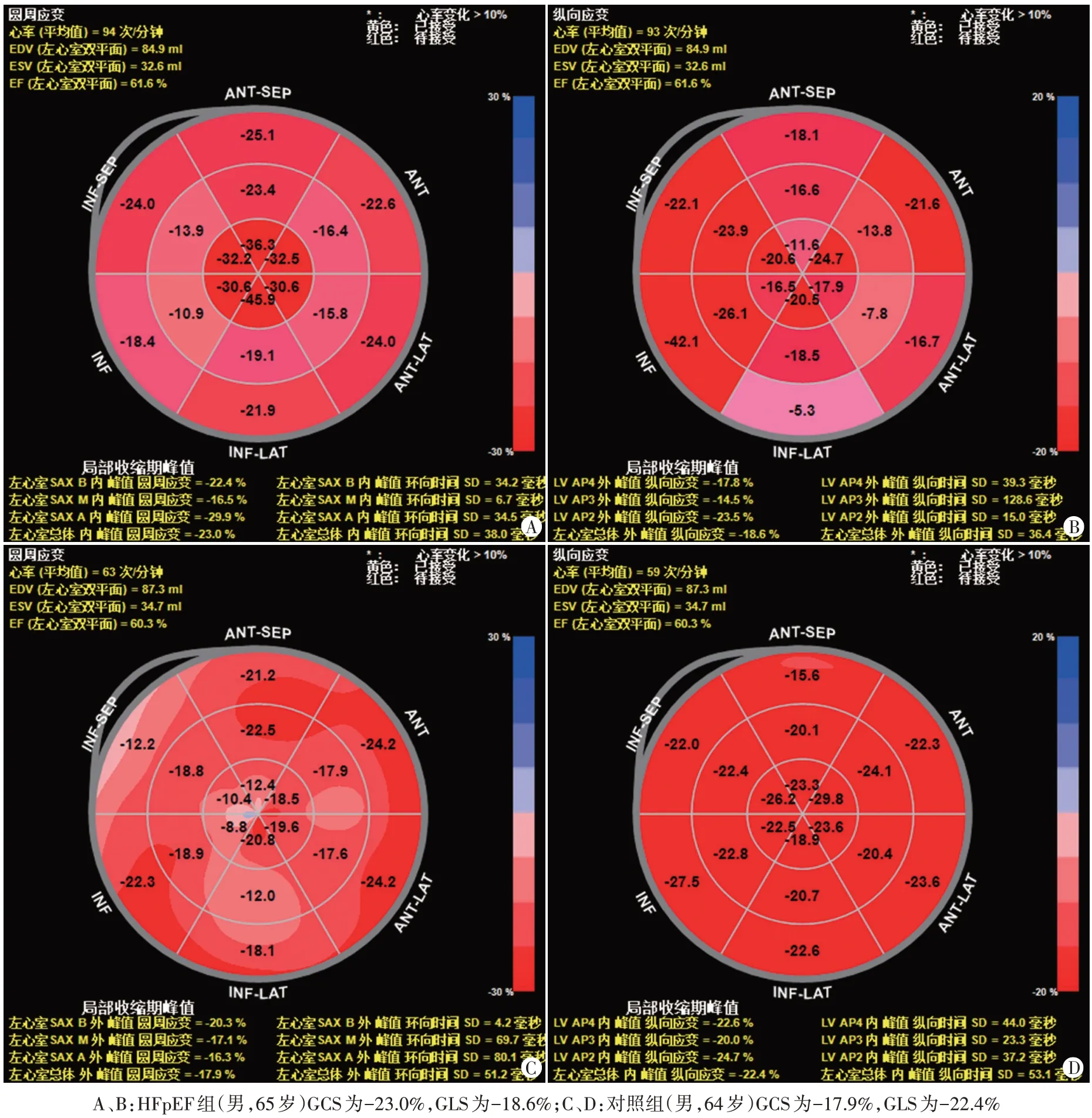
图1 两组左室心肌GCS和GLS牛眼图
表2 两组超声心动图指标比较()

表2 两组超声心动图指标比较()
LVEDD:左室舒张末期内径;LVESD:左室收缩末期内径;IVSD:室间隔舒张末期厚度;LVPWD:左室后壁舒张末期厚度;E、A:二尖瓣口舒张早期和晚期血流速度峰值;e’、a:二尖瓣环侧壁瓣环舒张早期和晚期运动速度峰值;LVEF:左室射血分数;GCS:整体环向应变;GLS:整体纵向应变
GLS(%)-23.0±4.0-21.0±4.0-2.226 0.029组别对照组HFpEF组t值P值LVEDD(mm)45.4±3.9 45.3±3.9 0.095 0.925 LVESD(mm)27.9±2.9 28.8±3.2-1.268 0.209 IVSD(mm)9.1±0.9 9.5±0.9-2.080 0.041 LVPWD(mm)8.7±0.9 9.4±0.9-2.861 0.005 E A a(cm/s)74.6±21.3 59.7±14.7 3.330 0.001(cm/s)72.9±16.5 74.6±17.6-0.429 0.669 E/A 1.1±0.4 0.8±0.3 2.933 0.004 e’(cm/s)12.3±2.2 7.5±1.2 10.724<0.001(cm/s)12.1±3.1 11.0±2.1 1.678 0.097 E/e’6.1±1.6 8.2±2.0-4.890<0.001 LVEF(%)62.0±7.0 61.0±7.0 0.496 0.621 GCS(%)-24.0±10.0-23.0±8.0-0.283 0.778
三、相关性分析
相关性分析显示,AVI与GCS 呈负相关(r=-0.241,P<0.05),与E/e’呈正相关(r=0.288,P<0.05),与其余超声心动图指标均无相关性。
四、Logistic回归分析
Logistic 回归分析采用向前逐步法,第1 步先将AVI 纳入模型,提示AVI 是发生HFpEF 的危险因素(OR=1.174,P=0.030);第2 步将AVI 和LVPWD 纳入模型,提示二者均是发生HFpEF的危险因素(OR=1.240、2.448,P=0.014、0.020);第3 步将AVI、LVPWD、E纳入模型,提示AVI和LVPWD 均是发生HFpEF 的危险因素(OR=1.249、2.635,P=0.025、0.016)。见表3。

表3 Logistic回归分析
五、重复性检验
Bland-Altman 分析显示,AVI 和GLS 两次测量差值与均值呈一致性的变化趋势。线性回归分析显示,AVI和GLS 两次测量值均呈线性相关(R2=0.91、0.81,均P<0.01)。见图2。

图2 同一观察者两次测量AVI、GLS的Bland-Altman散点图和线性关系图
讨论
HFpEF 被称为舒张性心衰,是以心肌主动松弛功能障碍、心室充盈压升高、舒张功能减退、收缩功能障碍为主要机制的一种复杂的临床综合征,患者临床表现呈高度异质性。流行病学数据显示,HFpEF 发病率逐年升高,在全球自然人群中患病率约1.1%~5.5%,在心衰人群中占比达30.1%~59.7%[7];欧洲60 岁以上人群中,HFpEF 患病率约4.9%,在住院心衰人群中HFpEF 占比超过50.0%[5]。HFpEF 病因尚未明确,患者心肌收缩功能是否受损,以及左室舒张功能、收缩功能、大动脉僵硬度三者间的关系尚不清楚。本研究旨在探讨HFpEF 患者心肌纵向收缩力与动脉僵硬度的关系。
既往研究[8]表明,心脏收缩功能和舒张功能相互影响,即舒张性心衰存在轻度收缩功能异常,收缩性心衰存在心脏舒张功能不全。HFpEF 与射血分数降低性心衰的关系一直存在争论,尚未明确二者是同一疾病的不同阶段,还是两种不同疾病。本研究发现,HFpEF患者LVPWD增大,舒张功能指标E/A和E/e’均减低,左室纵向收缩功能指标GLS 减低,与对照组比较差异均有统计学意义(均P<0.05);而两组左室环向收缩功能指标GCS 和整体收缩功能指标LVEF 比较差异均无统计学意义,提示左室纵向收缩力异常,而环向和整体收缩力均正常,表明HFpEF 患者部分心肌可能已经存在收缩功能障碍。但另有研究[9]发现,HFpEF 患者左室径向应变减低,分析原因可能为多种因素导致心肌细胞损伤和细胞外基质重构,但由于其未涉及GLS、GCS等指标,无法判断HFpEF患者心脏在不同方向上收缩力变化的差异。有研究[10]应用左室压力-应变环评估HFpEF 患者GLS 和心肌做功指数,结果发现GLS 和心肌做功指数均较正常对照组减低(均P<0.05),但该研究未涉及GCS。本研究的独特之处是同时获取HFpEF 患者GLS 和GCS,结果提示其心肌纵向收缩力异常,而心肌环向和整体收缩力均正常。分析原因可能为心脏收缩和舒张运动发生在空间的多个方向,心肌在不同方向的收缩和舒张功能存在代偿和制约,纵向收缩对心脏整体收缩功能的贡献较环向收缩更大[11-12]。
高血压是发生HFpEF 的主要危险因素,因此可以通过高血压间接探讨动脉僵硬度与HFpEF 的关系。Pugliese 等[13]研究发现,HFpEF 患者血管僵硬度和心室弹性均较正常对照组更高,GLS 更低,心室-血管耦合更差,差异均有统计学意义(均P<0.05)。研究[14]也提示,HFpEF 患者同时存在动脉僵硬度增加、内皮功能障碍和心室-血管耦合失匹配[15-16]。本研究结果发现,动脉僵硬度指标AVI 与E/e’呈正相关(r=0.288,P<0.05),与GCS 呈负相关(r=-0.241,P<0.05)。分析原因可能为AVI 主要反映中心大动脉僵硬度,动脉僵硬度增大会使心脏后负荷和心肌耗氧量均增加,射血时间延长,可能导致心肌劳损、左室舒张末期压力升高,促使HFpEF 的发生[17]。本研究Logistic 回归分析发现,AVI和LVPWD均是发生HFpEF的危险因素(OR=1.249、2.635,P=0.025、0.016),与既往研究[18]结果一致。这一结果可通过心肌能量代谢进行解释,心肌组织的弛豫是通过能量依赖性肌丝解离和心室、心包内非心肌细胞基质的被动弛豫实现的。舒张期左室心肌主动弛豫受损,被动舒张硬度增加(左房-左室耦合);收缩期左室和动脉僵硬度增加(左室-动脉耦合),表明收缩功能和舒张功能之间存在紧密耦合,当收缩期发生某些损害时,可能反映在舒张期[19]。提示无论是从力学角度还是从能量学角度,临床很难准确区分这两种异常。另外,本研究重复性检验显示同一观察者测量AVI 和GLS 的重复性均较好,这为未来研究HFpEF 患者动脉僵硬度与心肌能量代谢、左房-左室耦合、左室-动脉耦合等提供了依据。
本研究的局限性:①样本量较小,未对HFpEF 病程进行分层研究;②未纳入HFpEF 共病(如糖尿病、高血压和慢性肾脏疾病),未分析共病对动脉硬化的潜在影响;③横断面设计也存在不足,未获取HFpEF 患者的结局事件;④本研究使用的心肌应变分析软件的分析流程未涉及二维图像质量评估环节,其准确性仍需进一步验证。
综上所述,HFpEF 患者动脉僵硬度增加、心室壁增厚、心肌纵向收缩力减低,增加的动脉僵硬度与心肌纵向收缩力具有相关性。
