基于ADC值变化量评估宫颈癌放化疗预后的价值
2023-06-29张庆李云熊浩彭婕
张 庆 李 云 熊 浩 彭 婕
长江大学附属第一医院荆州市第一人民医院放射影像科 (湖北 荆州 434000)
宫颈癌已成为全球发病率最高的妇科生殖道恶性肿瘤,在中国女性中,其发病率亦呈持续上升趋势[1]。同步放化疗(concurrent chemoradiotherapy,CCRT)[2-3]是宫颈癌的有效治疗方法,但是即使接受CCRT,患者仍然面临着转移及复发的高风险,且由于肿瘤的异质性[4],并不是所有的肿瘤都对同步放化疗敏感。据报道[5],全球宫颈癌复发率约为20-30%。鉴于宫颈癌高复发率及死亡率,对于宫颈癌疗效的早期评估和预测显得至关重要。弥散加权成像(diffusion-weighted imaging,DWI)是一种功能成像技术,表观弥散系数(apparent diffusion coefficient,ADC)能够量化水分子弥散受限的程度。国内外研究显示[6-9],DWI序列及ADC值有助于宫颈癌的诊断及疗效的评价。本研究主要探索宫颈癌的不同ADC值与其放疗后预后生存的相关性。
1 资料与方法
1.1 患者资料回顾性分析2016年1月至2019年8月于我院接受同步放化疗且有完整MRI及随访资料的患者。
纳入标准:经病理证实为原发性宫颈癌;于我院同步放化疗治疗,且同步放化疗前、四周后均于我科室行MRI扫描。排除标准:之前有宫颈癌手术或放化疗史;随访资料不完善着。纳入76名患者,年龄32-70岁,平均(53.6±5.5)岁。上述所有受检者均无MRI禁忌症。同时通过我院病历系统记录患者临床病理性质,患者前两年每3或6各月随访一次,以后每年随访一次。随访终点为无病生存期(Disease-free survival,DFS),DFS被定义为从放化疗开始到临床进展或因任何原因死亡的时间。本研究获得长江大学附属第一医院伦理委员会批准,免除受试者知情同意(20220829)。
1.2 MRI扫描方案分别于放疗前、放疗后四周运用飞利浦3.0 T MR(InteraAchievaTX)仪及18通道体部相控阵线圈进行盆腔扫描。扫描范围为髂骨翼上缘至耻骨联合水平。扫描序列及参数:常规T1WI轴位,抑脂-T2WI,矢状位、冠状位T2WI,高分辨T2WI,DWI轴位。采用梯度回波序列行 DWI(b=50s/mm2,800s/mm2,)轴位扫描,TR 4.154ms,TE 2.20ms,矩阵154×192,层厚5.5mm,层间距1.0mm,视野260mm×260mm。
1.3 图像分析由2名腹部组中高年资影像诊断医师在Extended MR Workplace工作站上通过Functool软件重建出ADC图(图1)。在不知晓肿瘤临床与病理信息的情况下,2名诊断医师人工勾画出肿瘤感兴趣区(region of interest,ROI)。ROI的大小尽可能地全部覆盖该层面肿瘤区域,采用 Functool的像素分析软件测量病灶每个ROI的ADC值,求其平均值。△ADC%定义为:(治疗后ADC-治疗前ADC)/ 治疗前ADC。在T2WI轴位、冠状位或矢状位上比较得出肿瘤的最大直径。
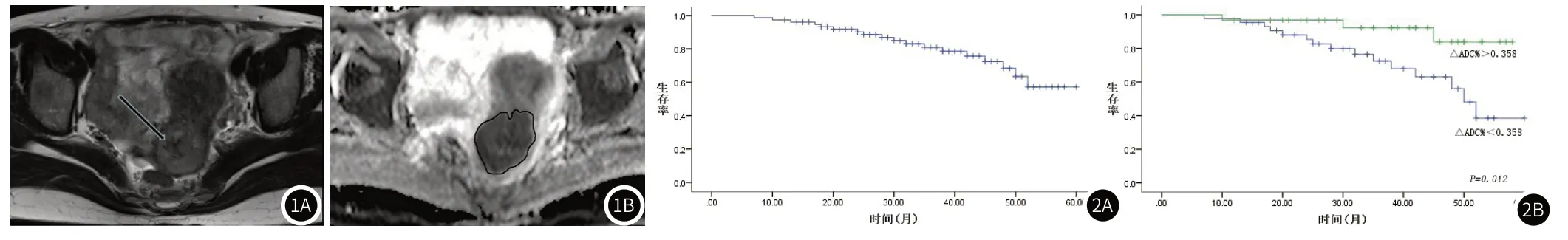
图1 肿瘤MRI图像。注:图1A:原发肿瘤T2WI,病灶呈稍长T2信号。图1B:原发肿瘤ADC图,ADC值为0.928x10-3mm2/s。图2 患者DFS曲线。注:图2A:所有肿瘤患者DFS曲线。图2B:△ADC%<0.358、△ADC%>0.358患者DFS曲线,log-rank检验P=0.012。
1.4 统计学方法应用 SPSS(Statistic Package for Social Science)21.0软件统计包对数据进行分析,数据正态性检验采用单样本正态分布检验。单因素COX回归分析用于评估临床和影像资料(包括年龄、病理类型、FIGO分期[10]、淋巴结状态、治疗前肿瘤长径、治疗前ADC值、治疗后ADC值、△ADC%)与肿瘤预后的关系,P值<0.05时进一步使用多因素COX回归分析筛选出肿瘤预后的独立危险因素。受试者工作特征曲线(receiver operator characteristic curve,ROC)确定危险因素的最佳截断值,采用Kaplan-Meier法对DFS进行生存分析,log-rank检验用于比较患者生存曲线之间的差异。
2 结果
2.1 病人特征及随访结果患者及肿瘤特征见表1。患者的平均随访时间为35个月(范围12-60个月)。3例(4%)患者在放化疗后18个月、20个月和24个月发生肿瘤相关死亡。复发15例(20%),局部复发7例,局部复发伴远处转移者5,仅远处转移3例。1年和3年的DFS率分别为97%和81%(图2A)。

表1 患者及肿瘤特征
2.2 危险因素与肿瘤预后的关系宫颈癌危险因素与肿瘤患者预后的关系见表2。单因素分析显示治疗前ADC值、△ADC%是肿瘤进展的危险因素(P=0.015,P=0.005)。多因素分析显示只有△ADC%是肿瘤进展的高危因素(P=0.048)。ROC曲线示最佳截断值为0.358(曲线下面积为0.847,敏感度为83.3%,特异度为75.9%),Kaplan-Meier曲线显示△ADC%<0.358的DFS显著低于>0.358患者(P=0.012)(图2B)。

表2 患者危险因素COX回归分析
3 讨论
宫颈癌常用的预后因素包括肿瘤的大小、病理类型、淋巴结转移和FIGO分期等[11-13],但这些形态病理学特征并不能充分并全面地预测肿瘤患者的预后。DWI能在常规形态学改变之前量化治疗引起的肿瘤内部变化[14-15],适用于肿瘤治疗后的长期随访,可用于宫颈癌放化疗疗效的评估及肿瘤复发或进展的监测。本研究结果显示,△ADC%是影响宫颈癌放化疗后DFS的独立危险因素,△ADC%较大的患者具有更高的DFS。患者临床病理性质与DFS无关,可能和样本及研究终点的选取有关,也可能说明相较于临床病理性质,能够反应放化疗过程中细胞分子动态变化过程的ADC变化量与肿瘤的预后及生存关系更为密切。
有效地放化疗能够杀死肿瘤细胞和降低肿瘤细胞的活性,导致肿瘤组织水分子弥散特性的改变。因此,肿瘤放化疗前后ADC值的改变量可以用来反应肿瘤组织对放化疗的敏感性。ADC值改变量越大,说明肿瘤组织对放化疗越敏感,治疗效果越好,拥有较高的无病生存期。我们的结果很好的印证了这一观点,ADC变化量是影响宫颈癌放化疗后DFS的独立危险因素,且ADC变化量较大的患者拥有相对更高的DFS。与我们的研究结果类似,基于放化疗后,Somoye等[16]的研究表明存活组患者的ADC变化量显著高于死亡组,Park等[17]的结果显示ADC变化量是宫颈癌疾病进展的独立预测因子,Gu等[18]报道ADC变化量是宫颈癌无进展生存期(PFS)的独立影响因子,Onal等[19]的研究显示ADC变化量是宫颈癌总生存期(Overall survival,OS)的预测因子。与我们的结果一致,Yui等[20]的研究表明ADC变化量是宫颈癌复发的独立预测因子,而且ADC变化量较低的患者具有较差的无病生存期,但是他们的研究对象为部分患者接受放化疗,少部分接受放疗的混合治疗,而我们的研究对象均为同步放化疗,因此我们的研究更具说服力。
宫颈癌放化疗前ADC值与肿瘤预后的关系存在较大争议,目前尚无明确的定论。以前的研究观点认为[21-24],放化疗前ADC均值是宫颈癌DFS的独立预测因素。然而近些年的大部分研究显示,放化疗前ADC均值与宫颈癌的预后无关[25-30],而部分放化疗前其他ADC值可能与肿瘤患者预后相关。Heo等[25]认为ADC75是肿瘤复发的预测因子,Adam等[26]认为ADC95是宫颈癌放DFS的独立预测因素,Daniel等[27]认为ADC最小值可能是宫颈癌DFS的相关预测因素,Shih等[28]和Qin 等[29]认为ADC最小值是宫颈癌PFS的独立预测因子。我们的结果与近些年的研究一致,放化疗前ADC均值并不能预测宫颈癌的预后和生存状态。关于放化疗前ADC值与患者预后及生存的关系还待进一步研究。
本研究具有几点局限性。第一,本文为回顾性研究,且从病历系统获取信息,难免会产生偏倚。第二,由于本研究的样本量相对较小,且为单中心研究,因此需要更大样本的多中心结果进行验证。
总结,我们的研究结果表明,ADC变化量可能是宫颈癌同步放化疗过程中疾病进展与生存的有效预测指标,可能作为宫颈癌预后评估与预测的早期影像标记物。
