DCE-MRI、多b值DWI结合CA153、CEA对乳腺癌及肿块型浆细胞性乳腺炎的鉴别诊断价值研究*
2023-06-29何瑞红钱伟军
何瑞红 李 立 钱伟军
河南省开封市中心医院医学影像科 (河南 开封 475000)
浆细胞性乳腺炎(PCM)一种病程较长、病变较复杂的非细菌性慢性乳腺炎症[1-2],在乳腺良性病变中约占1-5%左右,临床上主要分为溢液期、肿块期、脓肿期和瘘管期,大部分患者无明显炎症反应,白细胞和体温正常,且可伴乳头凹陷、乳腺肿块、乳头溢液、局部皮肤橘皮样变、同侧腋窝淋巴结肿大等改变,特别是肿块期患者临床可触及肿块,因此肿块型PCM与乳腺癌患者无论是临床还是影像学表现均有很多重叠地方,从而影响疾病的诊断、临床治疗和预后[3]。与乳腺钼靶、超声相比,磁共振成像(MRI)对多发病灶、多中心检出率较高,具有高软组织分辨率,且对于病灶累及乳后间隙的显示具有优势[4]。动态增强MRI(DCE-MRI)不仅可显示病灶形态学表现,还可通过计算出动态增强定量参数,可对病灶做出定量判断,使判断结果更为客观。扩散加权成像(DWI)可无创检测体内水分子扩散运动,根据组织中水分子扩散速度不同而成像,通过测量表观扩散系数(ADC)实现,但b值的大小会影响ADC值的准确性,故选择合适的b值将直接影响诊断结果的判读[5]。血清糖类抗原125(CA125)、癌胚抗原(CEA)等肿瘤标志物的应用可提高早期乳腺癌的诊断水平,且早期发现可显著提高患者预后生存率,但其灵敏度相对不高[6]。因此,本研究通过探讨DCE-MRI、多b值DWI结合CA153、CEA对乳腺癌及肿块型PCM的鉴别诊断价值,以期为临床工作提供一定参考。
1 资料与方法
1.1 一般资料回顾性分析2018年4月至2021年10月我院经病理检查证实的乳腺癌及肿块型PCM患者的临床资料。所有患者均行乳腺MRI平扫、动态增强及多b值DWI检查。患者均为女性,就诊时处于非哺乳期和非妊娠期。乳腺癌患者55例,平均年龄(44.32±5.74)岁;肿块型PCM患者48例,平均年龄(43.69±4.24)岁。临床表现多为乳腺疼痛、乳腺包块、乳头溢液等就诊。
纳入标准:临床资料完整,就诊时均未行手术、放化疗、激素或靶向治疗;对本研究进行的MRI检查不存在禁忌症且MRI检查图像结果显示符合诊断标准;所有患者均行手术得到病理证实者。排除标准:乳腺假体植入者;存在包括肾、心、肝功能等障碍者。
1.2 检查方法
1.2.1 常规MRI、DCE-MRI以及多b值DWI检查 采用美国GE公司生产的Discovery MR750 3.0 T MR扫描仪。患者取俯卧位,扫描双侧乳腺及腋窝,采用Gd-DTPA为MR增强对比剂,流率:2.0mL/s,剂量:15mL,扫描序列及扫描参数:T1 FSE TR 793ms,TE Min Full;T2 FSE-IDEAL TR 5263ms,TE 85ms;层厚4mm,层间距1mm;FOV为340mm×340mm。DWI扫描参数:TR 8150ms,TE Minimum,层厚4mm,层间距1mm,FOV:340mm×340mm,b值取400、800、1000s/mm2;动态增强(VIBRANT Dynamic)TE 2.1ms,TR 4.3ms,FOV为320mm×320mm,层厚1.8mm。动态增强共7期,第1期为T1WI压脂序列预扫描,注入对比剂后连续无间隔采集6个时相,每个时相扫描50s,增强后扫描6min。所有扫描序列采用横断位,对病灶需要的患者进行冠、矢状位重建。
1.2.2 图像分析 患者图像传输至GE ADW4.5后应用Functool软件对本文研究数据进行分析,通过两名放射科诊断医师(具有8年以上工作经验)判读MRI检查结果,结论不一致时需要协商。ADC值、动态增强MRI感兴趣区、DWI评分的分析使用Functool软件,测量时需最大层面完全置于病灶内,避开坏死、出血区域,所取平均值均为3次随机测量。在病灶区域通过绘制感兴趣区自动生成ADC值,应用动态增强MRI绘制时间-信号强化曲线(TIC),并计算血管外细胞外间隙体积百分数(Ve)、转运常数(Ktrans)、速率常数(Kep)。
1.2.3 CA153、CEA检测 于患者入院当日清晨采取空腹外周静脉血,采用化学发光法进行检测,使用上海罗氏有限公司生产的全自动化学发光免疫分析仪以及其配套CA153、CEA检测试剂盒,严格按照说明书进行实验操作。正常值参考范围:CA153<28U/mL,CEA<3.5ug/mL。
1.3 统计学方法采用SPSS 22.0统计分析软件。定量参数Ktrans、Kep等计量资料实施t检验,表示方式为()。计数资料以频数表示,实施χ2检验。乳腺癌及肿块型PCM的MRI形态学表现采用Fisher确切概率法或χ2检验。多组间比较采用单因素方差分析。采取曲线下面积(AUC)分析不同b值,DCE-MRI、多b值DWI,CA153、CEA对乳腺癌及肿块型PCM的鉴别诊断价值。检验水准α=0.05。
2 结果
2.1 乳腺癌及肿块型PCM的MRI形态学表现55例乳腺癌多发生于外上象限(34例,61.82%),48例肿块型PCM多发生于乳晕周围(34例,70.83%)。55例乳腺癌均为单发病灶,肿块型PCM中有12例为双乳多发结节,两者差异有统计学意义(χ2=16.056,P=0.000)。MRI平扫乳腺癌和肿块型PCM在T1WI序列大部分呈等或稍低信号,T2WI呈稍高信号或高信号或混杂信号。由表1可知乳腺癌与肿块型PCM在强化方式、病灶边缘、TIC曲线类型、有无导管扩张方面有统计学差异(P<0.05),两者间病灶形状无统计学差异(P>0.05)。乳腺癌毛刺征占比为43.63%,高于肿块型PCM的0.00%;乳腺癌有导管扩张占比为25.45%,低于肿块型PCM的83.33%;乳腺癌TIC曲线Ⅱ型和Ⅲ型的占比为90.91%,低于肿块型PCM的Ⅰ型和Ⅱ型的95.84%,组间差异具有统计学意义(P<0.05),见表1。

表1 乳腺癌及肿块型PCM的MRI形态学表现[n(%)]
2.2 乳腺癌及肿块型PCM的DCE-MRI定量参数比较由表2可知乳腺癌和肿块型PCM的DCE-MRI定量参数Ktrans、Kep差异均有统计学意义(P<0.05),两者间DCE-MRI定量参数Ve差异无统计学意义(P>0.05),且乳腺癌组患者Ktrans、Kep值均比肿块型PCM组患者更高(P<0.05)。
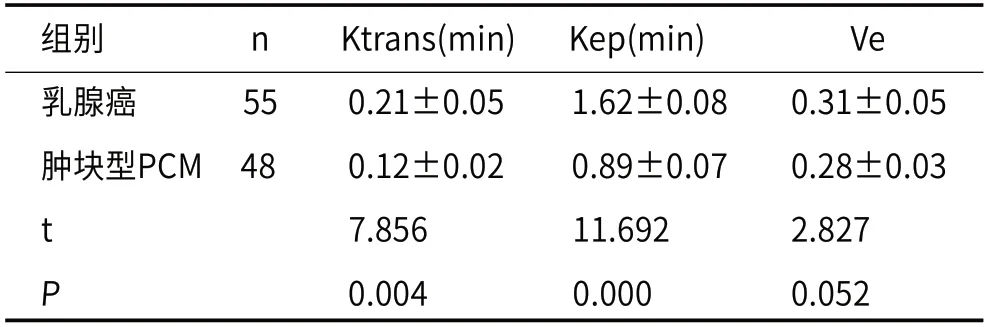
表2 乳腺癌及肿块型PCM的DCE-MRI定量参数比较
2.3 多b值DWI对乳腺癌及肿块型PCM的ADC值比较在相同b值时,乳腺癌的ADC值均低于肿块型PCM,且差异有统计学意义(P<0.05);随着b值增大,乳腺癌或肿块型PCM的ADC值降低,但三组间比较差异无统计学意义(P>0.05),见表3。当b值分别取400、800、1000s/mm2时,对应AUC值分别为0.621、0.754、0.801,b值为1000s/mm2时诊断乳腺癌、肿块型PCM的准确度、敏感度、特异度最高,诊断效能最佳,见表4。
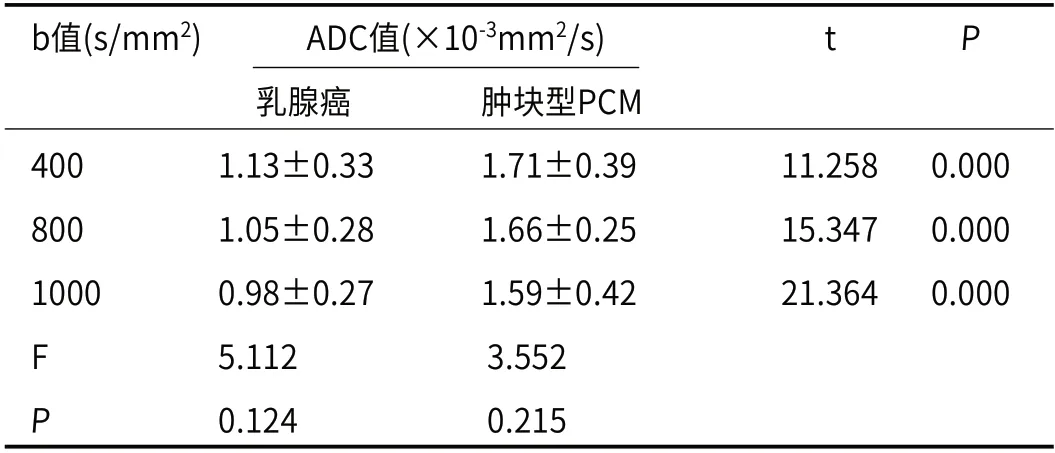
表3 多b值DWI对乳腺癌及肿块型PCM的ADC值比较
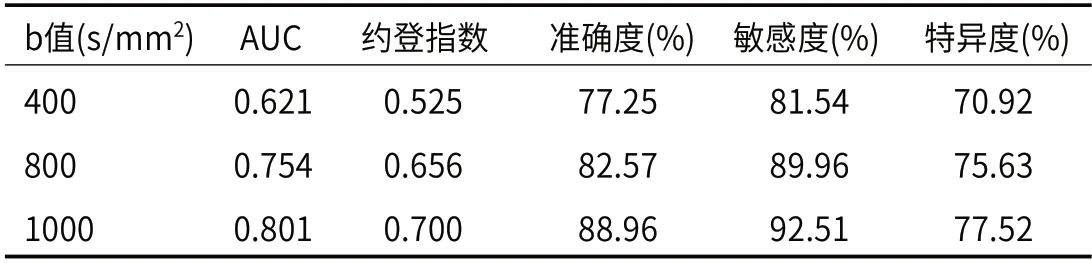
表4 不同b值对乳腺癌、肿块型PCM的诊断效能比较
2.4 乳腺癌及肿块型PCM患者血清CA153、CEA比较乳腺癌患者血清CA153、CEA表达水平均高于肿块型PCM患者(P<0.05),见表5。
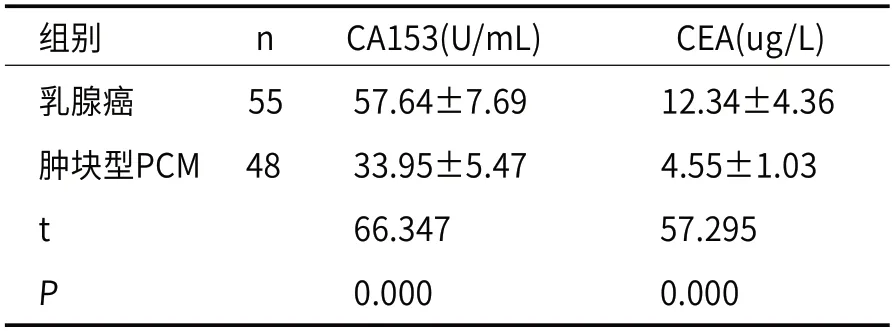
表5 乳腺癌及肿块型PCM患者血清CA153、CEA比较
2.5 由表6可知DCE-MRI、多b值DWI,CA153、CEA对乳腺癌及肿块型PCM的鉴别诊断价值比较由表6可知,DCE-MRI、多b值DWI结合CA153、CEA对乳腺癌及肿块型PCM的鉴别诊断价值优于单独应用DCE-MRI、多b值DWI、CA153、CEA。
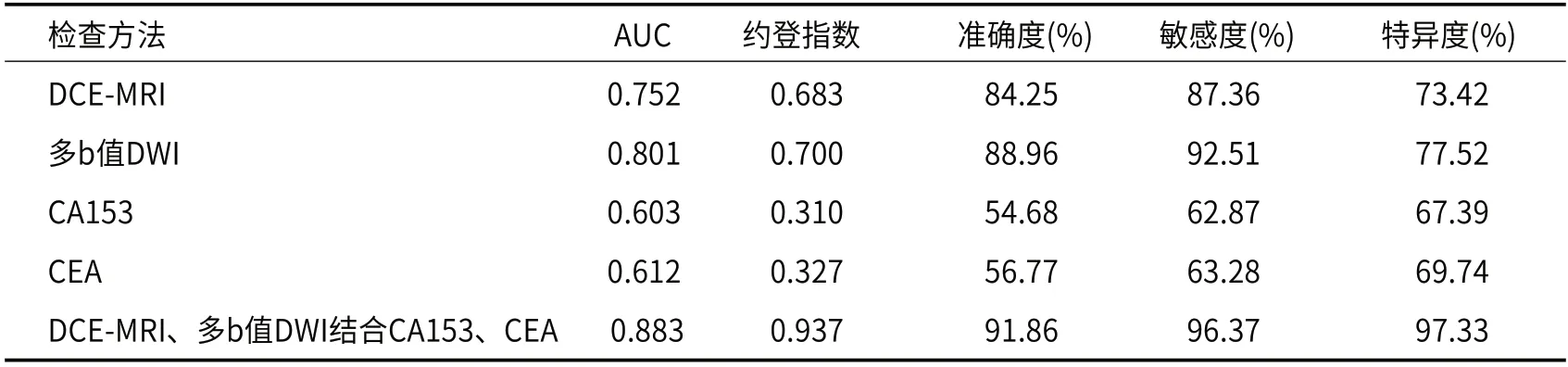
表6 DCE-MRI、多b值DWI,CA153、CEA对乳腺癌及肿块型PCM的鉴别诊断价值比较
2.6 典型病例患者女,35岁,经术后病理证实为右乳肿块型PCM,相关影像学资料见图1A~图1F。患者女,38岁,左乳侵润性导管癌通过术后病理证实,相关影像学资料见图2A~2F。
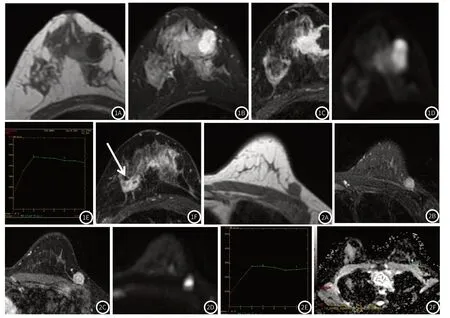
图1 右乳肿块型PCM影像学资料。注:图1A~图1B图示肿块呈T1WI低信号,T2WI高信号,可见扩张导管(箭头所示);图1C~图1E:示肿块增强后呈明显环形强化,形态不规则,边缘不规则,DWI(b值=1000s/mm2)呈明显高信号,TIC曲线呈Ⅲ型。图1F:示右乳内另见明显异常强化灶(箭头所示),提示病灶为多发。图2 左乳侵润性导管癌影像学资料。注:图2A~图2B:图示肿块呈T1WI稍低信号,T2WI稍高信号;图2C~图2F:图示肿块增强后呈明显不均强化,形态呈类圆形,边缘毛糙,DWI(b值=1000s/mm2)呈明显高信号,ADC值为0.881,TIC曲线呈Ⅱ型。
3 讨论
PCM是一种非细菌性炎性病变,目前学者认为其是乳头异常所致,乳导管开口阻塞、变形、异常等使乳导管腔变窄,导致分泌物堆积,并刺激周围正常乳腺组织引起一系列病变所致[7]。相关研究[8]显示,临床上肿块型PCM与乳腺癌的鉴别相对困难,很容易漏诊误诊。本研究结果显示,乳腺癌多发生于外上象限,且均为单发病灶,肿块型PCM多发生于乳晕周围,肿块型PCM中有6例为双乳多发结节,两者差异有统计学意义;MRI平扫乳腺癌和肿块型PCM在T1WI序列大部分呈等或稍低信号,T2WI呈稍高信号或高信号或混杂信号。
此外,本研究显示乳腺癌与肿块型PCM在病灶边缘、有无导管扩张、强化方式方面差异均有统计学意义,两者间病灶形状差异无统计学意义,其中毛刺征为乳腺癌特有征象,肿块型PCM导管扩张出现概率(83.33%)明显高于乳腺癌(25.45%)。肿块性PCM因纤维组织增生、浆细胞浸润,多表现为不规则形态,而乳腺癌因肿瘤血管增生、癌细胞浸润,从而形成毛刺,本组纳入病例中肿块型PCM未见明显毛刺征改变。PCM又称为乳腺导管扩张症,被认为是一种疾病的不同阶段,由于乳腺导管开口阻塞,可导致乳导管扩张,因此导管扩张在PCM中广泛存在[9];乳腺癌所致导管扩张为癌细胞侵润、破坏导致远端导管扩张,故肿块型PCM乳导管扩张出现概率高于乳腺癌。因此,乳导管扩张、毛刺征可作为肿块型PCM和乳腺癌的辅助鉴别方式之一。
乳腺癌和肿块型PCM均为富血供强化灶,以血管内皮生长因子为强化机制,其可毛细血管壁的通透性,促进新生微血管形成,但乳腺癌血管内皮不成熟,对比剂排泄、回收较快,其强化呈现为快进快出,而肿块型PCM血管内皮完整,对比剂回收、排泄较慢,多为逐渐强化[10]。因此乳腺癌TIC曲线多为Ⅱ型或Ⅲ型,肿块型PCM则TIC曲线多为Ⅰ型和Ⅱ型。DCE-MRI不仅可获得TIC曲线,还可进行定量参数(Ktrans、Kep、Ve)分析对比剂药代动力学特点[11]。本研究中,乳腺癌和肿块型PCM的DCE-MRI定量参数Ktrans、Kep差异均有统计学意义,两者间DCE-MRI定量参数Ve差异无统计学意义,乳腺癌组患者Ktrans、Kep值均比肿块型PCM组患者高,主要原因为Ktrans、Kep值反映血流量和血管通透性,随着乳腺癌恶性程度升高,肿块新生血管丰富,血管灌注较大,毛细血管通透性增高所致[12]。通常来说Ve与组织细胞环境的活跃程度有关,由于乳腺癌的恶性增殖对血管生长的依赖性较强,当乳腺癌恶性程度越高,则Ve越小,本研究中差异无统计学意义,分析其原因可能与乳腺癌和肿块型PCM的新生血管比例有关[13]。
目前主要采用ADC值来表示DWI上病变的扩散程度,乳腺癌癌细胞增殖旺盛导致细胞密集度增加,因此其ADC值偏低。本研究结果显示在相同b值时,乳腺癌的ADC值均低于肿块型PCM,且差异有统计学意义,乳腺癌或肿块型PCM随着b值增大,ADC值降低,但三组间比较差异无统计学意义,当b值分别取400、800、1000s/mm2时,对应AUC值分别为0.621、0.754、0.801,b值为1000s/mm2时诊断乳腺癌、肿块型PCM的准确度、敏感度、特异度最高,诊断效能最佳。在不同b值情况下,DWI对乳腺病变诊断的敏感性、特异性均存在差异;主要原因为b值较小时,受灌注影响较大,b值较大时,组织信噪比和病灶对比噪声比会减低[14]。CEA是临床使用较为广泛的一种广谱肿瘤标志物,也是一种酸性糖蛋白,但其敏感性较低;CA153是一种乳腺癌相关抗原,为早期诊断乳腺癌的标记物;由于两种肿瘤标志物在多种恶性肿瘤中均有表达,因此其敏感性和特异性一般,但是将CA153、CEA联合应用时可在一定程度上提高乳腺癌的诊断效能[15]。本研究显示乳腺癌组血清肿瘤标志物CA153、CEA表达水平均高于肿块型PCM组,差异有统计学意义。
本研究结果显示,DCE-MRI、多b值DWI、CA153、CEA对乳腺癌及肿块型PCM的鉴别诊断AUC值分别为0.752、0.746、0.603、0.612,血清肿瘤标志物CA153、CEA对两者鉴别诊断价值相对较低;而DCE-MRI、多b值DWI结合CA153、CEA对乳腺癌及肿块型PCM的鉴别诊断AUC值为0.883,准确度、敏感度、特异度分别为91.86%、96.37%、97.33%,优于单独应用DCE-MRI或多b值DWI或CA153或CEA,组间比较差异有统计学意义。
综上所述,DCE-MRI、多b值DWI、CA153、CEA均可用于对乳腺癌和肿块型PCM的鉴别诊断,但联合应用时可明显提高鉴别诊断效能,可为临床乳腺癌和肿块型PCM的诊断提供真实客观的影像学证据。
