2020—2022年玉溪市猪流行性腹泻病毒分子流行病学调查及遗传进化分析
2023-06-28朱鹤然赵国洪赵碧王帅赵津
朱鹤然,赵国洪,赵碧,王帅,4,赵津*
(1.云南省畜牧兽医科学院,云南 昆明 650224; 2.玉溪农业职业技术学院,云南 玉溪 653106;3.云南省农业科学院,云南 昆明 650205; 4.云南农业大学,云南 昆明 650201)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,PEDV)感染引起的,一种以各日龄猪的水样腹泻、呕吐、脱水、厌食、体重减轻甚至死亡为主要临床症状的高度接触性肠道传染病,该病病程短、发病迅速,对哺乳仔猪极易造成高死亡率,给养猪业造成了极大损失[1]。1977年PED最早在英国报道,之后在世界各地广泛传播[2]。经过长期的流行,PEDV进化出具有更强毒力、传染性和致病性的变异毒株。从2010年下半年开始,我国的华南地区开始出现新型高致病性PED暴发,并很快传播到全国各地[3,4]。云南省近年来PEDV流行变异程度上有增强的趋势,调查表明,2021年引起云南曲靖某猪场PED的PEDV与AJ1102和CV777 疫苗株遗传序列存在差异[5];云南分离的PEDV YNDH-2017株与近年来国内流行的PEDV毒株亲缘关系较近,而与CV777疫苗株分处在不同的两大分支上,亲缘关系较远[6];云南省2017—2022年分离的PEDV和疫苗株间存在较远的遗传和亲缘关系,流行毒株存在一定的基因多样性[7]。
PEDV属于冠状病毒科α冠状病毒属,基因组约30Kb的单股正链RNA有囊膜病毒,具有7个开放阅读框编码4种结构蛋白:M蛋白(膜蛋白)、S蛋白(刺突蛋白)、N蛋白(核衣壳蛋白)和E蛋白(包膜蛋白)。M蛋白是病毒包膜的组成成分,其编码基因全长约681bp,高度保守[4],M蛋白参与病毒颗粒的组装和释放,刺激机体产生α干扰素以及特异性保护抗体[8],M基因是PEDV分群的重要依据[9,10]。
为调查云南PEDV分子流行病学与遗传进化情况,建立RT-qPCR方法,对2020—2022年从玉溪市4个养猪场采集的临床腹泻样品进行检测,调查PEDV的流行情况。对阳性样品,进一步采用RT-PCR方法扩增样品的M基因序列,比较分析其遗传进化关系,旨在从分子水平了解玉溪市流行毒株的遗传变异规律,为玉溪市PED防控提供参考依据。
1 材料与方法
1.1 临床样品来源
2020—2022年采自玉溪市4个猪场的腹泻粪便和肠组织临床样品。
1.2 引物设计
根据GenBank收录的PEDV毒株M基因序列,对不同基因型PEDV的M基因进行多序列比对,自行设计检测PEDV的引物PEDV-M-F/PEDV-M-R和扩增M基因全长的引物PEDV-AL-M-F/PEDV-AL-M-R。引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。
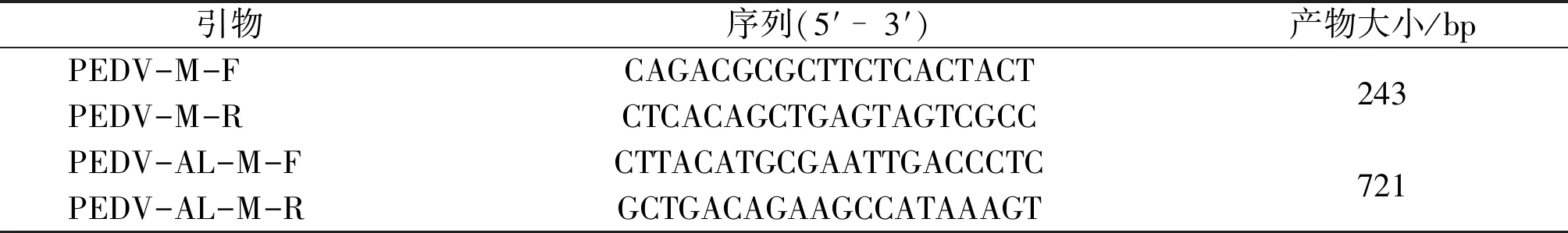
表1 PEDV RT-qPCR检测引物和M基因全长扩增引物
1.3 病毒RNA提取和cDNA合成
将33份小肠组织剪碎,取30mg样品加入500μL灭菌生理盐水,充分研磨后将混合液吸入1.5mL洁净EP管中,并加入1mL Trizol (Takara公司),充分混匀。4℃条件下8000r/min离心3min,取1mL上清提取病毒总RNA后,用50μL DEPC水溶解RNA,最后用FastKing RT Kit(With gDNase)试剂盒(TIANGEN公司)合成病毒cDNA。
1.4 PEDV qPCR检测
以上述合成的cDNA为模板,采用本实验室建立的实时荧光定量PCR方法检测PEDV,引物对为PEDV-M-F/PEDV-M-R。反应体系:qPCR Super Mix 10μL(全式金公司),cDNA 1μL,ddH2O 7μL,以及上、下游引物各1μL,PCR总体系为20μL。反应程序:95℃ 5min;95℃ 30s、60℃ 30s、72℃ 30s,40个循环;72℃ 10min。
1.5 PEDV遗传进化分析
以RT-qPCR检测为阳性的cDNA样品为模板,用引物PEDV-AL-M-F/PEDV-AL-M-R扩增PEDV M基因,反应体系为20μL,其中PCR Mix 10μL(生工生物公司),cDNA 1μL,ddH2O 7μL,上、下游引物各1μL。反应程序:95℃ 5min;95℃ 30s、60℃ 30s、72℃ 60s,40个循环;72℃ 10min。4℃保存。取20μL扩增产物进行琼脂糖凝胶电泳并拍照观察记录结果,目标条带胶回收送测序。将目标条带连接在pMD18-T载体,作为PEDV检测的阳性对照。测序结果利用DNA star软件进行分析、关键变异位点比对,利用MEGA 7.0构建遗传进化树。20株来源于GenBank的参考毒株信息见表2。

表2 PEDV参考毒株信息
2 结果与分析
2.1 PEDV RT-qPCR检测结果
对采集的33份疑似猪腹泻的样品进行RT-qPCR检测,当Ct值≤35时,扩增曲线呈典型的S型,熔解曲线为单一峰,且阳性对照和阴性对照均成立,判定为PEDV阳性。结果显示,检出PEDV阳性病料13份,PEDV阳性检出率为39.39%(13/33),检测结果见图1。
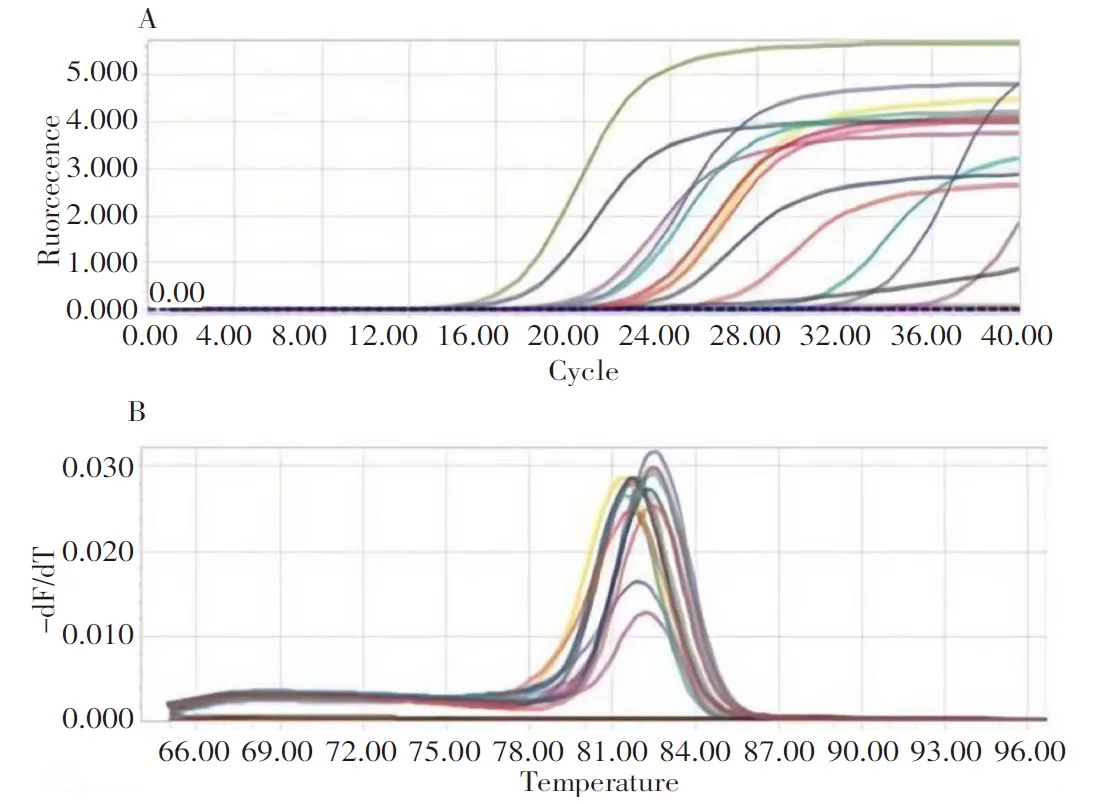
A:样品扩增曲线;B:熔解曲线。
2.2 PEDV M基因扩增
以RT-qPCR方法检测结果为阳性的PEDV 样品cDNA为模板进行PCR扩增全长M基因,获得721bp与预计目标片段大小一致的条带(图2),检出的13份PEDV阳性病料的M基因序列结果一致,将其命名为PEDV/YX-2021。
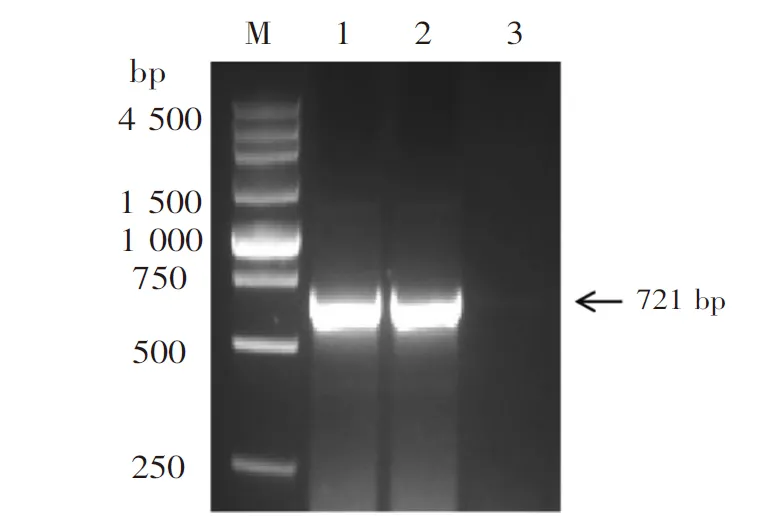
M:250 bp DNA Ladder;1:PEDV样本PCR产物;2:阳性对照;3:阴性对照。
2.3 PEDV M基因遗传进化分析
基于PEDV/YX-2021 M基因构建遗传进化树,分析表明,PEDV/YX-2021与国内流行的变异株AH2012、AJ1102和LW/L疫苗株、美国分离的高致病性毒株USA/Colorado/2013等亲缘关系较近,处于同一进化分支上,而与大部分属于G1型的代表性毒株如CV777、SD-M、Attenuated DR13亲缘关系较远(图3)。表明PEDV/YX-2021属于G2型流行变异株,与PEDV 疫苗毒株CV777等早期毒株进化关系较远,与近年PEDV流行株遗传进化关系较近。

图3 基于PEDV M基因构建的遗传进化树
2.4 PEDV M基因氨基酸同源性分析
比较PEDV/YX-2021株与其他不同地区、不同基因型的参考毒株氨基酸序列,结果表明,PEDV/YX-2021与参考毒株同源性为96.48%~99.56%,其中G1基因型来源的经典株CV777氨基酸同源性为98.24%,与LZC序列同源性最低为96.48%;与G2型来源的AH2012、JS-HZ2012、E16-39、PEDV-FJ-Fuzhou、USA/Colorado/2013的同源性最高为99.56%。PEDV/YX-2021与经典株CV777相比,氨基酸有4个变异位点(13:E→Q;42:V→A;129:V→I;214:A→S)。其中第129位氨基酸变异位点(V→I)为PEDV/YX-2021株所特有;第13(E→Q)、42(V→A)氨基酸变异位点主要存在于变异株与PEDV/YX-2021株;第214位氨基酸变异位点(A→S)主要存在于经典株、变异株与PEDV/YX-2021株。这些氨基酸变异位点为后期研究PEDV/YX-2021株的致病性提供了关键信息。见表3。

表3 PEDV/YX-2021与参考毒株M蛋白氨基酸变异位点分析
3 讨论
PEDV是目前危害我国养猪业最主要的病原之一,几乎在所有省份都有流行[11]。杨启尧等人对2019—2021年云南省的猪血清进行PED的抗体检测,云南省文山、红河、玉溪、昆明、曲靖、大理、丽江、西双版纳8个州(市)PEDV 3年平均感染率为28.46%,2021年感染率最高为37.43%。其中,玉溪市PEDV 3年平均感染率为19.76%,2019年PEDV感染率为11.54%,2020年PEDV感染率为20.54%,2021年PEDV感染率为29.31%,玉溪市PEDV感染率呈现逐年上升的趋势[12]。本研究调查了2020—2022年玉溪市PEDV流行情况,PEDV阳性检出率为39.39%,说明目前玉溪市PEDV流行程度高,应引起高度重视。
玉溪市PEDV/YX-2021 属于G2型流行变异株,与G1型经典株CV777相比,存在4个氨基酸变异位点(13:E→Q;42:V→A;129:V→I;214:A→S);其中第13(E→Q)、42(V→A)氨基酸变异主要存在于PEDV/YX-2021株与G2型流行株,其中,第13位变异属于酸性氨基酸变为中性氨基酸;第214氨基酸变异(A→S)主要存在于2010年以后出现的流行株,属于疏水性氨基酸变为亲水性氨基酸。这些氨基酸位点变异改变了氨基酸的亲疏水性和带电情况,提示PEDV G1基因型与G2基因型的M基因之间存在不一致的氨基酸位点且可能存在基因型内部一致性的突变规律,为后期研究PEDV/YX-2021株的致病性提供了关键信息,但具体生物学意义还有待进一步研究。
PEDV属于RNA病毒,其分子演化与变异的概率高,导致近年来PEDV变异毒株不断出现[13]。云南省2017—2022年PEDV的流行病学调查发现曲靖、宣威、蒙自等地区同时流行G1基因型和G2基因型两种基因型毒株,但以G2b为优势流行基因亚型[7]。本文在玉溪市没有检测到G1基因型PEDV,可能与收集的样品时间段和样品数量少有关。PEDV G2型是玉溪市的优势流行株,明显与PEDV 疫苗毒株CV777等早期毒株存在特征性的氨基酸变异,可能存在抗原性差异。因此,防控PED,需要关注当前PEDV G2型流行株的流行上升趋势,在做好猪场饲养管理和生物安全的同时,筛选配型和免疫原性好的G2型毒株疫苗进行PED免疫防控。
