柠檬酸盐对缺氧/复氧诱导的心肌细胞损伤及LKB1/AMPK信号通路的影响
2023-06-27周学才朱冬梅
张 博,周学才,朱冬梅,万 翔
心肌损伤(myocardial injury,MI)普遍认可的定义为超声心动图和心电图出现异常或者心肌肌钙蛋白过高[1]。高血脂、高血压可以导致心肌缺血引发心肌梗死,通过介入手术或者药物溶栓可以实现缺血再灌注(ischemia/reperfusion,I/R),但此时可以引发心肌损伤[2],其对病人生命健康有巨大威胁,且是病人死亡的独立因子[3]。探寻可以保护心肌细胞的药物具有重大意义。线粒体中谷氨酰胺代谢通路可以合成柠檬酸盐,其可以通过螯合血液内钙离子实现抗凝血的作用,同时可以抑制炎性因子[4],降低肾I/R损伤指标水平,明显提高肾I/R及炎性细胞因子从而影响的细胞活力[5]。5′-单磷酸腺苷激活的蛋白激酶(5′-AMP-activated protein kinase,AMPK)是一种代谢的中心调控因子,在细胞自噬与细胞极化过程中发挥重要调控作用,三磷酸腺苷(ATP)产生减少时,AMPK被磷酸化而激活[6],激活AMPK信号通路可以降低线粒体超氧化物的含量,调节心肌收缩能力,降低I/R引起的心肌梗死[7],肝激酶B1(liver kinase B1,LKB1)不仅是丝氨酸/苏氨酸激酶,也是代谢调控因子,具有调控炎症的作用[8]。激活LKB1/AMPK信号通路恢复肠道自噬,可改善肠道I/R损伤[9]。因此,本研究观察不同浓度柠檬酸盐对缺氧/复氧(hypoxia/reoxygenation,H/R)诱导的人心肌细胞损伤及LKB1/AMPK信号通路的影响,探究保护心肌细胞的分子机制,为防止心肌细胞损伤提供理论基础。
1 材料与方法
1.1 细胞 人心肌细胞(HCM),货号:CP-H076,购于武汉普诺赛生命科技有限公司。
1.2 主要试剂及仪器 青霉素钠(Penicillin G Sodium)、AMPK抑制剂(Doxorubicin HCI,货号:S416001、S1208)购于上海蓝木化工有限公司;链霉素(货号:A103-01)购于翌圣生物科技(上海)股份有限公司;DMEM basic(1X)高糖培养液(货号:C11995500BT)购于广州赛国生物科技有限公司;RPMI 1640 培养基(货号:12633012)购于赛默飞世尔科技(中国)有限公司;胰蛋白酶-乙二胺四乙酸二钠(EDTA)消化液、总RNA提取试剂盒、通用逆转录聚合酶链式反应(RT-PCR)试剂盒(M-MLV,货号:T1300、R1200、RP1100)购于北京索莱宝科技有限公司;Korser柠檬酸盐(货号:GR1962)购于上海广锐生物科技有限公司;细胞增殖毒性检测(CCK-8)试剂盒(货号:GK10001)购于上海宏叶生物科技有限公司;膜联蛋白V-FITC(Annexin V-FITC)细胞凋亡检测试剂盒(货号:C1062S)购于上海碧云天生物技术有限公司;LKB1、AMPK、磷酸化LKB1(p-LKB1)、磷酸化AMPK(p-AMPK)、Bcl-2、Bax、羊抗兔IgG、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(货号:ab138386、ab32047、ab63473、ab92701、ab321124、ab32503、ab150077、ab8245)购于美国Abcam公司。
细胞培养箱(型号:LW-80A-Ⅲ)购于上海利闻科学仪器有限公司;倒置显微镜(型号:CM2000S)购于睿鸿光电科技(福建)有限公司;全功能定量PCR仪(型号:QuantStudio12Flex)购于上海土森视觉科技有限公司;细胞计数器(型号:ADAM-MC2)购于艾万拓威达优尔国际贸易(上海)有限公司;酶标仪(型号:SAF-680T)购于上海巴玖实业有限公司;流式细胞仪(型号:130-109-803)购于德国美天旎生物技术有限公司。
1.3 方法
1.3.1 HCM培养及H/R损伤细胞模型制备 取HCM细胞株,培养于含有10×105U/L青霉素钠、100 mg/L链霉素、10%胎牛血清的RPMI 1640 培养基中,培养条件设置为:95%空气,5%CO2,37 ℃,每2 d更换1次培养液,HCM细胞呈同步搏动时,用于后续实验。缺氧处理过程:HCM细胞使用无糖DMEM洗涤3次,使用无糖DMEM培养基进行培养,培养条件设置为:95%N2,5%CO2,37 ℃,培养2.5 h;复氧处理过程:将缺氧处理过的HCM细胞使用含糖的DMEM培养基进行培养,培养条件设置为:95%空气,5%CO2,37 ℃,培养2 h后进行后续各项实验。
1.3.2 HCM细胞分组及柠檬酸盐处理 取对数生长期HCM细胞,使用0.25%的胰蛋白酶进行消化,重悬HCM细胞并随机分为对照组(常规培养)、H/R组、柠檬酸盐低剂量组(20 μmol/mL柠檬酸盐培养液)、柠檬酸盐中剂量组(40 μmol/mL柠檬酸盐培养液)、柠檬酸盐高剂量组(80 μmol/mL柠檬酸盐培养液)、柠檬酸盐高剂量+抑制剂组(3 mg/kg LKB1/AMPK通路抑制剂Doxorubicin HCI、80 μmol/mL柠檬酸盐培养液)[10],柠檬酸盐低、中、高剂量组及通路抑制剂组在建模后30 min进行给药处理。
1.3.3 CCK-8法检测HCM细胞增殖能力 取经H/R处理的HCM细胞,将重悬后的HCM细胞浓度调整为6×105个/mL的细胞悬浮液,以每孔0.5 mL接种于24孔培养板,每组3个复孔,每孔加入10 μL浓度为10%的CCK-8溶液,细胞培养箱中继续培养2 h后收集HCM细胞,通过酶标仪检测570 nm处的吸光值(OA),细胞增殖抑制率(%)=(药物组OA值/正常组OA值)×100%。
1.3.4 生化法检测HCM细胞培养液中心肌损伤生化标志物水平 取HCM细胞培养液,3 500 r/min离心10 min,去上清液,完全按照试剂盒说明书进行实验操作,利用生化分析仪检测培养基中肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)的水平。
1.3.5 流式细胞仪检测HCM细胞凋亡水平 取H/R处理的HCM细胞,完全按照Annexin V-FITC/碘化丙啶(PI)细胞凋亡双染试剂盒说明书进行测定,用胰蛋白酶消化各组HCM细胞,将重悬后的HCM细胞密度调整为1×106个/mL,加入70%乙醇溶液在4 ℃环境中固定过夜,用磷酸缓冲盐溶液(PBS)清洗后离心去除上清液,将细胞重悬后加入5 μL Annexin V-FITC(标记细胞)、2 μL RNA酶(去除内源性RNA)、2 μL PI溶液,室温下孵育35 min后使用细胞流式仪检测HCM细胞凋亡情况。每组实验重复3次。
1.3.6 蛋白免疫印迹法(Western Bloting)检测HCM细胞凋亡、LKB1/AMPK通路相关蛋白表达水平 取H/R处理的HCM细胞,采用Western Bloting法检测各组HCM细胞凋亡相关因子(Bax、Bcl-2)、LKB1/AMPK通路相关蛋白的表达。获取各组HCM细胞,重悬HCM细胞并将浓度调整为2×106个/mL接种于24孔培养板中,低温下加入RIPA蛋白裂解液裂解30 min,4 ℃、12 000 r/min离心30 min,取上清至无菌离心管中,按照二喹啉甲酸(BCA)蛋白试剂盒的说明书进行操作,测定其中蛋白质含量,取40 μg蛋白使用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,转移至聚偏二氟乙烯(PVDF)膜上,加入脱脂奶粉溶液封闭1 h,4 ℃下添加Bcl-2(1∶500)、Bax(1∶500)、LKB1、p-LKB1、AMPK、p-AMPK兔源一抗与GAPDH(1∶500)4 ℃孵育过夜,用TBST洗涤后添加羊抗兔IgG(1∶1 000)室温下孵育4 h。采用蛋白成像凝胶仪对凋亡相关蛋白(Bax、Bcl-2)、LKB1/AMPK通路相关蛋白水平进行半定量分析。每组实验重复3次。

2 结 果
2.1 各组HCM细胞增殖能力比较 与对照组相比,H/R组HCM细胞增殖抑制率明显升高(P<0.05);与H/R组相比,柠檬酸盐低、中、高剂量组HCM细胞增殖抑制率明显降低(P<0.05),且随着柠檬酸盐剂量的升高,HCM细胞增殖抑制率降低;与柠檬酸盐高剂量组相比,柠檬酸盐高剂量+抑制剂组HCM细胞增殖抑制率明显升高(P<0.05)。详见表1。

表1 各组HCM细胞增殖能力比较(±s) 单位:%
2.2 各组HCM细胞培养液中心肌损伤生化标志物水平比较 与对照组相比,H/R组HCM细胞培养液中心肌损伤生化标志物CK-MB、LDH水平明显升高(P<0.05);与H/R组相比,柠檬酸盐低、中、高剂量组HCM细胞培养液中心肌损伤生化标志物CK-MB、LDH水平明显降低(P<0.05),且随着柠檬酸盐浓度的升高,HCM细胞培养液中心肌损伤生化标志物CK-MB、LDH水平随之降低;与柠檬酸盐高剂量组相比,柠檬酸盐高剂量+抑制剂组HCM细胞培养液中心肌损伤生化标志物CK-MB、LDH水平明显升高(P<0.05)。详见表2。

表2 各组HCM细胞培养液中心肌损伤生化标志物水平比较(±s)
2.3 各组HCM细胞凋亡率比较 与对照组相比,H/R组HCM细胞凋亡率明显升高(P<0.05);与H/R组相比,柠檬酸盐低、中、高剂量组HCM细胞凋亡率明显降低(P<0.05),且随着柠檬酸盐浓度的升高,HCM细胞凋亡率随之降低;与柠檬酸盐高剂量组相比,柠檬酸盐高剂量+抑制剂组HCM细胞凋亡率明显升高(P<0.05)。详见表3、图1。
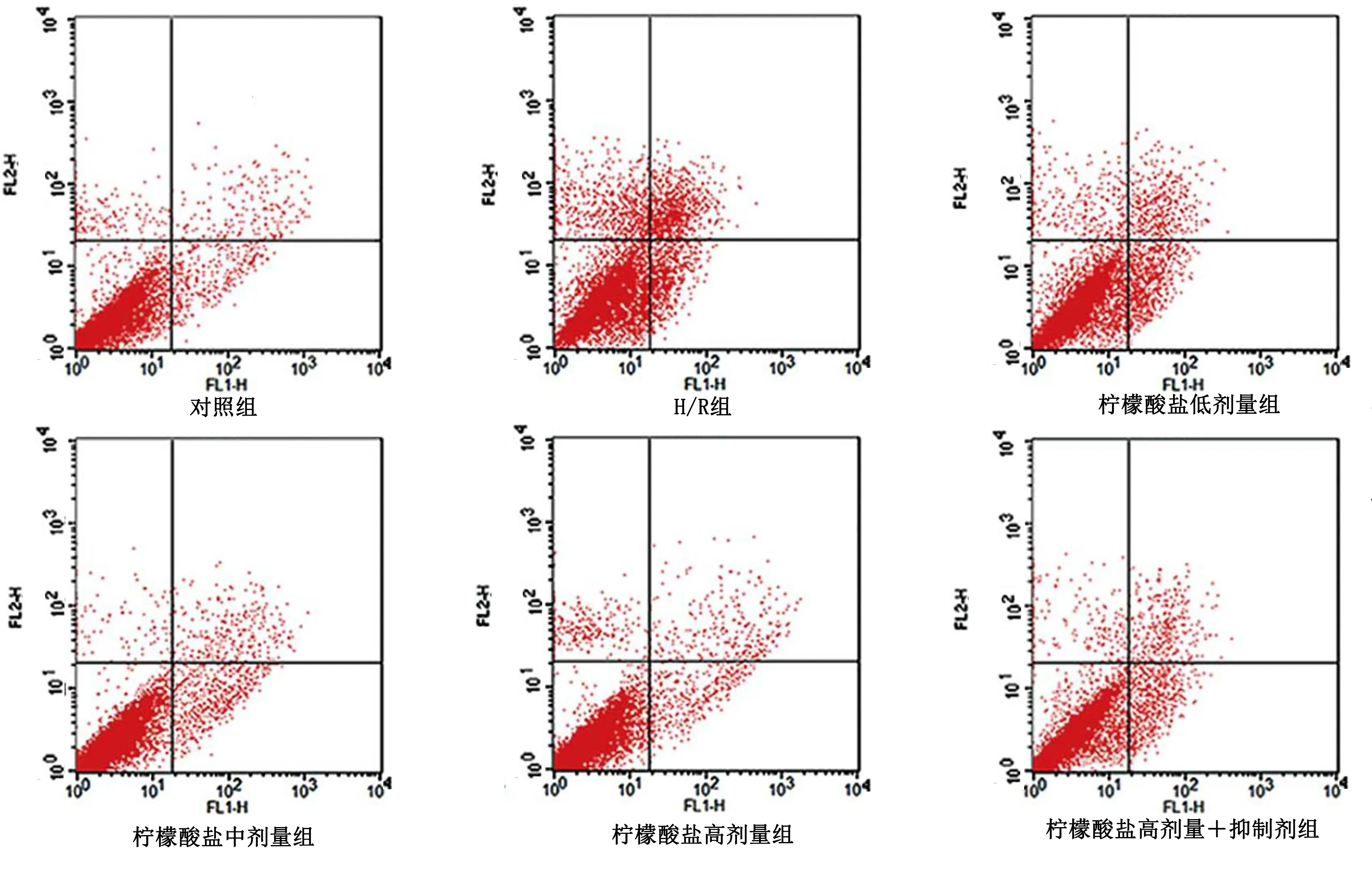
图1 各组HCM细胞凋亡流式图

表3 各组HCM细胞凋亡率比较(±s) 单位:%
2.4 各组HCM细胞凋亡相关蛋白水平比较 与对照组相比,H/R组HCM细胞中Bax蛋白表达水平明显升高(P<0.05),Bcl-2蛋白表达水平明显降低(P<0.05);与H/R组相比,柠檬酸盐低、中、高剂量组HCM细胞中Bax蛋白表达水平明显降低(P<0.05),且随着柠檬酸盐浓度的升高HCM细胞中Bax蛋白表达水平降低,Bcl-2蛋白表达水平明显升高(P<0.05),且随着柠檬酸盐浓度的升高HCM细胞中Bcl-2蛋白表达水平升高;与柠檬酸盐高剂量组相比,柠檬酸盐高剂量+抑制剂组HCM细胞中Bax蛋白表达水平明显升高(P<0.05),Bcl-2蛋白表达水平明显降低(P<0.05)。详见表4、图2。
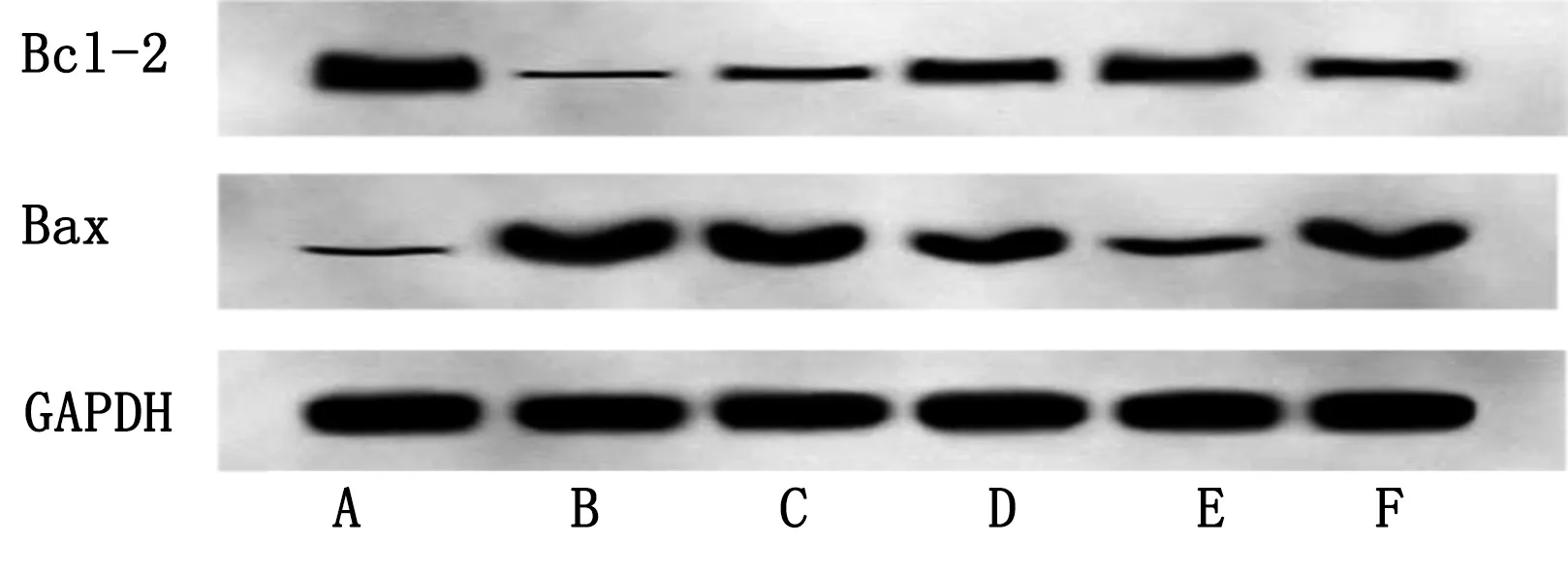
图2 各组HCM细胞凋亡相关蛋白表达条带图

表4 各组HCM细胞凋亡相关蛋白水平比较(±s)
2.5 各组HCM细胞中LKB1/AMPK通路相关蛋白表达水平比较 与对照组相比,H/R组HCM细胞中p-LKB1、p-AMPK蛋白表达水平明显降低(P<0.05);与H/R组相比,柠檬酸盐低、中、高剂量组HCM细胞中p-LKB1、p-AMPK蛋白表达水平明显升高(P<0.05),且随着柠檬酸盐浓度的升高HCM细胞中p-LKB1、p-AMPK蛋白表达水平升高;与柠檬酸盐高剂量组相比,柠檬酸盐高剂量+抑制剂组HCM细胞中p-LKB1、p-AMPK蛋白表达水平明显降低(P<0.05)。详见表5、图3。
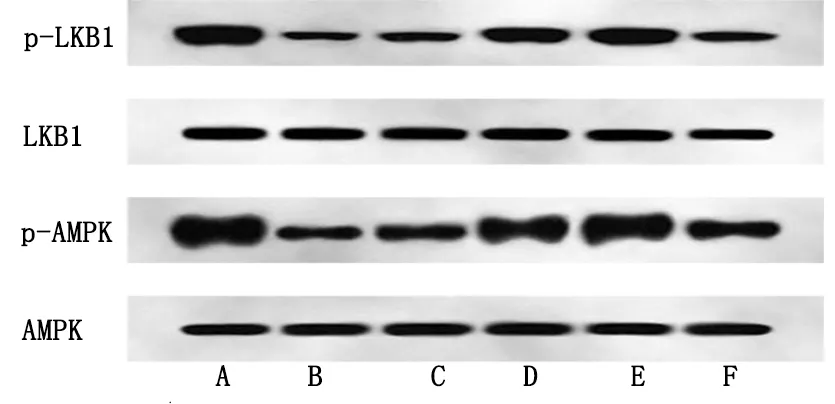
图3 LKB1/AMPK通路相关蛋白表达条带图

表5 各组HCM细胞中LKB1/AMPK通路相关蛋白表达水平比较(±s)
3 讨 论
心肌损伤是由于心脏I/R造成,长期I/R损伤可能引发DNA损伤、细胞功能障碍和细胞死亡,可导致急性冠脉综合征和心肌梗死[11],严重威胁病人的生命健康。柠檬酸盐是一种重要代谢产物,不仅可以作为胆固醇与细胞质合成脂肪酸的碳源,还可以促进线粒体能量代谢,使用其预处理可以有效降低心肌细胞凋亡[12]。柠檬酸盐具有抑制新鲜血液凝固的作用,在临床采血中被用作抗凝血剂,并有报道指出其可以起保护心肌的作用,有效抑制心肌细胞凋亡[13]。心肌细胞受到损伤时生化标志物CK-MB、LDH就会由心肌细胞产生并分泌到心肌细胞外[14],因此,CK-MB、LDH的含量可以很好地反映心肌损伤的受损程度,CK-MB、LDH释放量减少时则心肌细胞损伤程度明显降低[15]。因此,本实验以人心肌细胞HCM为研究对象,利用H/R诱发心肌损伤,探究柠檬酸盐对心肌细胞损伤及LKB1/AMPK信号通路的影响。本研究使用N2环境处理HCM细胞2.5 h,之后恢复O2环境继续培养2 h制作H/R模型即H/R组,结果发现,与正常培养的HCM细胞相比,H/R组HCM细胞增殖抑制率、凋亡率及CK-MB、LDH蛋白表达水平明显升高,表明H/R模型制作符合实验要求。Bax与Bcl-2在细胞凋亡过程中特异性表达,其表达水平可以反映细胞凋亡程度[16]。与H/R组相比,柠檬酸盐低、中、高剂量组HCM细胞增殖抑制率、凋亡率及CK-MB、LDH、Bax蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高,表明柠檬酸盐可以保护心肌损伤,并且随着柠檬酸盐剂量的升高,其保护作用越强。
LKB1/AMPK信号通路的激活可以增强细胞增殖能力[17]。LKB1是AMPK的上游激酶,可以激活AMPK[18]。激活的AMPK是关键的能量传感器,维持细胞能量稳态,可能是通过调节脂质和葡萄糖代谢发挥作用的[19],激活LKB1/AMPK信号通路可以通过影响能量代谢调控细胞的增殖和凋亡[20],同时,有研究报道,加强激活LKB1/AMPK信号通路可以明显改善坏死与凋亡,保护受损的心肌细胞[21]。本实验发现,与H/R组相比,柠檬酸盐高剂量组HCM细胞中p-LKB1、p-AMPK蛋白表达水平明显升高,表明柠檬酸盐可促进HCM细胞增殖,抑制其凋亡,保护受损的HCM细胞,可能与激活LKB1/AMPK信号通路有关;与柠檬酸盐高剂量组相比,柠檬酸盐高剂量+抑制剂组HCM细胞中p-LKB1、p-AMPK蛋白表达水平明显降低,进一步证明柠檬酸盐促进受损的HCM细胞生存是通过激活LKB1/AMPK信号通路实现的。
综上所述,柠檬酸盐可以促进受损的HCM细胞生存,可能与激活LKB1/AMPK信号通路有关,但影响受损的HCM细胞生存因素较多,细胞内信号通路具有多种功能,因此,避免心肌细胞H/R损伤仍需深入研究。
:
