菜心不同器官糖含量比较及代谢相关基因的表达分析
2023-06-27冯献君王丽王彤侯雷平李梅兰
冯献君,王丽,王彤,侯雷平,李梅兰
菜心不同器官糖含量比较及代谢相关基因的表达分析
冯献君1,王丽2,王彤1,侯雷平,李梅兰
1山西农业大学园艺学院,山西太谷 030801;2左权县农业农村局现代农业产业发展服务中心,山西左权 032600
【目的】菜心口感脆嫩,营养价值高,是华南地区人们最喜爱的蔬菜之一,其中糖的种类和含量是决定菜心甜度和风味的主要因素。分析菜心不同器官糖含量及与糖代谢和转运相关基因的表达,以探明导致菜心不同器官糖含量差异的分子机制。【方法】采用高效液相色谱法测定菜心叶片、薹茎和花蕾中可溶性糖、蔗糖、葡萄糖和果糖的含量;通过转录组测序技术对菜心叶片、薹茎和花蕾基因的表达量进行全面系统的分析,并利用DESeq2软件鉴定3个不同器官间的差异表达基因,分析糖代谢通路及转运过程涉及的酶编码基因的表达,在基迪奥生信云平台将筛选到的与糖代谢转运相关的差异表达基因和糖含量进行相关性分析,同时利用实时荧光定量PCR(qRT-PCR)技术对部分基因的表达量进行验证。【结果】糖含量测定结果表明,菜心不同器官之间糖含量差异明显。可溶性糖、蔗糖、葡萄糖和果糖含量均呈现花蕾>薹茎>叶片的趋势。花蕾中葡萄糖含量分别为薹茎和叶片的1.3倍和1.6倍,果糖含量分别为薹茎和叶片的1.42倍和1.78倍。通过分析糖代谢关键酶和转运蛋白编码基因与糖含量变化趋势的一致性,共找出18个与糖含量变化趋势一致的基因。通过分析糖代谢转运中相关差异基因的表达与糖种类及含量的相关性和一致性,鉴定了14个与糖含量变化趋势一致的DEG。合并7个共有基因(、、、、、和),共计25个基因与糖含量变化趋势一致。qRT-PCR结果分析表明筛选到的8个差异基因的表达量FPKM值与相对表达水平高度一致,说明测序结果准确可靠。【结论】菜心花蕾中的糖含量高于薹茎和叶片,是由合成相关酶编码基因的表达在薹茎和花蕾中高于叶片所致,研究结果为揭示菜心不同器官中糖代谢及转运的分子机制奠定了一定基础。
菜心;器官;糖类;转录组;基因
0 引言
【研究意义】菜心(L. ssp.var.Tsen et Lee)又名菜薹,是十字花科芸薹属白菜亚种的一个变种。菜心以花薹为主要食用器官,生长周期短,可周年供应,是华南地区人们餐桌上的必备佳肴。因其品质柔嫩,具有十字花科植物特有的风味和口感,有着“蔬品之冠”和“菜中之后”的美誉。它富含糖类、维生素C以及人体所需蛋白质等营养物质,因此深受消费者喜爱[1-2]。糖的含量影响蔬菜的风味和营养品质[3],分析植物体内糖的含量是研究糖代谢的基础[4]。因此,研究菜心器官中主要糖含量和糖代谢机制具有重要的意义。【前人研究进展】植物各器官糖积累和转运过程中需要糖代谢和转运相关酶的共同参与,但是糖代谢和转化酶的编码基因在同一植物不同器官中的表达不一致。张晓艳等[5]研究了不同熟性菜心品种的糖代谢规律,发现晚熟品种中可溶性糖、果糖和还原糖含量在花芽分化中期至现蕾期和采收期快速升高。张梦[6]发现在百合现蕾期光合作用增强,叶片中积累的果糖和葡萄糖等向花蕾中积累,最后在花瓣盛开过程中糖含量(葡萄糖、果糖和蔗糖)大量积累。马春梅等[7]研究发现不同大豆品种叶片在生长过程中可溶性糖含量呈现单峰曲线变化,峰值出现在开花期。甜瓜中在叶片、茎和果实中表达,在花和根中不表达,而甜瓜在未成熟时蔗糖含量较低,随着果实发育,的表达量迅速提高,表明蔗糖积累可能与表达量关系密切[8]。在棉花过表达株系的幼叶中,果糖含量也明显上升,能促进纤维的伸长,在伸长纤维的植株中,高活性的能促进果糖和葡萄糖含量的提高[9],叶片中葡萄糖和果糖等己糖的渗透力小,高活性的可能通过糖信号来促进叶片的发育。辣椒在花发育中表达量高,在叶片中表达较高,这些基因与糖代谢和转化密切相关,促进了辣椒叶片和花的发育[10]。【本研究切入点】以果实为产品器官的植物中糖含量及代谢转运相关酶的研究较为深入,但关于菜心糖含量及代谢转运酶的研究较少,糖代谢转运分子机制仍未明确。【拟解决的关键问题】本试验对菜心3个不同器官的糖(蔗糖、果糖和葡萄糖)含量进行测定,并结合转录组测序结果对菜心糖代谢转运过程中的相关酶编码基因的变化进行分析,揭示菜心不同器官糖代谢转运的分子机理,为利用分子育种改良菜心品种,提高菜心品质提供理论依据。
1 材料与方法
1.1 植物材料及栽培
试验采用晚熟菜心品种‘油绿802’为研究材料(该品种是笔者课题组前期筛选出的生理指标和营养指标均表现较好的品种)[11],种子购买于广州市农业科学研究院。种子于2019年9月15日条播于山西农业大学园艺站富含有机质土壤的塑料大棚中,期间间苗,株距12 cm×行距12 cm,并进行常规管理。
1.2 取样
当菜心长至“齐口花”时期(主薹长度与叶片先端高度持平,有初花,达到采收标准),随机挑选10株长势相同的植株,取新鲜叶片、薹茎和花蕾各4 g样品在液氮中速冻,-80 ℃保存,2 g用于转录组测序,剩余2 g用于糖含量测定,3次重复。
1.3 糖含量测定
1.3.1 葡萄糖和果糖的含量测定 不同器官葡萄糖和果糖的含量采用高效液相色谱法进行测定,由上海优选生物科技有限公司完成。
检测器选用RID,色谱柱为HILIC-NH2:250 mm×4.6 mm,0.5 μm;流动相由超纯水和乙腈(Tedia,United States)组成,乙腈﹕水=80﹕20(V﹕V);流速为1 mL∙min-1,进样量为20 µL,柱温为30 ℃。
1.3.2 可溶性糖和蔗糖含量的测定 可溶性糖的含量测定采用蒽酮比色法[12]进行;
蔗糖含量的测定参照张志良等[13]的盐酸-间苯二酚法,并稍作修改。取新鲜菜心叶片、薹茎和花蕾各2 g,于-80 ℃液氮中速冻,称取0.2 g样品于2 mL蒸馏水中磨样,倒入10 mL刻度离心管内,95 ℃加热10 min,10 000×离心10 min,吸取上清液100 µL,加入20 µL NaOH,沸水浴10 min,加入280 µL 30% HCl和0.1%的间苯二酚溶液80 µL,沸水浴30 min。冷却后480 nm测定OD值,每个处理3次重复。
标准曲线制作:分别取0、20、40、60、80和100 µg∙mL-1的标准溶液各100 µL,方法同上。最后绘制蔗糖浓度-OD值曲线。
1.4 转录组测序
转录组测序委托武汉迈特维尔生物科技有限公司进行。提取的RNA通过质量评估后,每个样本约3 μg RNA构建cDNA文库。总RNA的提取采用RNeasy Plant Mini Kit试剂盒(QIAGEN,74903),参照说明进行。使用带有Oligo(dT)磁珠富集总RNA中的mRNA,加入fragmentation buffer将RNA打断成短片段,用六碱基随机引物合成第一链cDNA,加入缓冲液、dNTPs和DNA polymerase I合成双链cDNA,利用AMPure XP beads纯化双链cDNA,然后进行末端修复和测序接头连接。使用AMPure XP beads进行片段大小的选择,通过PCR扩增构建cDNA文库。最后用Illumina Miseq平台对测序文库进行测序。
测序后对每个样品进行原始读取,去除引物和带接头reads。过滤掉低质量reads,clean reads包含超过80%的碱基对和Q值≥30。clean reads以Brassica Database v1.5(http://brassicadb.org/brad/)为参考基因组,与TopHat软件进行比对,并组装成contigs。通过双末端连接和间隙填充,contigs被组装和聚类以获得唯一的reads。通过比较已鉴定基因的数量与总reads来评估每个文库的reads饱和度。
1.5 基因表达及差异基因的功能注释分析
采用FPKM作为衡量转录本或基因表达水平的指标。利用DESeq2软件鉴定不同器官间的差异表达基因(DEG)。使用FC≥2和FDR<0.01作为DEG的显著性阈值,3个不同部位进行两两比较,将所有差异表达基因通过GO和KEGG数据库进行分类富集分析。
1.6 实时荧光定量PCR
随机选取8个基因进行菜心不同器官的qRT-PCR验证。利用在线工具Primer 3设计8个基因的特异性引物,序列见表1,用大白菜作参照,与目标基因一起扩增。RNA提取后,采用PrimeScriptTMRT Reagent Kit(TaKaRa, RR037A)试剂盒反转录合成cDNA,再采用TB Green® Premix Ex TaqTMII(TaKaRa, RR820A)试剂盒进行qRT-PCR,20 μL反应体系的反应条件为94 ℃5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。PCR反应在ABI 7500 real-time PCR仪上操作,每个反应设置3个技术重复,相对表达水平使用2-ΔΔCT方法计算[14]。
2 结果
2.1 菜心不同器官糖含量比较
葡萄糖和果糖含量均在花蕾中最高,且显著高于薹茎和叶片;葡萄糖含量分别为薹茎和叶片的1.30倍和1.60倍,果糖含量分别为薹茎和叶片的1.42倍和1.78倍;可溶性糖和蔗糖含量同样在花蕾中显著高于薹茎和叶片。因此,这些糖类均在花蕾中含量最高,其次为薹茎,叶片中含量最少(图1)。

表1 实时荧光定量引物
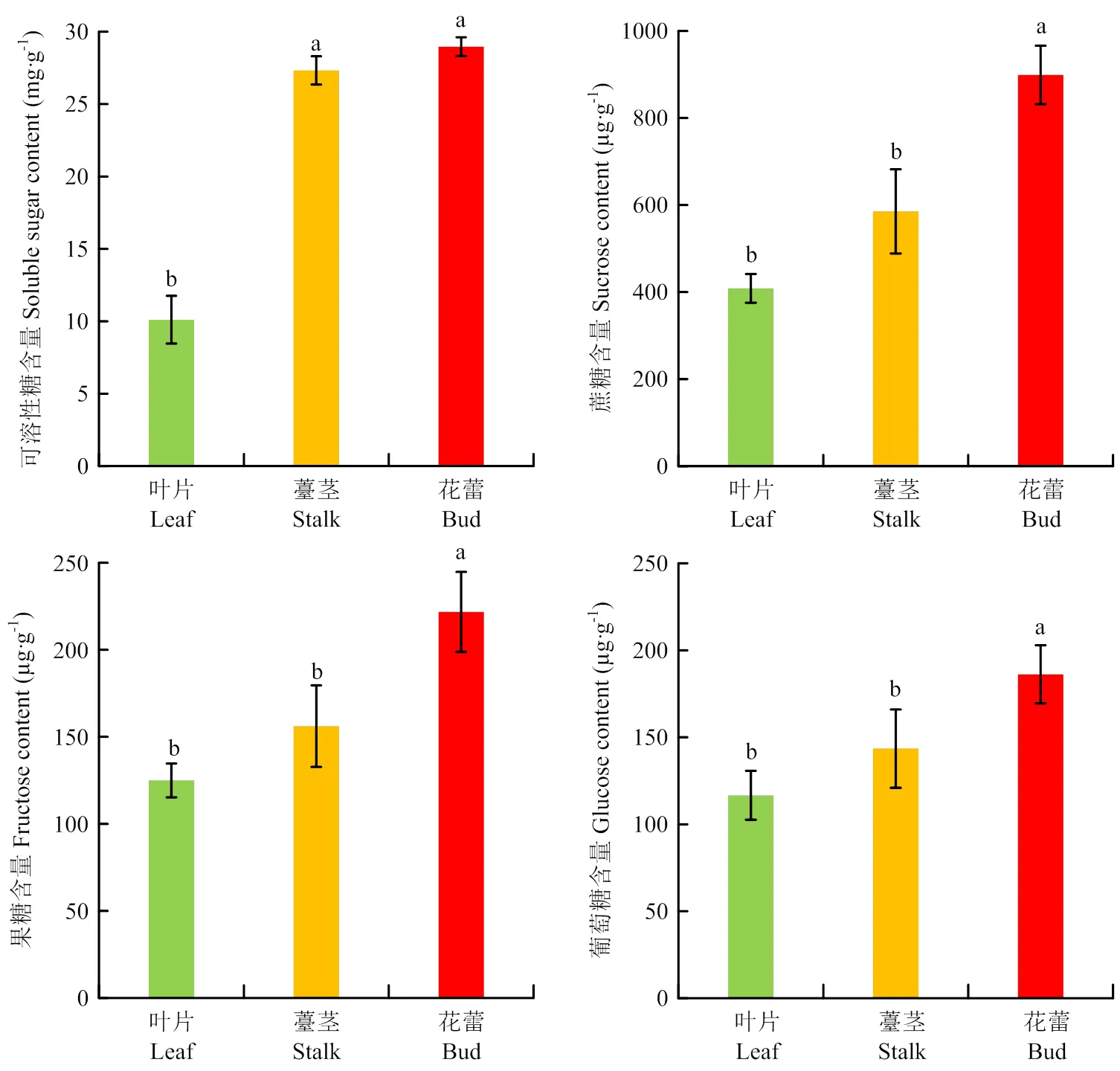
不同小写字母表示差异显著(P<0.05) Different lowercase letters indicate significant difference (P<0.05)
2.2 转录组分析
2.2.1 菜心不同器官测序数据统计及评估 从菜心3个不同器官(叶片、薹茎和花蕾)的3个生物重复样品中提取总RNA,生成cDNA文库,采用高通量测序技术对文库进行配对端部测序,各文库高通量测序数据如表2所示。为保证数据的质量及后续分析的准确性,过滤掉低质量及带接头的reads,共获得30.3 Gb clean data。将各文库获得的高质量reads与大白菜参考基因组v1.5版本数据库(http://brassicadb.cn/)进行比对,比对率均高于88%,唯一比对到参考基因组的reads数均在85%—87%,表明比对效率较高,测序结果和所选参考基因组较可靠,可用于后续分析。
2.2.2 样本主成分分析 对菜心3个不同器官共9个样品进行主成分分析,如图2所示。图中可看出第一、第二主成分的贡献率分别为48.28%和24.70%。图中相同颜色的每组样本均聚集在一起,而不同颜色的各个组均处于分散状态,3组样本数据被明显区分开,表明组内差异较小,重复性较好,而组间差异显著,叶片、薹茎和花蕾均呈现显著差异,可进行后续基因的挖掘。

表2 各样品测序数据评估及结果统计

A1/2/3:叶片1/2/3;B1/2/3:薹茎1/2/3;C1/2/3:花蕾1/2/3 A1/2/3: Leaf 1/2/3; B1/2/3: Stalk 1/2/3; C1/2/3: Bud 1/2/3
2.2.3 RT-qPCR验证 随机选取菜心3个不同器官的8个差异表达基因(、、、、、、和)进行实时荧光定量PCR验证,以为内参基因对菜心3个不同器官的差异表达基因进行定量分析,验证转录组测序数据的可靠性。从图3可以看出这些基因的表达量FPKM值与相对表达水平高度一致,表明转录组测序质量好,数据可靠。
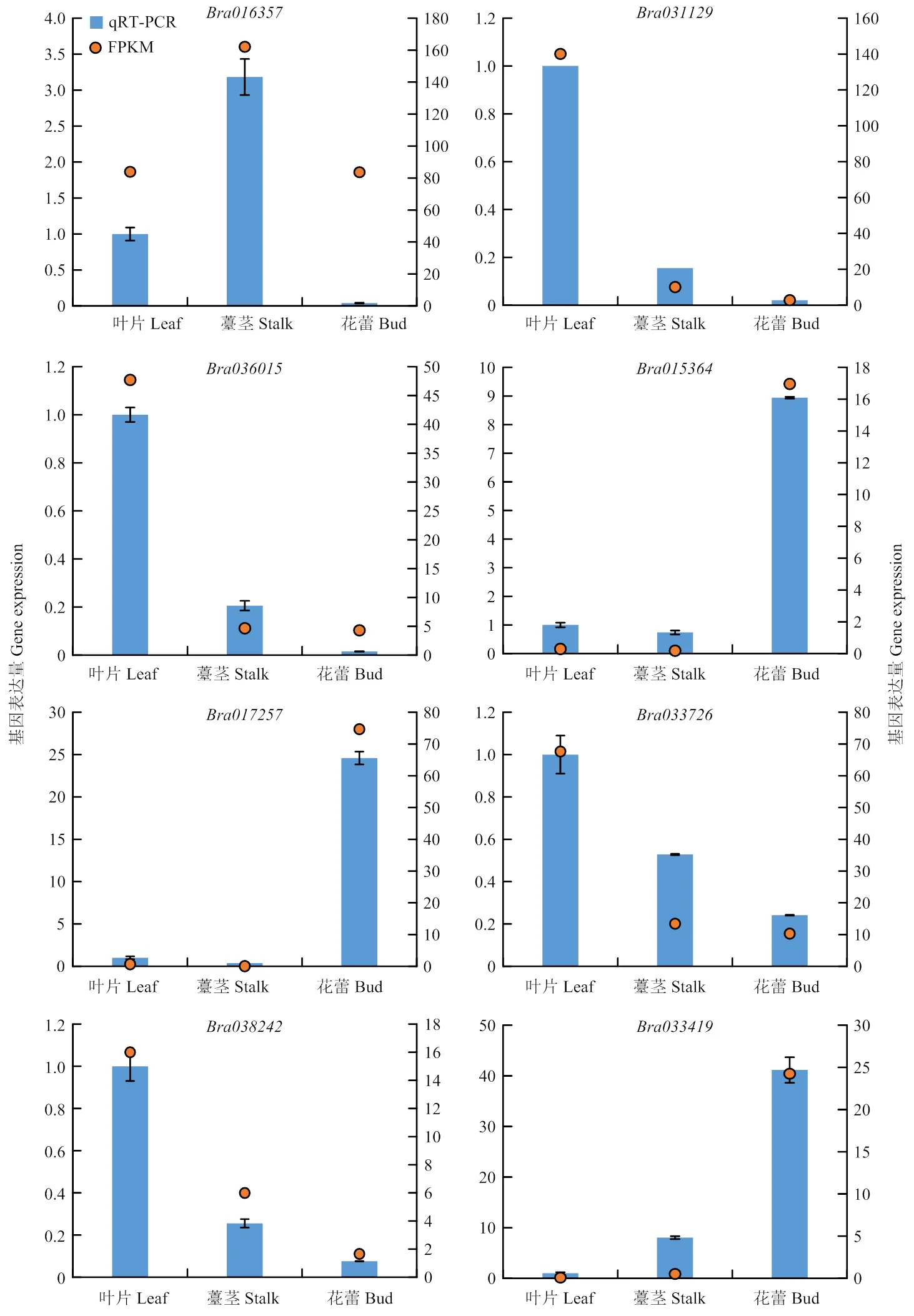
图3 基因表达量RT-qPCR验证分析
2.3 糖代谢关键酶编码基因的表达分析
糖代谢和转运过程中涉及到的关键调控酶包括蔗糖代谢相关酶-蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)和蔗糖转化酶(INV)以及转运蛋白-蔗糖转运蛋白(SWEET10/11/15)、果糖转运蛋白(SWEET16/17)和葡萄糖转运蛋白(SWEET1/2)(图4)。
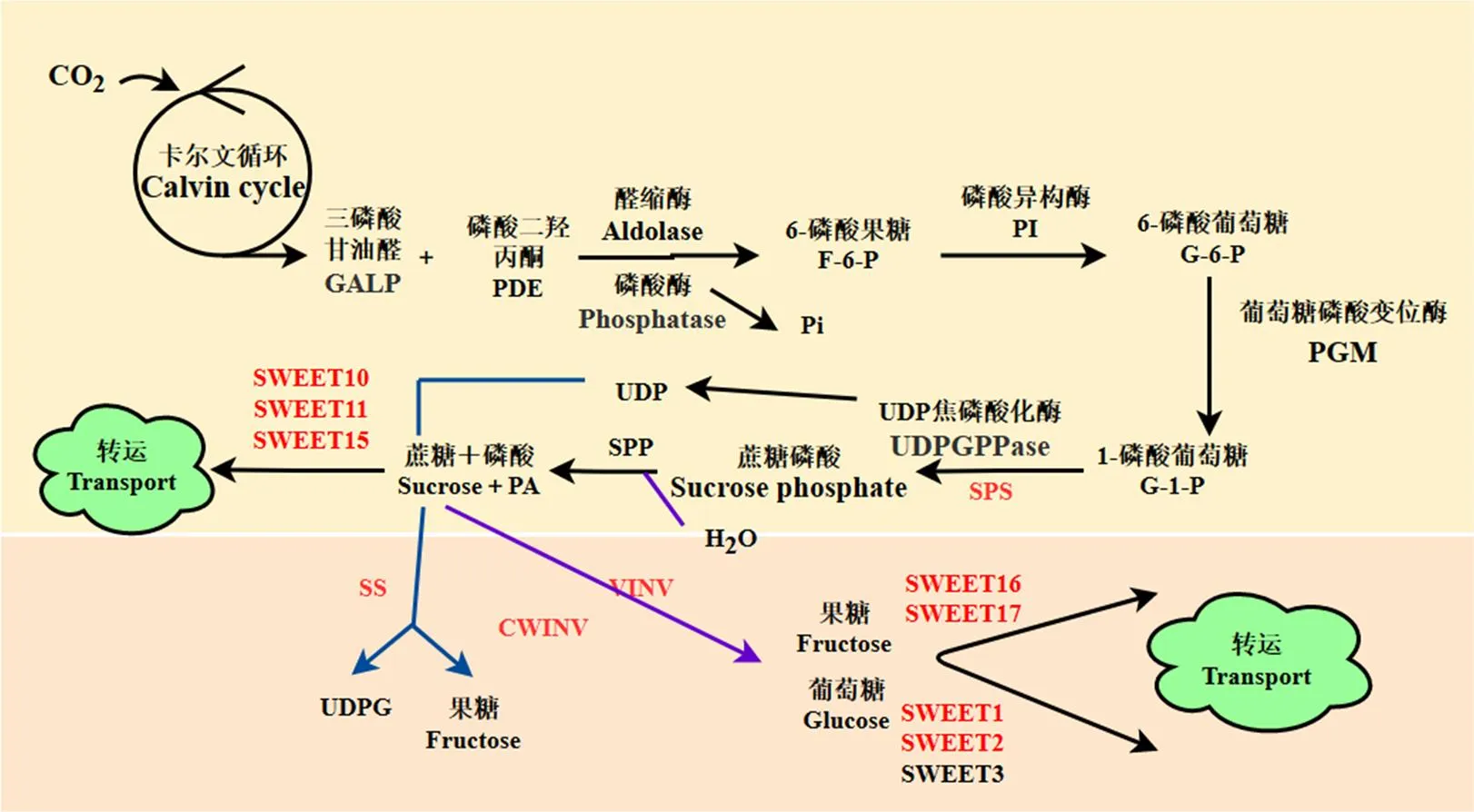
红色字体代表糖代谢过程的相关酶 The red font represents the enzymes involved in the process of sugar metabolism
根据拟南芥糖代谢酶及转运蛋白编码基因,在大白菜网站中找到26个糖代谢和16个糖转运蛋白的同源基因(表3)。这些基因在菜心3个不同器官中的表达表明,大部分糖代谢酶基因的表达量在叶片vs薹茎和叶片vs花蕾中上调,转运基因的表达量在叶片vs薹茎和叶片vs花蕾中下调,与测得的葡萄糖和果糖的含量变化趋势一致(图1)。
转录组分析显示,编码SPS的基因、和在花蕾中表达量最高,其次是薹茎,叶片中的表达量最低,说明在叶片中合成的蔗糖向茎端和花蕾中输送,导致薹茎和花蕾中蔗糖含量得到积累。编码SS1的和在薹茎和花蕾中的表达量都高于叶片,编码液泡蔗糖转化酶(VINV)的、、和在叶片vs薹茎和叶片vs花蕾均上调,但在叶片、薹茎和花蕾中表达量较低。编码细胞壁蔗糖转化酶(CWINV)的、、和在叶片vs薹茎、叶片vs花蕾和薹茎vs花蕾中都表达上调,、在叶片和薹茎中均未表达,在花蕾中表达量上调。这些结果与菜心3个器官中蔗糖、葡萄糖和果糖的含量变化一致(图1)。
一些调控糖代谢的酶编码基因在3个器官中表达变化无规律。、、和编码SPS,在薹茎和花蕾中的表达量均高于叶片,且在花蕾中表达量最高,与蔗糖含量变化趋势相反。编码SS的和均在薹茎中表达量最低,而、和在薹茎中表达量最高,在花蕾中表达量最低,与前两个基因表达趋势相反。、和在叶片vs薹茎中表达下调,在薹茎中表达量最低,在花蕾中表达量显著升高。
编码SWEET11的在叶片vs薹茎vs花蕾中表达下调,表明蔗糖在叶片中转运速度较快,逐渐向茎和花蕾中运输,使花蕾和薹茎中蔗糖含量高于叶片。编码SWEET2的、和表达量在叶片vs薹茎和叶片vs花蕾中下调。
此外,综合分析基因的表达趋势,发现18个编码糖代谢酶和转运蛋白的基因与糖含量变化趋势一致(、、、、、、、、、、、、、、、、和)(表3、图1),可进一步深入研究。

表3 糖代谢相关酶的基因表达
—:无差异。下同 —: No difference. The same as below
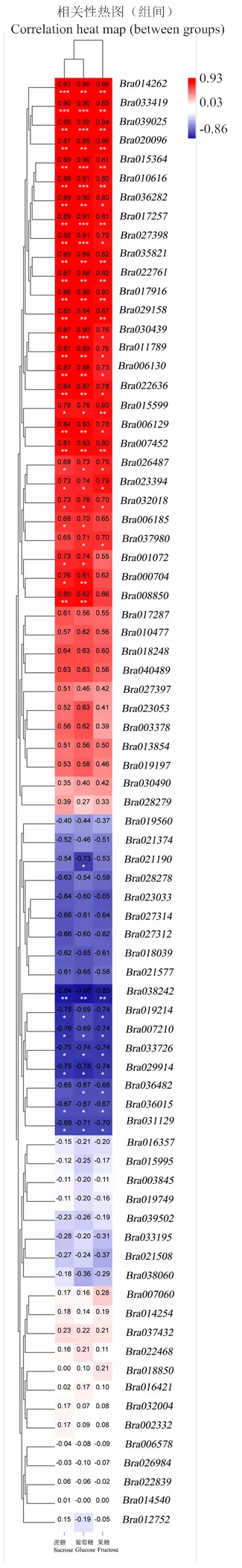
热图中的蓝色、白色和红色分别代表相关系数r从低到高
2.4 糖代谢和转运关键基因的挖掘
通过分析菜心3个器官的转录组数据,设置FDR≤0.01和Fold change≥2,对3个器官进行两两比较,找出77个与糖代谢和转运相关的差异表达基因。为了筛选出与葡萄糖和果糖代谢转运密切相关的关键基因,以≤0.05作为显著阈值,将这些基因的FPKM值与糖种类及含量在基迪奥生物信息云工具平台进行相关性分析,得到32个与葡萄糖和果糖均显著相关的基因(图5、表4),叶片vs薹茎、叶片vs花蕾和薹茎vs花蕾中的差异表达基因分别有16个、29个和24个,3个组合两两比较共有差异基因分别为14个、22个和8个,其中有7个差异基因在3个组合中共有(图6)。32个相关基因中有14个基因与糖含量变化趋势一致。
按照各基因编码酶参与糖代谢途径的先后次序,编码SPS,和编码SPP,在蔗糖合成过程中起关键作用,这些基因在花蕾和薹茎中的表达量高于叶片。、、、、和编码CWINV,是蔗糖转化成葡萄糖和果糖的关键酶。这些基因除在叶片vs花蕾、薹茎vs花蕾上调不显著外,其余均显著上调。
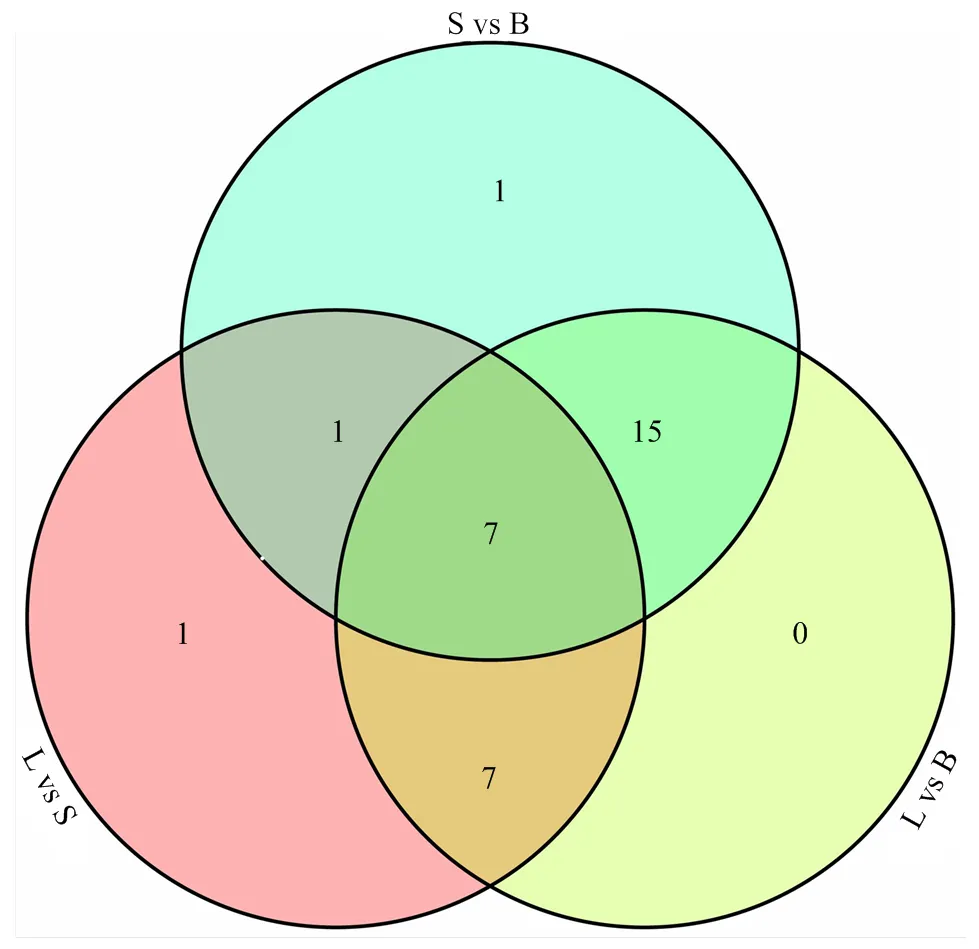
L vs S:叶vs薹;L vs B:叶vs花;S vs B:薹vs花

表4 与糖代谢密切相关的关键差异表达基因分析
、和编码GLK,催化葡萄糖磷酸化,在叶片vs薹茎vs花蕾中表达下调;编码SWEET11,主要参与蔗糖的转运过程。在叶片中的表达量高于薹茎和花蕾;编码转运蛋白STP4,在葡萄糖运输中起作用,在叶片vs薹茎vs花蕾中显著下调表达,叶片到花蕾转运速度逐渐变慢。
综合18个糖代谢关键酶和转运蛋白编码基因及14个与糖含量密切相关的DEG,合并7个共有基因,总计25个基因与糖含量变化趋势一致(图7)。

绿色、黑色和红色表示基因表达由低到高。蓝色背景中的基因与糖含量密切相关
3 讨论
3.1 糖含量与蔬菜的品质
优良的风味和营养品质是菜心深受消费者喜爱的关键。近年来,人们尤其关注菜心的甜度和口感。蔬菜中甜度由其可溶性糖组分的种类和含量决定,而菜心同一品种不同器官的可溶性糖组分和含量有一定的差异。蔗糖在源库之间的代谢转运影响菜心产品器官的形成,薹茎和花蕾品质形成的关键在于糖在源库间的代谢和转运过程[15]。菜薹生长发育过程中,晚熟品种薹茎中的可溶性糖、蔗糖和果糖含量均高于叶片[16]。对迟花芥蓝不同器官的营养成分研究发现薹茎中的可溶性糖、果糖和蔗糖含量最高,其次为叶柄和叶片[17]。以上研究表明,随着十字花科植物花薹的发育,其各种糖组分的含量逐渐增多。本研究中菜心3个器官的可溶性糖、蔗糖、葡萄糖和果糖均表现为在花蕾中的含量依次高于薹茎和叶片,与前人的研究结果一致。
3.2 糖代谢转运相关酶编码基因的表达与糖含量的相关性
在蔗糖合成代谢过程中,蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)和蔗糖转化酶(INV)起着至关重要的作用[18]。SPS是蔗糖合成的关键限速酶,而SS和INV是蔗糖分解代谢的主要酶[19],SS将蔗糖转化为UDP-葡萄糖和果糖,INV能催化蔗糖降解为葡萄糖和果糖[20]。结合转录组学分析发现18个糖代谢转运酶编码基因的表达变化与糖含量变化一致。、和编码SPS,SPS参与源组织的长途运输及库组织中蔗糖的代谢。甜高粱茎中表达量明显高于普通高粱[21]。贾荣荣等[22]发现棉花在花中表达量较高,可能主要参与花发育。山溪等[23]发现在芽中表达量较高,在其他组织中表达量较低。本试验中,这些基因在花蕾中表达量显著高于薹茎和叶片,与以上研究结果相似。SS和INV在蔗糖代谢中主要起分解作用[24]。柴静等[25]通过抑制拟南芥中的表达,转基因植株的葡萄糖含量显著低于野生型株系。苏宁[26]以超表达植株为材料,发现转基因植株中葡萄糖和果糖含量高于野生型株系。本研究中,编码SS的和、编码VINV的、和以及编码CWINV的、、在薹茎和花蕾中的表达量高于叶片,导致蔗糖在花蕾中迅速分解转化成葡萄糖和果糖,使葡萄糖和果糖含量在花蕾中积累,这就解释了薹茎和花蕾中的葡萄糖和果糖含量高的原因。
SWEET转运蛋白参与糖转运的过程。SWEET10/ 11/15主要参与蔗糖和葡萄糖的转运,SWEET16/17在果糖转运中发挥作用,而SWEET1/2/3参与葡萄糖的转运过程[27]。黄成等[28]发现甘蔗在根、茎、叶中均有表达,且茎、叶中表达量最高。李明[29]发现马铃薯在叶中特异性高表达,在花中特异性高表达。本试验中编码SWEET16,在花蕾中特异性高表达,与前人结果一致。和、、分别编码SWEET11和SWEET2,这些基因在叶片和薹茎中有高表达,在花蕾中表达量较低,表明叶片中蔗糖和葡萄糖的转运速度较快,花蕾中转运速度较慢,使糖类在花蕾中得到积累,这就解释了蔗糖和葡萄糖在花蕾中含量高于叶片的原因。
3.3 差异表达基因与糖含量的关系
通过分析不同器官中差异表达基因与糖种类和含量的相关性,筛选到14个与糖代谢转运密切相关的DEG。其中和编码SPP1,可将蔗糖-6-磷酸分解成蔗糖[30]。徐志华[31]克隆了菜用大豆的,转的拟南芥种子蔗糖含量显著高于野生型植株,表明SPP主要参与蔗糖合成过程。本试验中编码SPP1的基因在花蕾中有高表达,这可能造成花蕾中蔗糖含量的积累。、、和编码葡萄糖激酶(GLK),该酶主要在葡萄糖代谢过程中发挥作用。洪泂等[32]在耐热酵母中过表达可以恢复敲除后葡萄糖代谢受到的影响,HXK可以磷酸化葡萄糖[33],FRK催化果糖磷酸化[34],证明GLK和HXK发挥作用一致。本研究中,这些基因的表达量均在叶片vs薹茎vs花蕾中下调,己糖在花蕾中分解较少,使葡萄糖和果糖含量在薹茎和花蕾中积累。编码转运蛋白STP4,定位于细胞膜上,主要转运葡萄糖和果糖等单糖[35],这个基因在叶片中有高表达,在花蕾中表达量较低,这种趋势解释了花蕾中葡萄糖和果糖含量较高的原因,至于基因的转运机制仍需进一步分析。
4 结论
菜心不同部位中可溶性糖、蔗糖、葡萄糖和果糖的含量均呈现花蕾>薹茎>叶片的变化趋势,且差异显著。通过转录组测序分析与糖代谢及转运相关酶编码基因的表达分析,发现大部分编码糖代谢酶和转运蛋白的基因表达与糖含量变化趋势一致,其中18个基因完全符合。分析3个器官间的差异表达基因,鉴定到14个与糖种类相关且与3个部位糖含量变化趋势一致的基因,推测这些基因在菜心的糖代谢和转运过程中发挥重要作用,研究结果有助于进一步解释菜心不同器官糖代谢转运的分子机制。
[1] ZOU L, TAN W K, DU Y Y, LEE H W, LIANG X, LEI J J, STRIEGEL L, WEBER N, RYCHLIK M, ONG C N. Nutritional metabolites insubsp.var.(choy sum) at three different growth stages: Microgreen, seedling and adult plant. Food Chemistry, 2021, 357: 129535.
[2] FENG X J, MA J J, LIU Z Q, LI X, WU Y H, HOU L P, LI M L. Analysis of glucosinolate content and metabolism related genes in different parts of Chinese flowering cabbage. Frontiers in Plant Science, 2022, 12: 767898.
[3] TEIXEIRA R T, KNORPP C, GLIMELIUS K. Modified sucrose, starch, and ATP levels in two alloplasmic male-sterile lines of. Journal of Experimental Botany, 2005, 56(414): 1245-1253.
[4] WU Y L, LI Y L, LI Y Y, MA Y Z, ZHAO Y L, WANG C Z, CHI H B, CHEN M, DING Y H, GUO X P, MIN L, ZHANG X L. Proteomic analysis reveals that sugar and fatty acid metabolisms play a central role in sterility of the male-sterile line 1355A of cotton. Journal of Biological Chemistry, 2019, 294(17): 7057-7067.
[5] 张晓艳, 叶珺琳, 李仕芳, 柴喜荣, 赵普艳, 杨暹. 不同熟性菜心品种糖代谢规律的研究. 广东农业科学, 2015, 42(18): 25-31.
ZHANG X Y, YE J L, LI S F, CHAI X R, ZHAO P Y, YANG X. Research on sugar metabolism regular of flowering Chinese cabbage varieties with different maturity cultivars. Guangdong Agricultural Sciences, 2015, 42(18): 25-31. (in Chinese)
[6] 张梦. 百合花瓣成分分析及糖代谢相关酶基因表达的研究[D]. 北京: 北京林业大学, 2019.
ZHANG M. Composition analysis of lily petals and study on gene expression of enzymes related to sugar metabolism [D]. Beijing: Beijing Forestry University, 2019. (in Chinese)
[7] 马春梅, 郭海龙, 龚振平, 徐瑶, 魏丹, 迟凤琴. 大豆叶片可溶性糖代谢动态变化与相关酶活性的研究. 作物杂志, 2012(5): 71-75.
MA C M, GUO H L, GONG Z P, XU Y, WEI D, CHI F Q. Study on dynamic change of soluble sugar metabolism and related enzyme activity in soybean leaf. Crops, 2012(5): 71-75. (in Chinese)
[8] WEN X X, ZHANG W Q, FENG Y Q, YU X Y. Cloning and characterization of a sucrose synthase-encoding gene from muskmelon. Molecular Biology Reports, 2010, 37(2): 695-702.
[9] XU S M, BRILL E, LLEWELLYN D J, FURBANK R T, RUAN Y L. Overexpression of a potato sucrose synthase gene in cotton accelerates leaf expansion, reduces seed abortion, and enhances fiber production. Molecular Plant, 2012, 5(2): 430-441.
[10] 魏华伟, 柴松琳, 胡克玲, 侯金锋, 高朋, 高优洋, 陈友根. 辣椒酸性蔗糖转化酶基因家族鉴定及表达. 分子植物育种, 2019, 17(15): 4900-4907.
WEI H W, CHAI S L, HU K L, HOU J F, GAO P, GAO Y Y, CHEN Y G. Genome identification and expression of acid invertase gene in pepper. Molecular Plant Breeding, 2019, 17(15): 4900-4907. (in Chinese)
[11] 吴英华, 马嘉俊, 李梅兰, 侯雷平. 山西晋中地区塑料大棚菜心品种筛选. 山西农业科学, 2021, 49(1): 38-45.
WU Y H, MA J J, LI M L, HOU L P. Variety selection of flowering Chinese cabbage in plastic greenhouse in Jinzhong area of Shanxi. Journal of Shanxi Agricultural Sciences, 2021, 49(1): 38-45. (in Chinese)
[12] 陈克克. 地瓜儿可溶性糖和还原糖的含量测定. 西安文理学院学报(自然科学版), 2009, 12(1): 39-42.
CHEN K K. Determination of soluble sugar and reducing sugar in the root ofTurcz. Journal of Xi’an University of Arts and Science (Natural Science Edition), 2009, 12(1): 39-42. (in Chinese)
[13] 张志良, 瞿伟菁, 李小方. 植物生理学实验指导. 4版. 北京: 高等教育出版社, 2009.
ZHANG Z L, QU W J, LI X F. Experimental Instruction of Plant Physiology. 4th ed. Beijing: Higher Education Press, 2009. (in Chinese)
[14] SHANG M Y, WANG X T, ZHANG J, QI X H, PING A M, HOU L P, XING G M, LI G Z, LI M L. Genetic regulation of GA metabolism during vernalization, floral bud initiation and development in pak choi (ssp. chinensis makino). Frontiers in Plant Science, 2017, 8: 1533.
[15] 孙勃, 方莉, 刘娜, 闫会转, 张雅君, 施倩倩, 汪俏梅. 芥蓝不同器官主要营养成分分析. 园艺学报, 2011, 38(3): 541-548.
SUN B, FANG L, LIU N, YAN H Z, ZHANG Y J, SHI Q Q, WANG Q M. Studies on main nutritional components of Chinese kale among different organs. Acta Horticulturae Sinica, 2011, 38(3): 541-548. (in Chinese)
[16] 陈荣宇, 钟玉娟, 谢大森, 张艳, 陈汉才, 薛舒丹. 不同菜心品种的营养品质及外在感官品质评价分析. 广东农业科学, 2020, 47(5): 21-28.
CHEN R Y, ZHONG Y J, XIE D S, ZHANG Y, CHEN H C, XUE S D. Evaluation analysis on nutritional quality and external sensory quality of Chinese flowering cabbage varieties. Guangdong Agricultural Sciences, 2020, 47(5): 21-28. (in Chinese)
[17] 叶珺琳, 张晓艳, 柴喜荣, 赵普艳, 康云艳, 李仕芳, 杨暹. 芥蓝主要营养成分与活性氧代谢的研究. 广东农业科学, 2016, 43(4): 57-62.
YE J L, ZHANG X Y, CHAI X R, ZHAO P Y, KANG Y Y, LI S F, YANG X. Research on main nutritional components and active oxygen metabolism in Chinese kale (Bailey). Guangdong Agricultural Sciences, 2016, 43(4): 57-62. (in Chinese)
[18] 张永平, 乔永旭, 喻景权, 赵智中. 园艺植物果实糖积累的研究进展. 中国农业科学, 2008, 41(4): 1151-1157. doi: 10.3864/j.issn.0578- 1752.2008.04.026.
ZHANG Y P, QIAO Y X, YU J Q, ZHAO Z Z. Progress of researches of sugar accumulation mechanism of horticultural plant fruits. Scientia Agricultura Sinica, 2008, 41(4): 1151-1157. doi: 10.3864/j.issn.0578- 1752.2008.04.026. (in Chinese)
[19] 冯献君, 吴英华, 史艳, 侯雷平, 李梅兰. 菜心酸性蔗糖转化酶基因家族的鉴定及表达分析. 江苏农业科学, 2022, 50(19): 44-50.
FENG X J, WU Y H, SHI Y, HOU L P, LI M L. Identification and expression analysis of acid sucrose invertase gene family in Chinese cabbage. Jiangsu Agricultural Sciences, 2022, 50(19): 44-50. (in Chinese)
[20] RUAN Y L. Sucrose metabolism: gateway to diverse carbon use and sugar signaling. Annual Review of Plant Biology, 2014, 65: 33-67.
[21] 杨明. 甜高粱蔗糖代谢相关酶SPS、SS表达与蔗糖积累的相关性研究[D]. 保定: 河北农业大学, 2008.
YANG M. Study on the correlation between the expression of SPS and SS related enzymes of sucrose metabolism and sucrose accumulation in sweet sorghum [D]. Baoding: Hebei Agricultural University, 2008. (in Chinese)
[22] 贾荣荣, 路莎莎, 江媛, 刘增平, 俞嘉宁. 棉花GhSPS1的克隆及表达模式分析. 中国农业科学, 2012, 45(6): 1031-1041. doi: 10.3864/j.issn.0578-1752.2012.06.001.
JIA R R, LU S S, JIANG Y, LIU Z P, YU J N. Cloning and analysis expression patterns of GhSPS1 gene in cotton. Scientia Agricultura Sinica, 2012, 45(6): 1031-1041. doi: 10.3864/j.issn.0578-1752.2012. 06.001. (in Chinese)
[23] 山溪, 秦文斌, 张振超, 姚悦梅, 戴忠良, 饶斌. 甘蓝蔗糖磷酸合酶家族的鉴定和表达分析. 江苏农业科学, 2021, 49(16): 53-60.
SHAN X, QIN W B, ZHANG Z C, YAO Y M, DAI Z L, RAO B. Identification and expression analysis of sucrose phosphate synthase family in cabbage. Jiangsu Agricultural Sciences, 2021, 49(16): 53-60. (in Chinese)
[24] 闻小霞. 甜瓜果实蔗糖合成酶基因(SS)的克隆、表达分析及遗传转化[D]. 泰安: 山东农业大学, 2010.
WEN X X. Cloning, expression analysis and genetic transformation of sucrose synthase gene (SS) in melon fruit [D]. Taian: Shandong Agricultural University, 2010. (in Chinese)
[25] 柴静, 俞嘉宁, 屈生宪, 张会. 蔗糖合酶基因AtSUS3干涉后对拟南芥角果发育的影响. 西北植物学报, 2013, 33(4): 678-683.
CHAI J, YU J N, QU S X, ZHANG H. Sucrose synthase gene- AtSUS3 with RNA interference affects siliques maturation in. Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(4): 678-683. (in Chinese)
[26] 苏宁. 拟南芥蔗糖转化酶基因AtCWINV4的功能研究及对油菜的遗传转化[D]. 武汉: 华中师范大学, 2013.
SU N. Study on the function ofsucrose invertase gene AtCWINV4 and its genetic transformation to rape [D]. Wuhan: Central China Normal University, 2013. (in Chinese)
[27] CHEN L Q. SWEET sugar transporters for phloem transport and pathogen nutrition. New Phytologist, 2014, 201(4): 1150-1155.
[28] 黄成, 张明阳, 郭燕芳, 王锦达. 甘蔗双向糖转运蛋白基因的克隆与表达分析. 中国糖料, 2021, 43(2): 1-8.
HUANG C, ZHANG M Y, GUO Y F, WANG J D. Cloning and expression analysis ofgene from sugarcane. Sugar Crops of China, 2021, 43(2): 1-8. (in Chinese)
[29] 李明. 马铃薯糖转运蛋白StSWEET基因的克隆及功能分析[D]. 西宁: 青海大学, 2019.
LI M. Cloning and functional analysis of potato sugar transporter StSWEET gene [D]. Xining: Qinghai University, 2019. (in Chinese)
[30] 唐朝荣, 肖小虎, 方永军, 龙翔宇. 巴西橡胶树磷酸蔗糖磷酸化酶基因的克隆和表达模式分析. 热带作物学报, 2013, 34(5): 855-859.
TANG C R, XIAO X H, FANG Y J, LONG X Y. Cloning and expression of a sucrose phosphate phosphatase gene from. Chinese Journal of Tropical Crops, 2013, 34(5): 855-859. (in Chinese)
[31] 徐志华. 大豆蔗糖代谢相关基因和的克隆及功能分析[D]. 南京: 南京农业大学, 2013.
XU Z H. Cloning and functional analysis of genes related to sucrose metabolism in soybeanand[D]. Nanjing: Nanjing Agricultural University, 2013. (in Chinese)
[32] 洪泂, 张国荣, 卢敏, 王冬梅. 高温下高效利用菊芋一步生产高纯果糖的耐高温菌株及应用: CN106222101A. 2020-03-27.
HONG J, ZHANG G R, LU M, WANG D M. High-temperature- resistant strain for producing high-purity fructose at high temperature in one step through efficient utilization of Jerusalem artichoke and application of high-temperature-resistant strain: CN106222101A. 2020-03-27. (in Chinese).
[33] ZHAO B Y, QI K J, YI X R, CHEN G D, LIU X, QI X X, ZHANG S L. Identification of hexokinase family members in pear () and functional exploration of
[34] 叶香媛, 周文彬. 植物果糖激酶研究进展. 科学通报, 2021, 66(22): 2820-2831.
YE X Y, ZHOU W B. Research progress of plant fructose kinase. Chinese Science Bulletin, 2021, 66(22): 2820-2831. (in Chinese)
[35] OTORI K, TANABE N, TAMOI M, SHIGEOKA S. Sugar Transporter Protein 1 (STP1) contributes to regulation of the genes involved in shoot branching via carbon partitioning in. Bioscience, Biotechnology, and Biochemistry, 2018, 83(3): 1-10.
Comparison of Sugar Content and Expression Analysis of Genes Related to Sugar Metabolism in Different Parts of Chinese Flowering Cabbage
FENG XianJun1, WANG Li2, WANG Tong1, HOU LeiPing, LI MeiLan
1College of Horticulture,Shanxi Agricultural University, Taigu 030801, Shanxi;2Modern Agricultural Industry Development Service Center, Agricultural and Rural Bureau, Zuoquan County, Zuoquan 032600, Shanxi
【Objective】Chinese flowering cabbage has become one of the most popular vegetables in southern China due to its crunchy taste and high nutritional value. The type and content of sugars are the main factors for determining the sweetness and flavour of Chinese flowering cabbage. Therefore, this paper analyzed the sugar content and the expression of genes related to sugar metabolism and transport in different organs, so as to investigate the molecular mechanisms responsible for the differences in sugar content in different organs of Chinese flowering cabbage. 【Method】In this experiment, the content of soluble sugars, sucrose, glucose and fructose in leaves, stalks and flower buds were determined by high performance liquid chromatography (HPLC). The expression of genes in leaves, stalks and buds was analyzed comprehensively and systematically by transcriptome sequencing (RNA-seq), and the differentially expressed genes (DEGs) between three different organs were identified using DESeq2 software. In addition, the expression of genes encoding enzymes involved in the sugar metabolic pathway and transport process was analyzed, and the correlation with sugar content were analyzed on OmicShare. Moreover, the expression of some genes was verified using quantitative real-time fluorescence PCR (qRT-PCR).【Result】The sugar content varied significantly among the different organs of Chinese flowering cabbage. Soluble sugars, sucrose, glucose and fructose all showed a trend of buds>stalks>leaves. The glucose content in flower buds was 1.3 and 1.6 times of that in stalks and leaves; the fructose content was 1.42 and 1.78 times of that in stalks and leaves, respectively. By analyzing the relation and consistency between the expression of genes coding enzymes involving in sugar metabolism and transport and content of the sugar, a total of 18 genes were screened. By analyzing the correlation and consistency of the expression of DEGs among different organs with sugar species and content, 14 DEGs were identified. By merging 7 common genes (,,,,,and), expression of 25 genes in total were consistent with the sugar content. qRT-PCR results showed that the relative expression of the eight DEGs were highly consistent with their FPKM values from RNA-seq, indicating that the sequencing results were accurate and reliable.【Conclusion】 The sugar content in the flower buds of Chinese flowering cabbage was higher than that in stalks and leaves, because the expression of genes encoding sugar synthesis-related enzymes was higher in buds than in stalks and leaves. These results laid a certain foundation for revealing the molecular mechanism of sugar metabolism and transport in different organs of Chinese flowering cabbage.
Chinese flowering cabbage; organs; sugar; RNA-seq; gene
2022-07-26;
2022-11-15
山西省重点研发计划重点项目(201703D211001-04-01)、山西农业大学曲沃果蔬研究院项目(2021QWGS-3)
冯献君,E-mail:643046085@qq.com。通信作者侯雷平,E-mail:sxndhlp@126.com。通信作者李梅兰,E-mail:15935485975@163.com
10.3864/j.issn.0578-1752.2023.11.010
(责任编辑 赵伶俐)
