基于生物信息学分析药物治疗骨关节炎的潜在基因靶点▲
2023-06-25刘金富陈莉华陆冠宇
黄 悦 曾 平 刘金富 陈莉华 陆冠宇 熊 波 陈 财
(1 广西中医药大学第一临床医学院,广西南宁市 530022; 2 广西中医药大学第一附属医院骨二科,广西南宁市 530022)
骨关节炎是临床上常见的慢性关节疾病,其主要临床表现包括慢性疼痛、关节不稳定、僵硬、关节畸形等,影像学上表现为关节间隙狭窄等[1-3]。骨关节炎的发生和发展与炎症因子、代谢因子密切相关[4-5]。关节镜检查、MRI检查和超声检查均发现并证实早期骨关节炎存在滑膜增厚、水肿等滑膜形态学改变[6]。有研究表明,骨关节炎患者的软骨损失程度和关节退化进程与滑膜增生及促炎细胞因子的异常产生有关[7-10]。滑膜的病理改变通常发生在软骨损伤之前[11],滑膜炎症介质和促炎症介质的产生在骨关节炎的发病机制中起着重要作用[12],但其病理机制尚未完全确定。研究表明,骨关节炎的发生与发展可能是由多种基因和信号通路介导[13]。因此,研究骨关节炎发病的分子机制,对寻找有效的治疗方法具有重要意义。本研究通过数据挖掘找出骨关节炎患者滑膜组织的差异表达基因(differentially expressed genes,DEGs),对其进行功能和通路富集分析,并通过构建蛋白-蛋白相互作用(protein-protein interaction,PPI)网络筛选关键基因。同时,对骨关节炎常用的治疗药物进行文本挖掘,对其药物靶基因行进一步鉴定。然后对最终确定的靶基因进行实时荧光定量PCR以验证其结果,为了解骨关节炎的潜在发病机制及临床治疗药物的使用提供分子依据。
1 资料与方法
1.1 芯片数据来源 在基因表达综合(Gene Expression Omnibus,GEO)数据库[14](https://www.ncbi.nlm.nih.gov/gds)中以“Osteoarthritis”为检索词进行筛选。筛选条件:(1)实验对象为“Homo sapiens(人类)”;(2)数据集包括实验组和对照组;(3)平台文件可以直接下载;(4)样本组织来源均为膝关节滑膜组织;(5)检索时间为2012年1月至2020年12月。得到符合条件的微阵列芯片GSE41038、GSE55235、GSE55457和GSE82107,基因表达谱样本共包含33个骨关节炎滑膜组织样本和31个健康人滑膜组织样本。见表1。

表1 4个数据集相关信息
1.2 方法
1.2.1 筛选DEGs:对原始数据进行归一化处理和log2转换,以最大限度地减少本次综合分析所涉及不同数据集之间的异质性。采用R语言软件(https://www.r-project.org/,版本:4.0.3)的 ggplot2包筛选DEGs,设置调整后的P<0.05和|Log2FC|≥2为筛选标准,生成火山图。使用pheatmap包生成DEGs的分层聚类分析热图。
1.2.2 DEGs富集分析:采用DAVID数据库(https://david.ncifcrf.gov/)[15]进行DEGs的基因本体论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。GO功能富集分析包括生物学过程、分子功能和细胞组分。设定基因数>2和P<0.05为筛选条件,依据校正后的P值降序排列,将生物学过程、分子功能、细胞成分富集分析的结果以柱状图展示。
1.2.3 构建PPI网络和模块化分析:将所有DEGs的目标基因名导入STRING数据库[16](https://string-db.org/),并使用Cytoscape软件(版本3.7.2, http://www.cytoscape.org/)制作PPI网络图,设置中等置信区间为0.4,分子复杂检测插件参数为得分>5、degree值截止=2、节点截止分数=0.2、最大深度=100、k-得分=2。通过Cytoscape软件cytoHubba插件中的degree算法,筛选出degree值排名前10的核心靶点,并评估PPI网络中的中枢模块,对分子复杂检测插件参数得分较高的两个模块进行下一步分析,得分最高的模块定义为中枢模块,得分第二高的模块定义为次模块。
1.2.4 药物和靶基因鉴定:DRUGBANK数据库(https://go.drugbank.com/)是一个免费的综合性药物资源网站,其包含有关美国食品药品管理局(Food and Drug Administration,FDA)批准的药物和正在申请FDA批准的实验药物的药物靶点、药物功效和药物相关作用的信息[17]。在DRUGBANK数据库中以 “Osteoarthritis”作为关键词进行检索,选择“已批准的药物”,可筛选出50种治疗骨关节炎的相关药物,在药物-基因相互作用数据库(Drug-Gene Interaction Database,DGIdb;https://www.dgidb.org/)中鉴定其分子靶标,将这些可能具有治疗骨关节炎作用的靶基因与中枢模块的关键基因取交集,得到药物治疗骨关节炎的关键基因,并制作PPI图。
1.3 相关基因的实时荧光定量PCR验证
1.3.1 临床资料 选取2021年1—3月在广西中医药大学第一附属医院进行诊治的4例骨关节炎患者(实验组)和4例关节创伤患者(对照组)的滑膜组织用于实时荧光定量PCR验证,患者均为男性,患者之间无亲缘关系。实验组纳入标准:(1)符合原发性骨关节炎诊断标准[18]和手术治疗指征;(2)年龄30~50岁;(3)自愿参与本研究并签署知情同意书。实验组排除标准:(1)患有风湿性骨关节炎、痛风性关节炎的患者;(2)合并乙肝、结核、梅毒等传染性疾病的患者;(3)合并严重心脑血管疾病、恶性肿瘤等原发性疾病的患者。对照组纳入标准:(1)因外伤导致膝关节骨折或韧带损伤,需要进行手术治疗;(2)年龄30~50岁;(3)自愿参与本研究并签署知情同意书。对照组排除标准:(1)诊断为骨关节炎的患者;(2)合并乙肝、结核、梅毒等传染性疾病的患者;(3)合并有严重心脑血管疾病、恶性肿瘤等原发性疾病的患者。本研究经广西中医药大学第一附属医院医学伦理委员会批准。
1.3.2 实时荧光定量PCR:术中取患处膝关节的滑膜组织,剔除血污及脂肪组织,使用TRIzol试剂盒(Thermo Fisher Scientific公司,批号:391506)提取滑膜组织的总RNA,采用反转录试剂盒[莫纳(武汉)生物科技有限公司,批号:230631]将RNA反转录为cDNA,然后使用MonScriptTMRTⅢ All-in-One Mix with dsDNase[莫纳(武汉)生物科技有限公司,批号:130632]进行实时荧光定量PCR。反应体系:MonAmpTMChemoHS Specificity Plus qPCR Mix 10 μL,正向引物0.4 μL,反向引物0.4 μL,DNA模板1 μL,加Nuclease-Free水至20 μL。反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火10 s,72 ℃ 延伸30 s,共40个循环。以GAPDH作为内参,使用2-ΔΔCt法计算血管内皮生长因子(vascular endothelial growth factor,VEGF)A、基质金属蛋白酶(matrix metalloproteinase,MMP)1、MMP9、前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)mRNA的相对表达水平。数据采集由LightCycler 96型PCR仪(Roche公司)完成。实验共重复3次。引物设计由PREMIER Biosoft公司完成,引物序列见表2。

表2 引物序列
1.4 统计学分析 采用R语言软件(版本:4.0.3)和GraphPad Prism 软件(版本:8.0.1)进行统计学分析。计量资料以(x±s)表示,组间比较采用两独立样本t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 DEGs筛选结果 共筛选出111个DEGs,其中表达上调基因55个、表达下调基因56个。DEGs火山图见图1,DEGs热图见图2。

图1 DEGs火山图

图2 DEGs热图
2.2 DEGs富集分析 GO功能富集分析结果显示,DEGs的生物学过程主要富集于对RNA聚合酶Ⅱ启动子的转录进行正向调节、细胞黏附、血管生成、免疫反应、凋亡过程的正向调控等;细胞成分主要富集在细胞外区域、浆膜、细胞外间质、细胞外泌体、浆膜的重要组成部分等;分子功能主要富集在转录因子活性与特异性序列DNA结合、蛋白质同质化活性、肝素结合物、RNA聚合酶Ⅱ核心启动子近端区域序列特异的DNA结合等。KEGG通路富集分析结果显示,DEGs主要与白细胞介素(interleukin,IL)-17信号通路、类风湿关节炎、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、流体剪切应力和动脉粥样硬化、卡波西肉瘤相关的疱疹病毒感染等有关。见图3、图4。
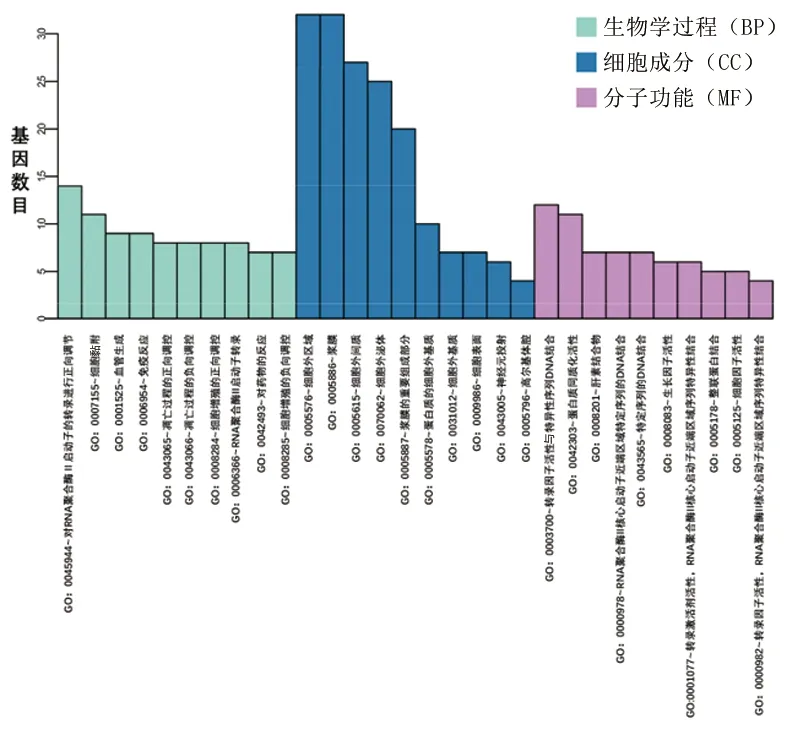
图3 DEGs的GO功能富集分析图
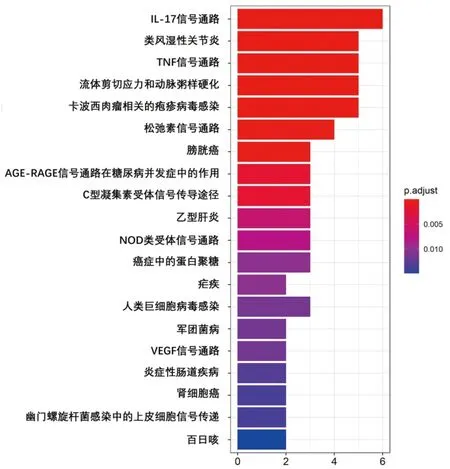
图4 DEGs的KEGG通路富集分析图
2.3 PPI网络和关键模块分析结果 PPI网络共由75个基因相关蛋白的节点和423条蛋白相互关系的连线组成,见图5。基于Cytoscape软件中的degree算法,筛选出PPI网络中degree值排名前10的关键基因,分别是IL-6、转录因子AP-1亚基(transcription factor AP-1 subunit,JUN)、VEGFA、MMP9、PTGS2、MMP1、C-X-C基序趋化因子配体2(C-X-C motif chemokine ligand 2,CXCL2)、双特异性磷酸酶1(dual specificity phosphatase 1,DUSP1)、多配体蛋白聚糖1(syndecan 1,SDC1)、活化转录因子3(activating transcription factor 3,ATF3)。PPI网络的中枢模块(模块1)得分5.8分,包含11个关键基因:SDC1、Toll样受体7(Toll-like receptor 7,TLR7)、Fos样抗原 1(Fos-like antigen 1,FOSL1)、半胱氨酸富集蛋白 61(cysteine-rich protein 61,CYR61)、锌指蛋白36(zinc finger protein 36,ZFP36)、VEGFA 、MMP9、MMP1、TNF配体6B(TNF ligand 6B,TNFSF11)、PTGS2、双糖链蛋白聚糖(biglycan,BGN);次模块(模块2)得分4.4分,包含6个关键基因:JUN、MYC原癌基因、C-X3-C基序趋化因子受体1(C-X3-C motif chemokine receptor 1,CX3CR1)、IL-6、ATF3、CXCL2。见图6。
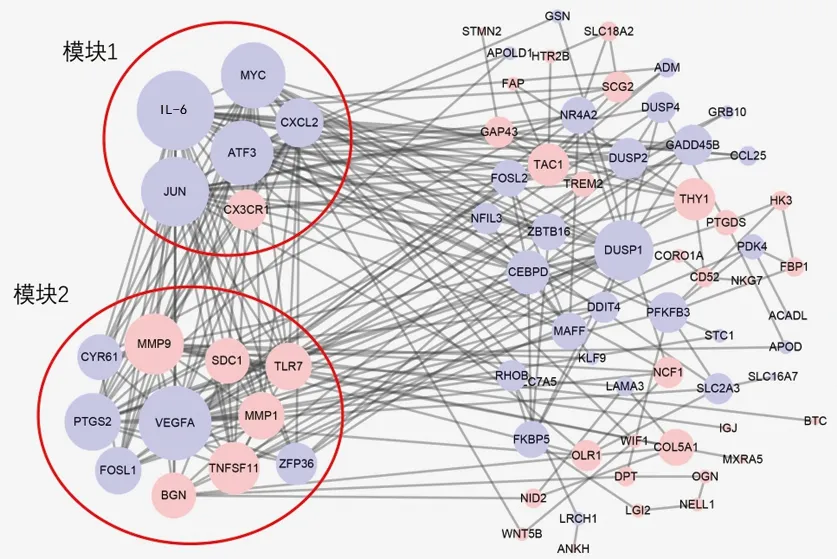
图5 DEGs的PPI网络图

图6 PPI网络中的两个重要模块
2.4 中枢模块的GO功能富集分析与KEGG通路富集分析 对中枢模块进行GO功能富集分析,结果显示,其生物学过程主要富集在细胞外基质结构、凋亡过程的积极调控、免疫应答、对RNA聚合酶Ⅱ启动子的转录的正向调节和对RNA聚合酶Ⅱ启动子的转录的负向调节中;细胞组分主要富集在细胞外基质、细胞表面、细胞外区域、细胞外空间、细胞外泌体、细胞质、浆膜和膜的重要组成部分中;分子功能主要富集在细胞外基质结合、同型的蛋白质结合和蛋白结合力中(见图7)。对中枢模块进行KEGG通路富集分析,结果显示,中枢模块主要富集在IL-17信号通路、类风湿性关节炎、TNF信号通路、流体剪切应力与动脉粥样硬化、卡波西肉瘤相关的疱疹病毒感染等信号通路(见图8)。
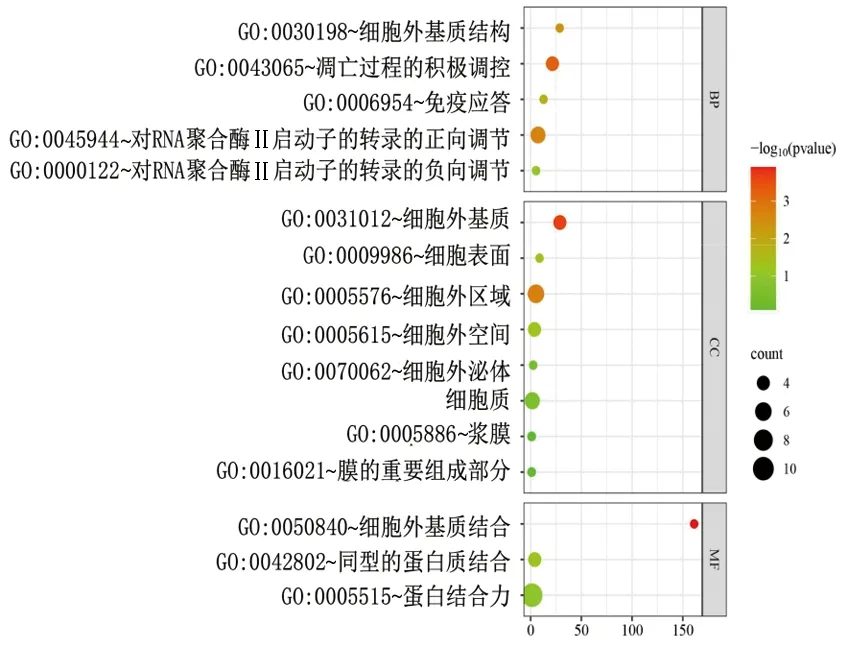
图7 中枢模块的GO功能富集分析结果

图8 中枢模块的KEGG通路富集分析结果
2.5 常用治疗药物和相关靶基因 在DRUGBANK数据库筛选出50种治疗骨关节炎的相关药物,包括塞来昔布、吲哚美辛、曲马多、双氯芬酸、曲安西龙、苏林达克、度洛西汀、玻尿酸、双醋瑞因、甲基泼尼松龙等,在DGIdb数据库中确定以上治疗药物共包含263个靶基因,将其与中枢模块的关键基因取交集得到4个关键基因,即VEGFA、MMP1、MMP9、PTGS2。见图9、图10。
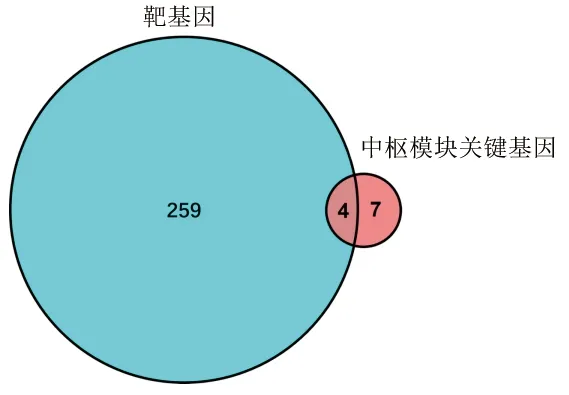
图9 药物靶基因和中枢模块关键基因的韦恩图

图10 骨关节炎常用治疗药物与靶基因的PPI网络
2.6 实时荧光定量PCR验证 为了验证微阵列的结果,使用实时荧光定量PCR检测关键基因在骨关节炎患者和健康人群滑膜组织样本中的表达水平。结果显示,实验组滑膜组织中VEGFA、PTGS2的mRNA表达水平低于对照组,MMP9的mRNA表达水平高于对照组(均P<0.05),而两组滑膜组织中MMP1的mRNA表达水平差异无统计学意义(P>0.05)。见表3。
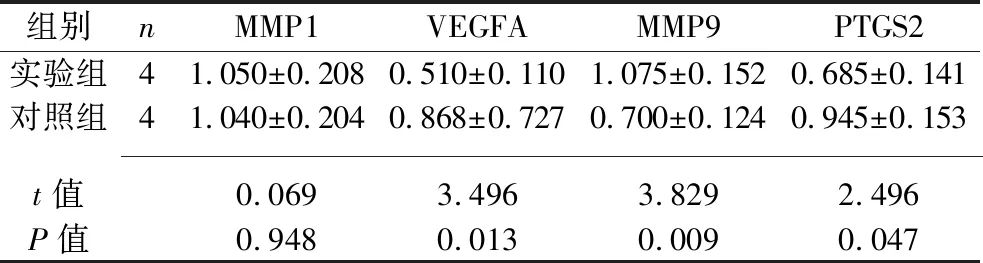
表3 两组滑膜组织MMP1、VEGFA、MMP9、PTGS2的 mRNA相对表达水平的比较(x±s)
3 讨 论
骨关节炎的病理特征包括关节软骨的修复、软骨下骨硬化、骨吸收/重建失衡、骨赘形成和滑膜炎症等[19-20]。研究表明,滑膜炎症从骨关节炎疾病早期就开始参与其发病机制[21]。深入研究基因规律可为骨关节炎的诊治提供新的思路,因此本研究通过生物信息学方法分析治疗骨关节炎患者的滑膜组织相关靶基因。
本研究结果显示,DEGs的生物学过程主要与细胞黏附、免疫反应、凋亡过程的正向调控有关,细胞组分主要富集在细胞外区域、浆膜、细胞外间质等,分子功能主要富集在转录因子活性与特异性序列DNA结合、蛋白质同质化活性等方面;DEGs通过IL-17信号通路、TNF信号通路等信号通路参与骨关节炎滑膜炎症的发展。说明免疫反应、细胞因子和免疫细胞群都参与了骨关节炎的发生和发展,并引起炎症反应和疼痛表现。滑膜炎症是由于单核细胞渗入滑膜后生成一系列促炎症介质(IL-1β、TNF-α和趋化因子)所致[22]。组织损伤和关节破裂导致促炎症介质因子合成增加,使其在滑膜中持续发挥促炎症作用,引起软骨细胞的分化及功能改变,诱导MMP和软骨聚集蛋白聚糖酶的表达与活化,破坏软骨基质稳态,引起关节周围骨重塑,进而导致骨关节炎的发生[23]。Liu等[24]发现,MRI显示的炎症组织学特征与滑膜增厚存在相关性,并进一步证实了滑膜炎症是导致骨关节炎病理改变的重要因素。本研究PPI网络的中枢模块KEGG通路富集分析结果显示,IL-17信号通路、TNF信号通路可能参与骨关节炎的发生与发展。IL-17是具有促炎症作用的细胞因子,主要来源于受刺激的CD4+T淋巴细胞和肥大细胞,其通过血管途径到达滑膜和关节部位[25-26]。IL-17可单独或通过与其他促炎症细胞因子的协同作用破坏细胞外基质的稳态结构[27],刺激成纤维细胞和软骨细胞生成,进一步刺激软骨破坏因子的产生,加速滑膜损伤。研究表明,在患有骨关节炎的小鼠体内注入特异性IL-17受体的DNA适配体,可抑制滑膜中IL-6的表达,使滑膜增厚,导致炎症反应的发生[28],提示调节IL-17信号传导可以预防滑膜炎症的发生。TNF是一种被广泛研究的炎症细胞因子,其可以诱导多种细胞内信号通路,调控细胞存活、细胞凋亡和相关炎症等[29]。研究表明,TNF在骨关节炎软骨组织中呈高表达,并可激活核因子κB信号通路,诱导一氧化氮、环氧合酶2、一氧化氮合酶和前列腺素E2的表达,加重关节的损伤程度,导致软骨细胞的凋亡和滑膜炎症的发生[30-33]。
本研究结果显示,VEGFA、MMP1、MMP9、PTGS2是药物治疗骨关节炎的关键基因靶点;实验组滑膜组织中VEGFA、PTGS2的mRNA表达水平低于对照组,MMP9的mRNA表达水平高于对照组(均P<0.05),而两组滑膜组织中MMP1的mRNA相对表达水平差异无统计学意义(P>0.05)。细胞外基质的一个重要组成部分是由关节囊中的软骨细胞产生的Ⅱ型胶原蛋白,其过度降解会使细胞外基质结构受到破坏进而导致关节损害[34]。MMP是一种参与细胞外基质和基底膜降解的酶,也是平衡关节软骨中细胞外基质合成和降解的重要因子,可促进软骨基质成分(如Ⅱ型胶原蛋白)的降解[35]。Xiao等[36]发现,MMP通过裂解相关靶标(如生长因子、细胞外基质、趋化因子、细胞因子等)以激活与之相关联的信号通路,破坏软骨细胞外基质的合成,进而导致炎症的发生[37]。MMP9是MMP家族中最复杂的成员,主要由促炎症刺激因子(TNF-α、内毒素、IL-1等)诱导产生。研究表明,TNF-α可通过特异性细胞信号通路诱导MMP9的表达,引起慢性炎症[38]。此外,具有MMP9活性的巨噬细胞的表达可以诱导急性炎症反应的发生,骨关节炎患者滑膜组织中的MMP9呈高表达[39]。
前列腺素是花生四烯酸通过环氧合酶(cyclooxygenase,COX)生成,可引起炎性疼痛的脂质介质的代谢物。COX有COX1和COX2两种亚型,分别由PTGS1和PTGS2编码。与构成性表达的PTGS1不同,PTGS2的表达由细胞因子和生长因子诱导,其可激活产生前列腺素E2,促进细胞增殖和血管生成,诱导成骨细胞分化,引起滑膜发炎、软骨变性和疼痛[40]。Tu等[41]发现,COX2的高水平表达能够刺激软骨下骨的异常形成,这可能是导致骨关节炎发生的原因之一。骨关节炎临床治疗中最常用的镇痛药是非甾体类抗炎药。本研究发现,以塞来昔布、吲哚美辛为代表的骨关节炎治疗药物均为COX2抑制剂。研究表明,塞来昔布、吲哚美辛均能通过阻断IL-17信号通路以刺激前列腺素(主要是前列腺素E2)的生成,诱导破骨细胞的分化,从而影响MMP9的表达,两者既是促进骨吸收的有效药物,也是临床上消炎镇痛的实用性药物[42-43]。VEGFA是VEGF家族的主要成员,其被证实参与多种疾病的发生机制。例如有研究发现,VEGF表达水平升高与骨关节炎的进展密切相关,其可促进软骨细胞的增殖分化,参与关节软骨基质的降解,在关节炎症早期产生大量促炎因子,参与关节内软骨退变和疼痛等病变[44-45]。
综上所述,VEGFA、MMP9、PTGS2可能为药物治疗骨关节炎的潜在基因靶点。但本研究样本量较小,且只针对筛选的基因进行实时荧光定量PCR验证,未来还需要进一步研究以证实本研究结论。
