Stathmin、着丝粒蛋白F预测宫颈高级别鳞状上皮内病变患者宫颈LEEP后复发的价值▲
2023-06-25劳芝英黄婉茸吴聪颖
劳芝英 凌 媚 黄婉茸 彭 艳 吴聪颖
(防城港市第一人民医院妇科,广西防城港市 538021)
宫颈鳞状上皮内病变(squamous intraepithelial lesion,SIL)是临床上常见的妇科疾病,是宫颈癌前病变,具有癌变风险[1]。宫颈高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)包括宫颈鳞状上皮内瘤变(cervical intraepithelial neoplasia,CIN)Ⅱ级和Ⅲ级,主要由高危型人乳头瘤病毒(human papilloma virus,HPV)感染后引起。目前临床上治疗宫颈HSIL首选宫颈环形电切术(loop electrosurgical excision procedure,LEEP)。尽管宫颈LEEP创伤小、可保留患者子宫和生育功能,但是术后存在病变残存及复发的风险,因此,了解宫颈HSIL患者宫颈LEEP后复发情况及其影响因素对改善患者预后具有积极意义[2]。着丝粒蛋白F(centromere protein F,CENP-F)可通过与蛋白质相互作用调节细胞的有丝分裂、恶性增殖,在多种恶性肿瘤中呈现高表达。研究显示,CENP-F在宫颈上皮呈现高表达,且其表达水平随着SIL级别的增加而升高,可以反映SIL的严重程度[3]。微管不稳定蛋白Stathmin在细胞质中广泛存在,其可结合多种蛋白调节信号传导通路,参与细胞的增殖、分化等[4]。研究发现,Stathmin蛋白在多种恶性肿瘤中呈高表达,且与肿瘤的预后密切相关[5],Stathmin在SIL患者中也呈现高表达[6],但是其与宫颈HSIL患者宫颈LEEP后复发的关系如何目前鲜见报告。为此,本研究检测宫颈HSIL患者病变组织Stathmin、CENP-F的表达情况,并分析其预测宫颈LEEP后疾病复发的价值,以期为临床评估宫颈HSIL患者行宫颈LEEP后的预后提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2018年1月至2020年1月我院收治的120例行宫颈LEEP治疗的宫颈HSIL患者的临床资料。纳入标准:年龄均≥18岁,女性,有性行为史;经过宫颈组织病理学检查确诊为SIL;病变分级均为宫颈HSIL;进行宫颈LEEP治疗,存档病理组织样本满足检测需求;随访资料及临床资料完整。排除标准:术后被确诊为宫颈癌浸润;有放化疗史;合并其他组织器官恶性肿瘤;有神经系统疾病。患者年龄23~71(41.28±5.98)岁;孕次0~5(2.23±1.00)次;产次0~3(1.19±0.21)次。
1.2 方法
1.2.1 收集患者一般资料:收集患者的年龄、孕次、产次、月经状态、绝经情况、生育情况、手术方式、高风险(high risk,HR)-HPV感染情况、病变分级、切缘状态、病理结果、HPV持续感染情况、腺体是否受累及受累象限等[7]。
1.2.2 检测Stathmin、CENP-F阳性表达情况:采用免疫组化法检测Stathmin、CENP-F阳性表达情况。取宫颈HSIL患者术后组织标本切片放置于含有3% H2O2的去离子水中孵育5 min,PBS冲洗3次。滴加Stathmin抗体(上海沪震生物科技有限公司,批号:20171123)、CENP-F抗体(上海研生实业有限公司,批号:YS170722)至切片上(稀释比均为1 ∶100),于37 ℃孵育2 h,PBS冲洗3次。滴加通用型IgG抗体-表皮生长因子受体多聚体(Imgenex公司,批号:171004),置于37 ℃孵育15 min,PBS冲洗3次。将二氨基联苯胺工作液(中杉金桥公司,批号:20171123)滴加至切片上并于显微镜下显色,用自来水终止显色反应。采用苏木素复染,常规酒精脱水,二甲苯透明,中性树胶固封。阴性对照采用PBS代替一抗,其余步骤与上述相同。阳性对照采用已有的阳性切片。(1)Stathmin结果判定。Stathmin定位于细胞质,胞质为棕黄色、棕褐色、淡黄色表示染色阳性。在200倍光学显微镜下随机选择10个视野观察细胞着色情况,采用双评分半定量法判断阳性细胞百分率和阳性细胞的染色深度。阳性细胞百分率评分如下,>75%细胞着色为4分,51%~75%细胞着色为3分,26%~50%细胞着色为2分,5%~25%细胞着色为1分,<5%细胞着色为0分。染色深度评分如下,棕黄色为3分,棕褐色为2分,淡黄色为1分,未见染色为0分。将阳性细胞百分率评分和阳性细胞染色深度评分之和作为最终评分,评分范围0~7分,评分≥2分为Stathmin阳性表达,评分<2分为Stathmin阴性表达。(2)CENP-F结果判定。CENP-F定位于细胞核,细胞核见棕色、棕黄色、淡黄色颗粒记为阳性。根据染色的程度和强度两方面进行评估,染色程度即阳性细胞百分率评分如下,>50%细胞着色为4分,26%~50%细胞着色为3分,11%~25%细胞着色为2分,1%~10%细胞着色为1分,无细胞着色为0分;染色强度评分如下,棕色颗粒为3分,棕黄色颗粒为2分,淡黄色颗粒为1分,无染色为0分。将染色程度和染色强度评分之和作为CENP-F总评分,评分范围0~7分,评分≥3分表示CENP-F阳性表达,<3分表示CENP-F阴性表达。
1.2.3 随访及观察指标:术后随访时间24~33个月,宫颈HSIL患者分别于术后3、6、12、24个月复查,包括HPV感染情况及薄层液基细胞学检查(thinprep cytologic test,TCT)。若患者随访期间复查CT异常,且宫颈活检结果显示SIL则为复发。若患者术前HR-HPV结果为阳性,且术后6个月的复查结果仍显示HPV阳性,则表示HPV持续感染。
1.3 统计学分析 采用SPSS 22.0软件进行统计学分析。计数资料以例数和百分比表示,比较采用χ2检验;符合正态分布的计量资料以(x±s)表示,比较采用两独立样本t检验;等级资料比较采用秩和检验。采用多因素COX回归模型分析确定宫颈LEEP后复发的危险因素;采用Pearson检验进行相关性分析;采用受试者工作特征(receiver operating characteristic,ROC)曲线分析Stathmin和CENP-F对宫颈LEEP后复发的预测价值。以P<0.05为差异具有统计学意义。
2 结 果
2.1 宫颈HSIL患者术后复发情况 120例宫颈HSIL患者的随访时间为24~33个月,中位随访时间为24个月。随访期间共有25例患者复发,复发率为20.83%。根据随访期间患者的复发情况,将患者分为复发组25例和未复发组95例。
2.2 复发组与未复发组患者术后Stathmin、CENP-F表达情况的比较 复发组患者Stathmin和CENP-F阳性表达率均高于未复发组(均P<0.05)。见表1。
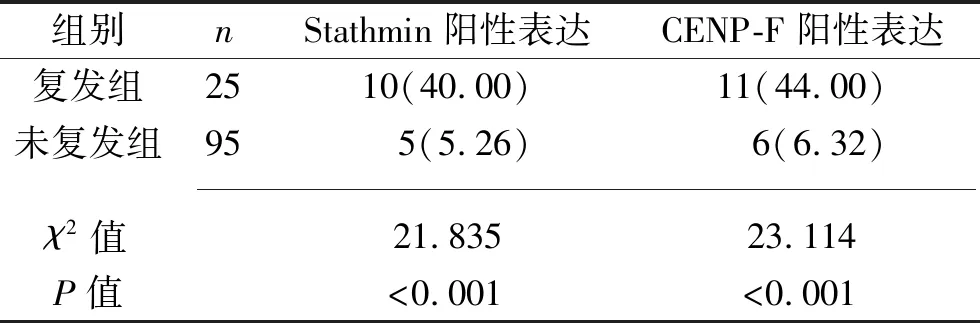
表1 复发组与未复发组患者术后Stathmin、CENP-F表达情况的比较[n(%)]
2.3 宫颈HSIL患者术后复发影响因素的单因素分析 复发组和未复发组宫颈HSIL患者的年龄、月经状态、绝经状态和孕次比较,差异均无统计学意义(均P>0.05);复发组和未复发组患者的产次、切缘状态、病理结果、HR-HPV种类数、腺体受累情况、受累象限个数、HPV持续感染情况、Stathmin表达情况和CENP-F表达情况比较,差异均具有统计学意义(均P<0.05)。见表2。
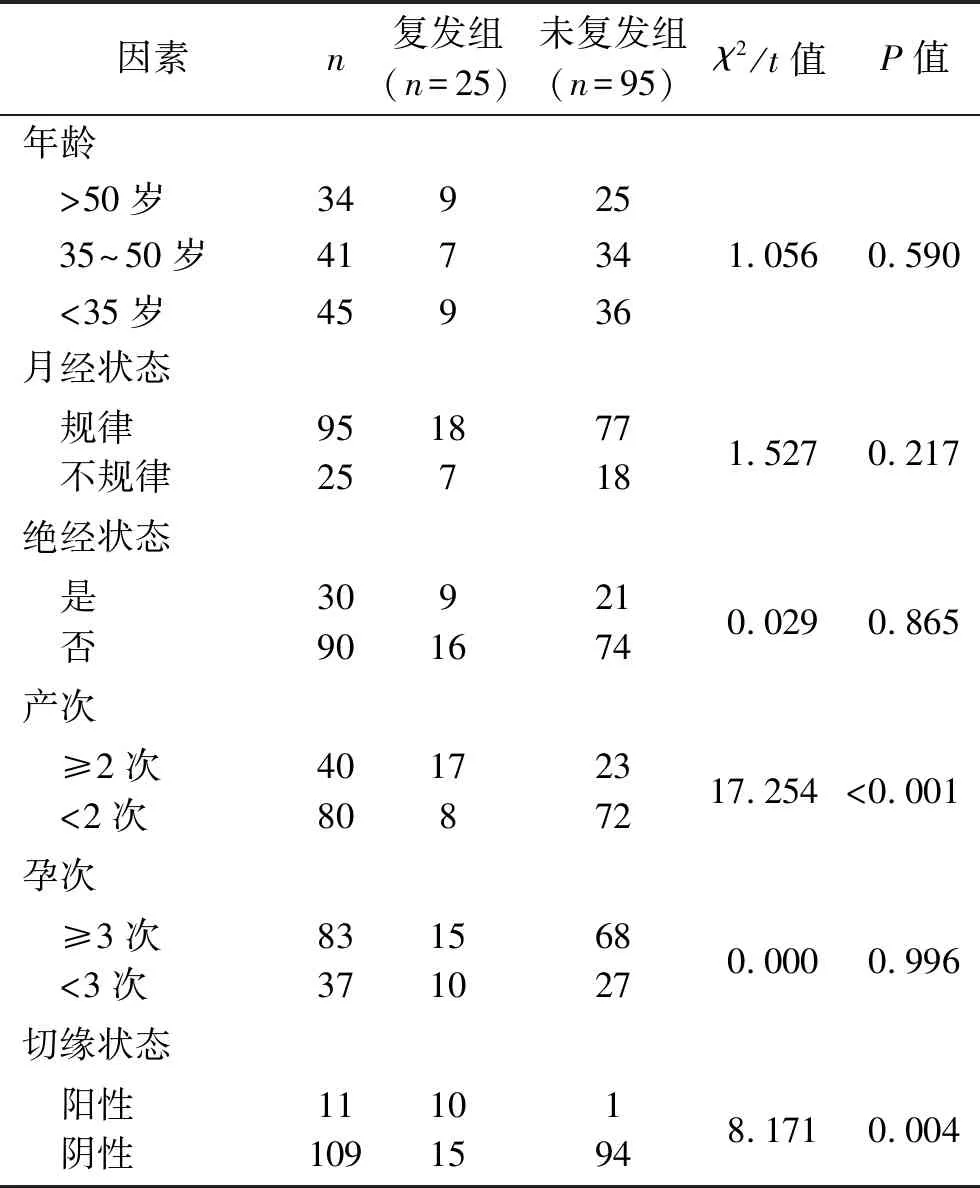
表2 单因素分析结果(n)
2.4 宫颈HSIL患者术后复发影响因素的多因素分析 以宫颈HSIL患者术后是否复发为因变量,以单因素分析中差异具有统计学意义的因素作为自变量(变量赋值情况见表3),纳入多因素COX回归模型进行分析。结果显示,切缘阳性、HR-HPV种类数≥2种、腺体受累、受累象限>3个、HPV持续感染、Stathmin阳性表达及CENP-F阳性表达均是宫颈HSIL患者宫颈LEEP后复发的危险因素(均P<0.05)。见表4。

表3 赋值情况
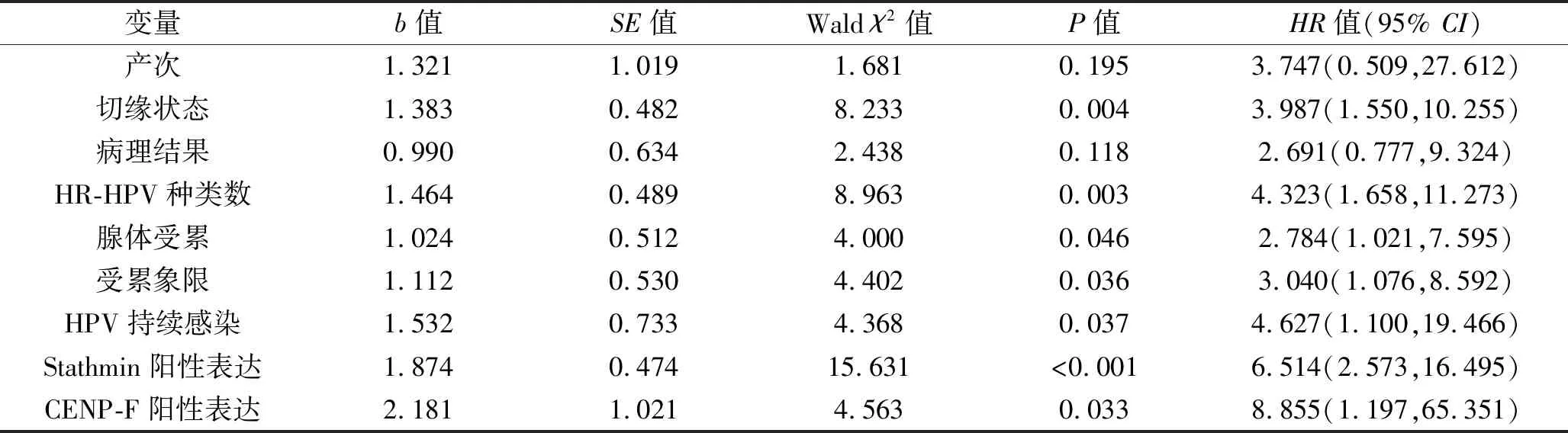
表4 多因素COX回归分析结果
2.5 Stathmin和CENP-F相关性分析 相关分析结果显示,Stathmin评分与CENP-F评分呈正相关(r=0.673,P<0.05)。
2.6 Stathmin评分和CENP-F评分对宫颈HSIL患者宫颈LEEP后复发的预测价值 ROC曲线分析结果显示,Stathmin评分预测宫颈HSIL患者宫颈LEEP后复发的曲线下面积为0.843(95%CI:0.766,0.885;P<0.001), CENP-F评分预测宫颈HSIL患者宫颈LEEP后复发的曲线下面积为0.865(95%CI:0.822,0.900;P<0.001);约登指数取最大值时,Stathmin评分和CENP-F评分的最佳截断值分别为2.01分和3.03分, Stathmin评分预测复发的灵敏度和特异度分别为73.28%和62.49%,CENP-F评分预测复发的灵敏度和特异度分别为75.32%和64.18%。见图1。
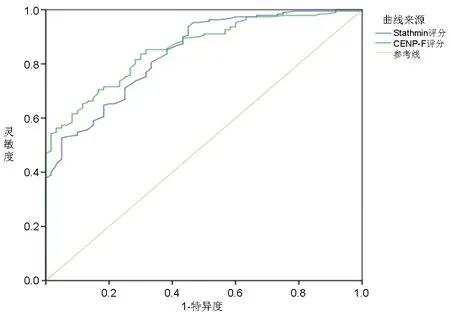
图1 Stathmin评分和CENP-F评分预测宫颈HSIL患者宫颈LEEP后复发的ROC曲线
3 讨 论
近年来,SIL发病率有上升趋势,且发病呈年轻化,有发展成宫颈癌的风险,积极治疗可以降低癌变的风险[8]。宫颈LEEP是目前临床上治疗宫颈HSIL的首选疗法,操作简单,对患者的创伤较小,有助于患者术后康复,且可以保留患者的子宫和生育功能,但由于手术过程中病变组织不易完全切除,因此术后仍然存在复发的风险[9]。有研究显示,宫颈HSIL患者宫颈LEEP后,病灶残留/复发率可达3%~47%[10]。本研究结果显示,宫颈LEEP后随访期间患者的复发率为20.83%,与既往研究结果相似。
Stathmin又称原癌基因蛋白 18,广泛存在于细胞质中,可以调节细胞增殖、分化等。Stathmin的组成包括中心区、蛋白相互作用结构域(C端)和结构调节域(N端),也属于微管相关蛋白,对微管的解聚有一定的调节作用,因此又被称为微管不稳定蛋白。此外,Stathmin还可以与多种蛋白调节信号传导通路结合,对细胞的增殖和分化进行调节[11]。研究显示,Stathmin在食管鳞癌、喉部鳞状细胞癌、胃癌等多种肿瘤中都呈现高表达[12]。CENP-F主要分布于细胞核内的细胞着丝粒区,参与细胞着丝粒的构成,其在细胞G2/M期呈现高表达,而在细胞分裂的末期被快速水解,CENP-F在细胞周期中的特异性表达可以调节细胞周期,影响细胞增殖,同时,CENP-F还可以通过结合Rb蛋白影响细胞增殖,在多种恶性肿瘤中也呈现高表达[13]。本研究结果显示,复发组患者Stathmin阳性表达率、CENP-F阳性表达率均高于未复发组,且相关分析结果显示,Stathmin评分与CENP-F评分呈正相关(均P<0.05)。提示Stathmin与CENP-F之间可能存在调控机制,它们的阳性表达情况或许是宫颈HSIL患者宫颈LEEP后复发的影响因素。
为进一步了解宫颈HSIL患者宫颈LEEP后复发的影响因素,本研究对可能的影响因素进行多因素分析。结果显示,切缘阳性、HPV持续感染、HR-HPV种类数≥2种、腺体受累、受累象限>3个、Stathmin阳性表达及CENP-F阳性表达均是宫颈HSIL患者宫颈LEEP后复发的危险因素(均P<0.05)。分析原因如下:(1)由于病灶范围较难确定,宫颈LEEP后可能会存在一定的切缘阳性,而切缘阳性患者病变组织残留较多,导致HR-HPV呈现持续感染状态,而术后HR-HPV持续感染可增加癌变的风险,因而患者的复发率较高[14]。有研究显示,HR-HPV种类在SIL的筛查和诊疗中有重要作用,且种类越多的患者宫颈LEEP后复发的风险越高[15],多重HR-HPV感染可能是SIL患者术后复发的危险因素[16]。(2)宫颈管腺体内一般会存在非典型增生,但其可能被正常的细胞遮挡而无法被LEEP有效清除,且其难以在常规的细胞学检查和阴道镜检查中发现,导致患者术后复发风险增加,且容易发展成浸润癌[17]。(3)病变受累象限较多的患者完全切除难度较大,复发风险升高。(4)Stathmin蛋白高表达时,微管的生长受到抑制,从而抑制微管多聚化,致使微管结构不稳定而解聚,这为肿瘤细胞侵袭和转移创造了有利环境。而CENP-F过表达能够使细胞有丝分裂中着丝点聚集,导致染色体分离障碍,使得细胞染色体倍数异常,加之宫颈癌周围微环境已经改变,在CENP-F影响下,肿瘤复发的风险增加。有研究发现,患者的年龄、月经紊乱或绝经、孕次、产次等也是宫颈HSIL患者宫颈LEEP后复发的影响因素[18-19],与本研究结果不完全相符,原因可能是本研究的样本量较小,相关结果还有待加大样本量进一步研究验证。
CENP-F主要分布于宫颈鳞状上皮的副基底层和基底层,其表达水平随SIL级别的增加而升高,且逐步向表层和中层蔓延,可作为预测宫颈HSIL预后的有效分子标志物[20]。有研究显示,抑制CENP-F的过表达可以抑制癌细胞的转移和浸润,抑制Stathmin过表达也可以抑制肿瘤细胞的增殖和迁移,延缓肿瘤的进展[21]。本研究结果显示,Stathmin评分、CENP-F评分预测宫颈HSIL患者宫颈LEEP后复发的曲线下面积分别为0.843、 0.865,且当Stathmin评分和CENP-F评分分别为2.01分和3.03分时,其预测宫颈HSIL患者宫颈LEEP后复发的灵敏度分别为73.28%和75.32%,特异度分别为62.49%和64.18%。提示Stathmin评分、CENP-F评分可用于评估宫颈LEEP后的预后。
综上所述,与宫颈HSIL患者宫颈LEEP后未复发者相比,复发者Stathmin阳性表达率、CENP-F阳性表达率升高,Stathmin阳性表达、CENP-F阳性表达是宫颈HSIL患者宫颈LEEP后复发的影响因素,二者可作为评估宫颈HSIL患者宫颈LEEP后预后的指标。
