复发性阿弗他口腔溃疡患者唾液外泌体miR-142-5p、FOXO3表达的相关性研究
2023-06-25童远武董方李艳莉肖莹
童远武,董方,李艳莉,肖莹
复发性阿弗他口腔溃疡(recurrent aphthous ulcer,RAU)是与体液免疫有密切关系的口腔黏膜破损疾病,主要表现为口腔局部黏膜变红、肿胀、发热、疼痛,多可自愈,但反复出现,影响患者进食、言语等[1-2]。各种因素(局部损伤、炎性反应、营养不良、B族维生素缺乏等)导致的免疫功能损伤可引发该病,因此从免疫学角度分析RAU的相关致病因子有助于该疾病的预防与治疗[3-7]。唾液腺外泌体是指存在于唾液中的直径30~50 μm的细胞外囊泡,唾液外泌体可作为治疗的药物载体,唾液外泌体miRNA可作为潜在的口腔疾病标志物[8-9]。已有研究证明[6],唾液外泌体miR-142-5p可介导获得性中耳脂瘤的炎性免疫调节。叉头转录蛋白O亚族3(FOXO3)在溃疡性结肠炎中占据重要地位[5]。基于miR-142-5p、FOXO3在免疫功能中发挥的不同作用,猜测二者可能在RAU患者中同样发挥作用。因此,本研究通过检测RAU唾液外泌体miR-142-5p、FOXO3表达水平,并分析其与患者免疫功能的关系,以期为RAU的预防和治疗提供新的理论依据,报道如下。
1 资料与方法
1.1 临床资料 收集2019年12月—2021年12月三亚中心医院/海南省第三人民医院口腔科收治复发性阿弗他口腔溃疡患者134例作为研究对象(观察组), 其中男50例,女84例,年龄18~62(44.37± 5.27)岁。另选取同期健康志愿者134例作为健康对照组,男50例,女84例,年龄18~63(44.62±5.48)岁。2组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准(20191103),受试者及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:符合复发性口腔溃疡诊断标准[10];患者均配合取样、治疗、研究;患者6个月内每2个月均复发超过1次,且患者就诊时处于溃疡期。(2)排除标准:存在显著的心、肝、肺等器质性改变;红斑狼疮等自身免疫性疾病,近1个月内使用过免疫抑制剂;就诊时溃疡发作超过3 d;妊娠期、哺乳期女性。
1.3 观测指标与方法
1.3.1 qPCR检测miR-142-5p、FOXO3 mRNA水平:研究对象漱口后收集唾液标本(舌顶上颚,唾液流入收集盒),唾液离心去除细胞等杂质,通过唾液外泌体试剂盒提取唾液外泌体(Norgen Biotek),低温保存。提取唾液外泌体总RNA(TRIzol试剂),将适量RNA逆转录为cDNA[miRcute miRNA cDNA 第一链合成试剂盒购自天根生化科技(北京)有限公司],使用miRcute miRNA荧光定量检测试剂盒[天根生化科技(北京)有限公司]配置qPCR反应体系,使用罗氏LightCycler480 Ⅱ实时荧光定量PCR系统(Roche,型号:LightCycler480 Ⅱ)进行qPCR反应,反应条件:95℃预处理2 min、95℃ 10 s、55℃ 15 s、72℃ 10 s,共40次循环。引物序列见表1。采用2-△△CT法定量miR-142-5p、FOXO3 mRNA水平,U6、GAPDH分别作为内参。
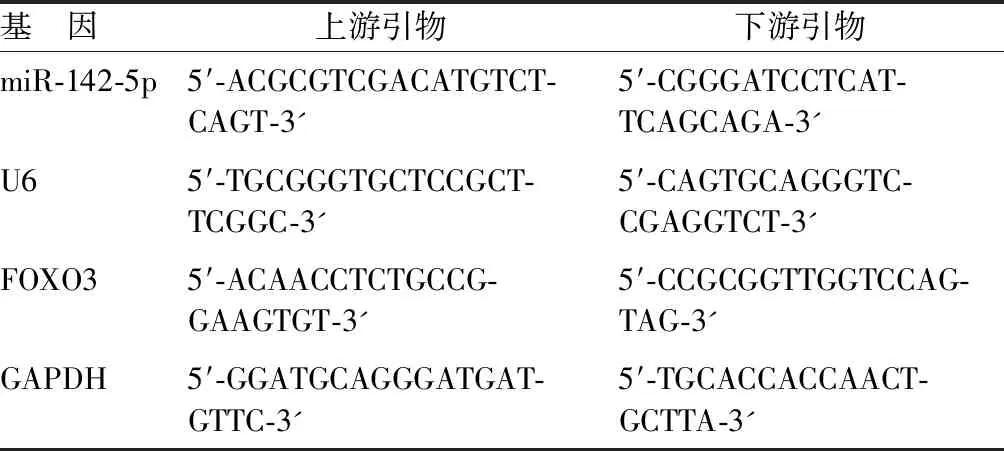
表1 qRT-PCR引物序列
1.3.2 Western-blot检测唾液外泌体中FOXO3蛋白表达水平:提取唾液外泌体样本中总蛋白,BCA试剂盒测量蛋白质浓度,行SDS凝胶电泳(LabYeah电泳仪,上海百赛生物公司),转膜后封闭。添加一抗[FOXO3(abcam公司)1∶1 000、GAPDH(内参),1∶5 000]孵育过夜清洗后加入山羊抗兔二抗(1∶5 000)。清洗3次后,使用Axygen凝胶成像系统(广州科适特科学仪器公司)测定蛋白条带灰度值,Image J分析蛋白质灰度值。
1.3.3 流式细胞术检测CD3+CD4+、CD3+CD8+细胞比例:晨起收集受试者空腹肘静脉血10 ml于抗凝离心管中,离心后弃上清,-80℃保存待测。取上述抗凝血100 μl,加入相应CD3-CY5、CD4-FITC、CD8-PE荧光标记抗体各20 μl,避光孵育30 min,加入溶血素,混匀后离心,清洗2次后弃上清,PBS悬浮细胞,流式细胞仪(美国艾森公司,型号:NOVOCYTE3130)检测CD3+CD4+、CD3+CD8+细胞比例,并计算CD4+/CD8+比值。
1.3.4 疼痛评分、溃疡面积评定:采用视觉模拟量表(VAS)[10]评定疼痛指数,总分10分,评分越高,疼痛越重。镜下用标尺测量患者溃疡最大直径和垂直直径(与最大直径垂直),计算溃疡面积(mm2)=最大直径×垂直直径。
2 结 果
2.1 2组miR-142-5p、FOXO3 mRNA水平比较 与健康对照组比较,观察组患者唾液外泌体miR-142-5p水平升高(P<0.01),FOXO3 mRNA、蛋白水平降低(P<0.01),见表2、图1。

图1 健康对照组与观察组唾液外泌体FOXO3蛋白水平比较

表2 健康对照组与观察组唾液外泌体miR-142-5p、FOXO3 mRNA水平比较
2.2 2组免疫指标比较 与健康对照组比较,观察组患者外周血CD3+CD4+、CD4+/CD8+细胞比值下降(P<0.01),外周血CD3+CD8+细胞比例升高(P<0.01),见表3。

表3 健康对照组与观察组外周血免疫指标水平比较
2.3 观察组患者不同亚组间疼痛指数、溃疡面积比较 将观察组患者唾液外泌体miR-142-5p、FOXO3 mRNA分别按照均数2.35、0.35分组,miR-142-5p≥2.35为高表达亚组82例,<2.35为低表达亚组52例;FOXO3≥0.35为高表达亚组55例,<0.35为低表达亚组79例。与miR-142-5p低表达亚组比较,miR-142-5p高表达亚组患者疼痛指数升高、溃疡面积增大(P<0.01)。与FOXO3高表达亚组比较,FOXO3低表达亚组患者疼痛指数、溃疡面积升高(P<0.01),见表4。

表4 不同 miR-142-5p、FOXO3 mRNA水平患者疼痛指数、溃疡面积比较
2.4 唾液外泌体miR-142-5p、FOXO3 mRNA与免疫指标相关性分析 观察组患者唾液外泌体miR-142-5p与CD3+CD4+、CD4+/CD8+细胞比值均呈负相关(P均<0.01),FOXO3 mRNA与CD3+CD4+、CD4+/CD8+细胞比值均呈正相关(P均<0.01),患者miR-142-5p、FOXO3与CD3+CD8+细胞比例均无相关性(P>0.05),而miR-142-5p与FOXO3呈负相关(r=-0.368,P<0.001),见表5。
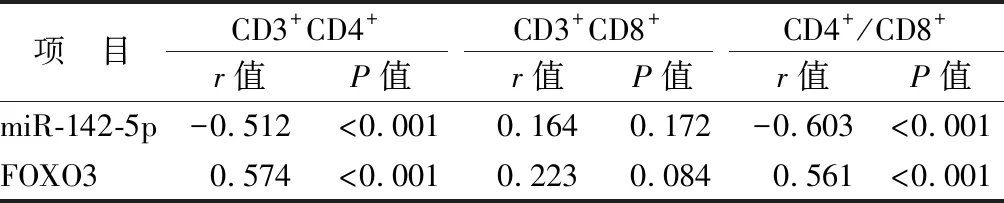
表5 复发性阿弗他口腔溃疡患者唾液外泌体miR-142-5p、FOXO3 mRNA与CD3+CD4+、CD3+CD8+、CD4+/CD8+的相关性
2.5 miR-142-5p、FOXO3 mRNA表达水平预测RAU复发的价值 绘制ROC曲线,并计算曲线下面积(AUC),结果显示,miR-142-5p、FOXO3 mRNA及二者联合预测RAU复发的AUC分别为 0.810、0.809、0.947,二者联合检测优于各自单独预测效能(Z=6.528、8.573,P均<0.001),见表6、图2。
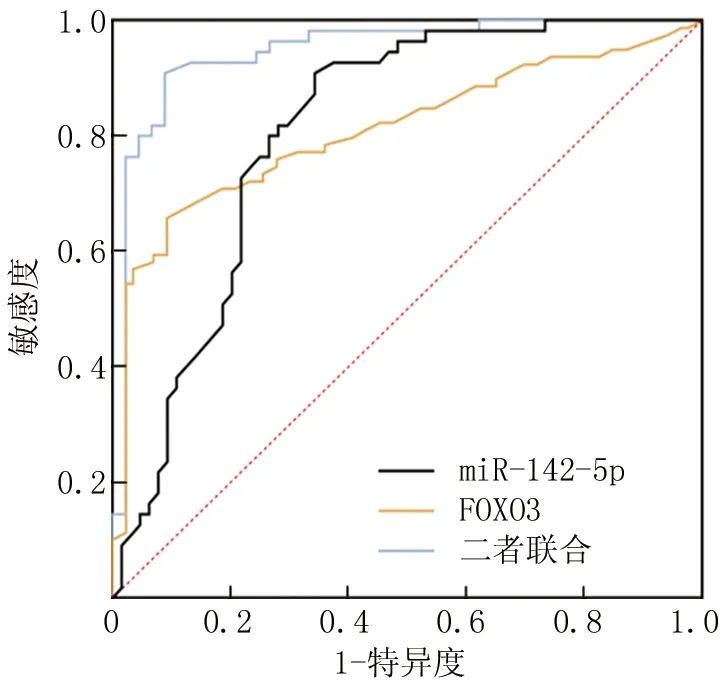
图2 miR-142-5p、FOXO3 mRNA表达水平预测RAU复发的ROC曲线

表6 miR-142-5p、FOXO3 mRNA表达水平预测RAU复发的价值比较
3 讨 论
RAU主要是以口腔黏膜反复破损为表现的深层次溃疡,临床上分为轻型溃疡、腺周口创和疱疹样溃疡[1]。根据最新统计资料显示,全球有25%的人曾经发生过口腔溃疡[2]。RAU的诱发因素具有复杂性和多样性特点,其中研究发现机体免疫反应在复发性口腔溃疡的发病机制中占据重要地位[3]。研究表明[3-4],在复发性口腔溃疡病理组织中,促炎性细胞因子IL-2、IL-12、TNF-α和IFN-γ处于高表达,同时炎性因子抑制剂TGF-β和IL-10低表达,说明炎性因子的分泌失衡是造成此疾病的诱发因素之一;研究显示,CD4+细胞与复发性口腔溃疡的发病具有密切相关性[4];另有研究提示,溃疡前期、溃疡发作期与间歇期T淋巴细胞亚群均有显著变化,介导患者的免疫应答,最终导致口腔黏膜的持续炎性反应[6];在人体遇刺激引发免疫损伤时,机体内CD4+细胞比例下降,而CD8+占比升高,CD4+/CD8+比值降低,两者的比值可显示患者免疫力损伤严重程度[3]。因此,早期发现患者体液中异常的免疫反应,成为及时干预和早期治疗RAU的关键。
目前,针对口腔类疾病诊断的方法越来越多,如液基细胞学检测、组织病理学检测等,但是上述诊断方式的有创性,常会引起患者和家属的排斥。唾液是口腔疾病辅助性诊断体液,留取样本方便,唾液的蛋白质组学、基因组学研究提高了口腔疾病的诊断水平,因此通过无创或微创采集患者唾液标本进行相关检测和诊断,成为目前临床诊疗中最常用的方式。唾液中的外泌体不仅可以作为治疗的药物载体,同时唾液外泌体miRNA可作为潜在的口腔疾病标志物[8-9],通过检测唾液外泌体的差异性寻找疾病发生、发展的内在机制已成为学术界新的热点。基于以上观点,本研究以唾液外泌体标本中差异性表达的miRNAs为切入点,聚焦外泌体miR-142-5p和FOXO3的表达与RAU患者体液免疫之间的相关性。既往类似研究发现,在癌症、免疫相关疾病患者的活检组织中miR-142-5p呈过度表达[11-13]。Han等[14]研究显示,miR-142-5p在排斥反应免疫应答中上调。李媛等[8]研究显示,miR-142-5p可在体外直接影响CD4+T细胞亚群Th17细胞发育,促进IL-17的产生,大鼠组织炎性因子水平升高,促进自身免疫性葡萄膜炎进展。本研究结果显示,RAU患者中唾液外泌体miR-142-5p水平显著高于健康对照组人群,这与以上研究结果一致,因此从侧面证实了miR-142-5p正向参与患者细胞免疫的调控。
FOXO3属于FOXO家族,同样在机体的免疫应答中发挥重要作用,在FOXO3缺乏的T细胞中,Th17细胞比例明显上调[15]。闵敏[16]研究显示,FOXO3在溃疡性结肠炎中可被miR-155下调,调节IL-8参与溃疡性结肠炎结肠黏膜炎性反应的发展。而溃疡性结肠炎属于非特异性炎性疾病,易反复发作,可能与免疫功能失常有关,这与复发性口腔溃疡有部分病因、发病机制重合,且复发性口腔溃疡发生几率高于溃疡性结肠炎。本试验研究结果显示,RAU唾液外泌体中FOXO3 mRNA与蛋白表达水平显著低于健康对照组,与CD3+CD4+、CD4+/CD8+细胞比值呈正相关,说明FOXO3负向参与RAU中机体的免疫反应,笔者查阅以往的生物信息学分析结果发现[8,17-20],FOXO3是miR-142-5p的靶基因,两者存在结合位点,miR-142-5p可调控FOXO3参与自身免疫性葡萄膜炎的发展。本试验结果提示,RAU患者免疫调节中miR-142-5p过表达,但FOXO3表达显著降低,因此提示在RAU患者中miR-142-5p过表达可达抑制FOXO3的表达,唾液外泌体miR-142-5p和FOXO3存在负相关调控,两者共同参与RAU免疫失常,但其具体调控机制仍需进一步试验得出相关数据。
本试验还研究了miR-142-5p、FOXO3 mRNA表达水平与患者疼痛指数、溃疡面积的影响,结果显示,当miR-142-5p表达高于平均值时,患者的疼痛加剧,且溃疡的面积明显增大;当FOXO3处于低表达时,会出现相同的表现,这从侧面表明miR-142-5p与FOXO3共同参与了RAU的免疫失常,并与其表达量成一定的关系,本试验并未进行相关深入研究,未来会进行相关性定量分析。
综上所述,复发性阿弗他口腔溃疡患者唾液外泌体miR-142-5p/FOXO3分子作用靶点共同参与对RAU的免疫调控,其中miR-142-5p为正向调控,FOXO3为负向调控,同时关于两者的表达定量对RAU患者的影响需要进一步深入研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
童远武:设计研究方案,实施研究过程,论文撰写,论文审核;董芳、李艳莉:分析试验数据,论文审核;肖莹:资料搜集整理,分析试验数据,论文修改
