老年急性髓系白血病患者临床特征与预后分析*
2023-06-23令狐顺唐晓琼张红宾罗小华陈建斌杨泽松
令狐顺,肖 青,王 欣,唐晓琼,张红宾,罗小华,刘 林,陈建斌,杨泽松,王 利
(重庆医科大学附属第一医院,重庆 400016)
急性髓系白血病(AML)是造血干/ 祖细胞的恶性克隆性疾病,发病时骨髓中异常的原始细胞及幼稚细胞(白血病细胞)大量增殖并抑制正常造血,可广泛浸润肝、脾、淋巴结等各种脏器,其发病率及预后与患者的年龄直接相关。近年来的研究发现,肾母细胞瘤基因1(WT1)、FMS 样酪氨酸激酶3 基因(FLT3)、核磷蛋白1 基因(NPM1)等发生基因突变对AML 预后具有重要意义[1-2]。随着人口老龄化速度的加快,老年AML 的发生率逐渐上升,且老年患者机体状况差、基础疾病多,对化学药物治疗(简称化疗)的耐受性差,生存期明显缩短[3-4]。本研究中选取了医院收治的部分老年AML 患者,分析其基因突变特点,并探讨影响其预后的因素,从而促进临床合理诊疗。现报道如下。
1 对象与方法
1.1 研究对象
纳入医院血液科2015 年1 月至2020 年12 月收治的参照世界卫生组织(WHO)髓系肿瘤和急性髓系白血病诊断标准确诊的AML[5]患者183 例,患者年龄≥60 岁,已排除急性早幼粒细胞白血病患者。本研究经医院医学伦理委员会批准(审批号2022-K489)。
1.2 方法
诱导治疗:86例患者接受化疗,其中63例进行疗效评估。按诱导化疗方案的不同分为标准化疗组(12 例)和低强度化疗组(74 例)。标准化疗组患者予标准剂量阿糖胞苷联合去甲氧柔红霉素或柔红霉素;低强度化疗组患者予基于去甲基化药物的方案,包括去甲基化药物单用或与其他药物联用,如地西他滨单药、维奈克拉联合阿扎胞苷或地西他滨、阿扎胞苷或地西他滨联合小剂量化疗等。完全缓解(CR)后给予巩固化疗,采用原诱导方案或其他多种复合方案治疗。
基因突变检测:采用实时荧光定量聚合酶链式反应法检测患者骨髓样本中的BCR-ABL,AML1-ETO,CBFβ-MYH11,MLL等43 种融合基因及WT1基因;采用DNA 测序技术检测NPM1,FLT3,DNMT3A等基因的突变情况。
1.3 观察指标与疗效判定标准
观察指标:1)总生存期(OS)。通过门诊、住院电子病历对患者随访至2021年6月1日。其间死亡或失访患者计为自诊断之日起至(任何原因)引起死亡的时间或末次随访时间(失访时间)。2)中位生存期(MST)。累积总生存率为50%时所对应的生存时间。3)复发情况。CR后在外周血重新出现白血病细胞或骨髓原始细胞比例>5%视为复发。
疗效判定:CR,白血病症状和体征消失,外周血无原始细胞,无髓外白血病;骨髓三系造血恢复,骨髓原始细胞比例< 5%;外周血中性粒细胞> 1.0 × 109/ L,血小板计数≥100 × 109/ L。部分缓解(PR),骨髓原始细胞比例5%~20%,或临床、血常规指标中有1 项未达CR。未缓解(NR),骨髓、外周血及临床指标均未达到上述标准[6]。客观缓解(OR)=CR+PR。
1.4 统计学处理
采用SPSS 26.0 统计学软件分析。计量资料以中位数或X±s表示,行非参数检验;计数资料以率(%)表示,行χ2检验,当理论频数小于1 时,采用Fisher 确切概率法。生存分析采用Kaplan - Meier 法,组间生存率比较采用Log - Rank 检验,采用COX 比例风险模型进行总生存期的多因素分析。P< 0.05 为差异有统计学意义。
2 结果
2.1 患者临床特征
患者临床特征见表1。AML 分型[5]以M2,M5,M4,M1 型多见,分别占26.23%,24.59%,13.66%,6.56%。有14 例(7.65%)患者为继发性AML,其中骨髓增生异常综合征转化者9例,慢性粒-单核细胞白血病转化者2 例,骨髓纤维化转化者3 例。49 例患者有初诊细胞遗传学资料,其中染色体无可分析分裂相3 例(6.12%),正常核型29 例(59.18%),异常核型17 例(34.69%);遗传学预后分层[7]良好、中等、不良分别为5例(10.20%)、35例(71.43%)、6例(12.24%)。
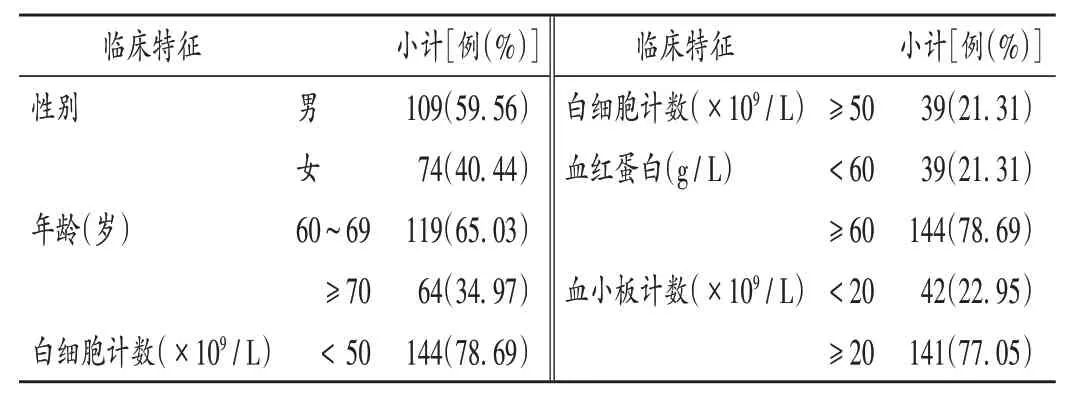
表1 183例老年AML患者临床特征Tab.1 Clinical characteristics of 183 elderly patients with AML
2.2 基因突变分布情况
有133 例患者行基因突变检测,共检测到23 个AML相关基因(图1,其中1列仅1例患者),基因突变数为每例0~7 个(中位数为1 个),平均基因突变率为每例1.62 个。其中118 例(88.72%)至少携带1 个突变基因;62例(46.62%)呈多基因突变(≥2个)。0,1,2,≥3个基因突变的发生率分别为11.28%(15/ 133)、42.11%(56/ 133)、25.56%(34/ 133)、21.05%(28/ 133)。WT1是最常见的突变基因(60.90%),其他突变频率>5%的基因依次为NPM1(22.56%)、IDH2(12.78%)、DNMT3A(10.53%)、FLT3-ITD(9.77%)、IDH1(7.52%)、AML1-ETO(7.52%)。

图1 133例老年AML患者的基因突变分布情况Fig.1 Distribution of gene mutations in 133 elderly patients with AML
2.3 基因共存突变情况及预后分析
46.62 %的患者存在基因共存突变,WT1主要的共存突变基因为NPM1(22 例、16.54%),IDH2(12 例、9.02%),FLT3-ITD(11 例、8.27%),DNMT3A(10 例、7.52%);NPM1主要的共存突变基因为IDH2(6 例、4.51%),FLT3-ITD(6 例、4.51%),DNMT3A(5 例、3.76%),IDH1(4 例、3.01%)。详见图2(弧形的长度表示对应该基因突变的频率,条带的宽度表示2个基因共同突变的频率)。

图2 老年AML患者的基因共存突变弦图Fig.2 Chord diagram of gene co - existing mutations in elderly patients with AML
WT1合并NPM1突变的患者MST(27 个月)显著长于WT1合并FLT3-ITD(MST 为11 个月)、DNMT3A(MST 为6 个月)突变的患者(P<0.05),详见图3。提示老年AML 患者存在WT1突变时,合并FLT3-ITD突变或DNMT3A突变预后不良。

图3 常见共存突变基因对老年AML患者总生存期的影响A.WT1+NPM1 and WT1+IDH2 B.WT1+NPM1 and WT1+FLT3-ITD C.WT1+NPM1 and WT1+DNMT3A D.WT1+IDH2 and WT1+FLT3-ITD E.WT1+IDH2 and WT1+DNMT3A F.WT1+DNMT3A and WT1+FLT3-ITDFig.3 Effect of common co - existing mutant genes on the OS in elderly patients with AML
2.4 基因突变个数与部分临床参数及初次诱导CR率的关系及预后分析
1 个、2 个、≥3 个基因突变且接受诱导化疗的患者基因突变个数与部分临床参数、初次诱导CR 的关系见表2。随着基因突变个数的增加,患者的OS 呈下降趋势,且≥4 个基因突变共存患者的MST 为3 个月,显著低于≤3个基因突变共存患者的12个月(P=0.025),详见图4 A。1个、2个、≥3个基因突变患者的MST均低于无基因突变患者,但差异不显著(P>0.05),详见图4 B。
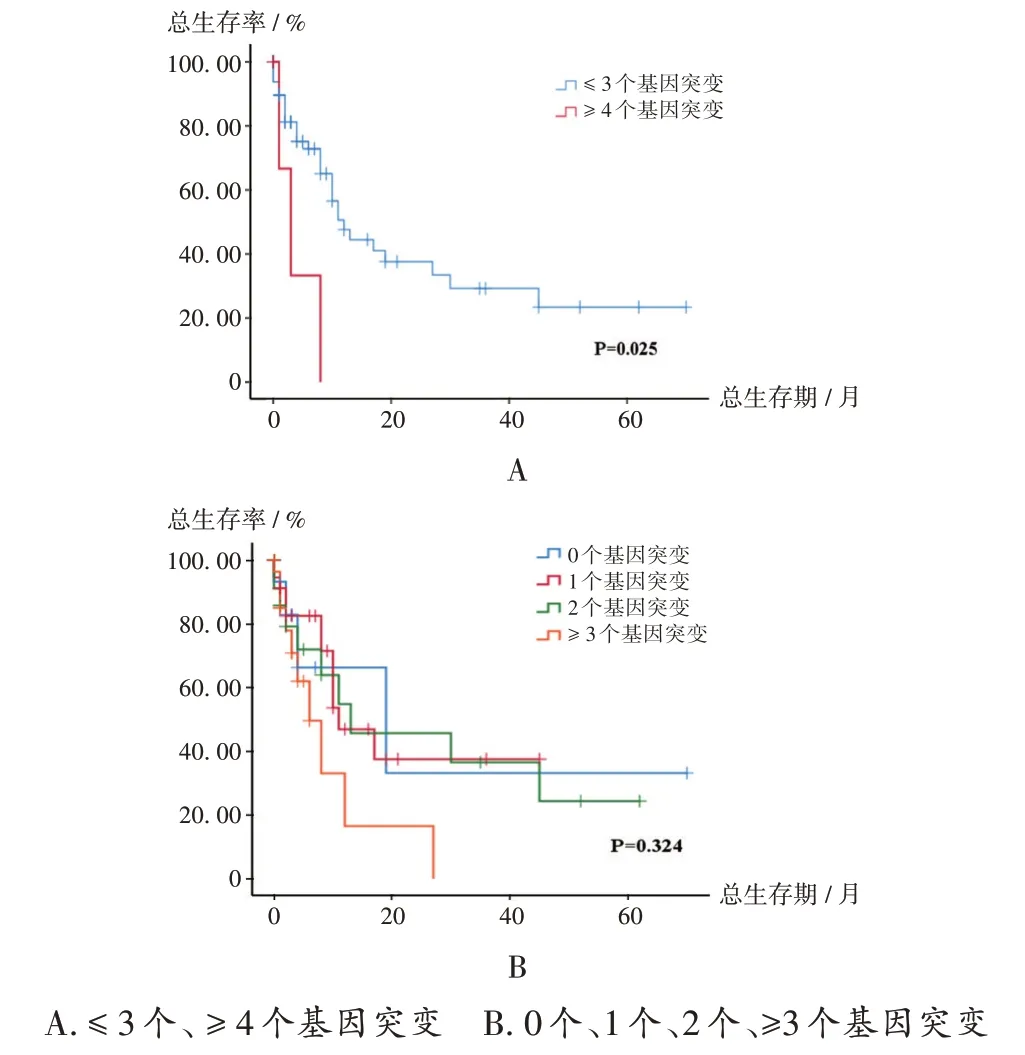
图4 133例老年AML患者基因突变个数对总生存期的影响A.No more than three and no less than four gene mutations B.Zero,one,two and no less than three gene mutationsFig.4 Effect of the number of gene mutations on the OS in 133 elderly patients with AML
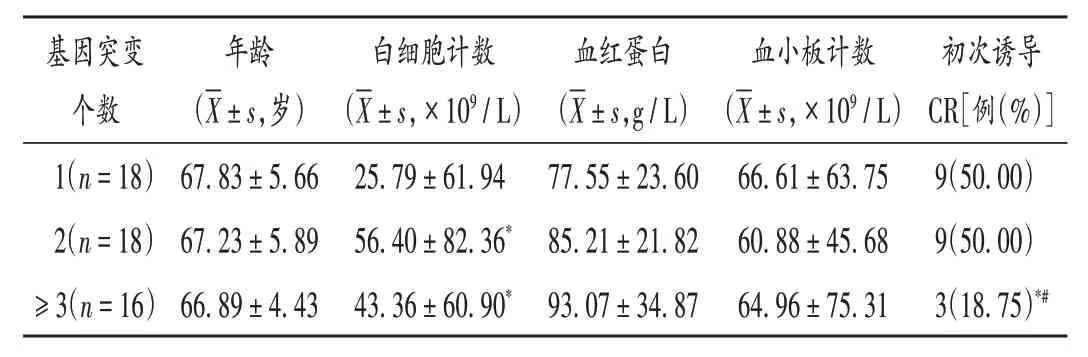
表2 基因突变个数与部分临床参数、初次诱导CR的关系Tab.2 Relationship of the number of gene mutations with some clinical parameters and CR of initial induction
2.5 疗效分析
63例患者可评估疗效,经1~2个疗程诱导治疗后,CR 29 例,PR 9 例,NR 25 例,其中2 例在治疗过程中死亡,总CR率为46.03%(29/63)、OR率为60.32%(38/63)。低强度化疗组可评估疗效51例,CR率为49.02%(25/51)、OR 率为62.75%(32/ 51),高于标准化疗组(可评估疗效12 例)的33.33%(4/ 12)和50.00%(6/ 12),但差异不显著(P=0.417,0.327)。
2.6 影响OS 的预后因素分析
老年AML 患者进行单因素分析。结果表明,初诊白细胞计数≥50×109/L、难治、复发、伴有髓外浸润、诱导治疗1~2个疗程后未达CR、FLT3-ITD突变、TET甲基胞嘧啶双加氧酶2 基因(TET2)突变为影响老年AML患者OS 的不良因素(表3)。将单因素分析中P<0.2的结果纳入多因素COX分析,结果显示≥70岁、难治、复发、诱导治疗1~2 个疗程未达CR、FLT3-ITD突变是老年AML患者OS不良预后的独立影响因素(表4)。

表3 影响老年AML患者OS的单因素分析Tab.3 Univariate analysis of factors affecting the OS in elderly patients with AML
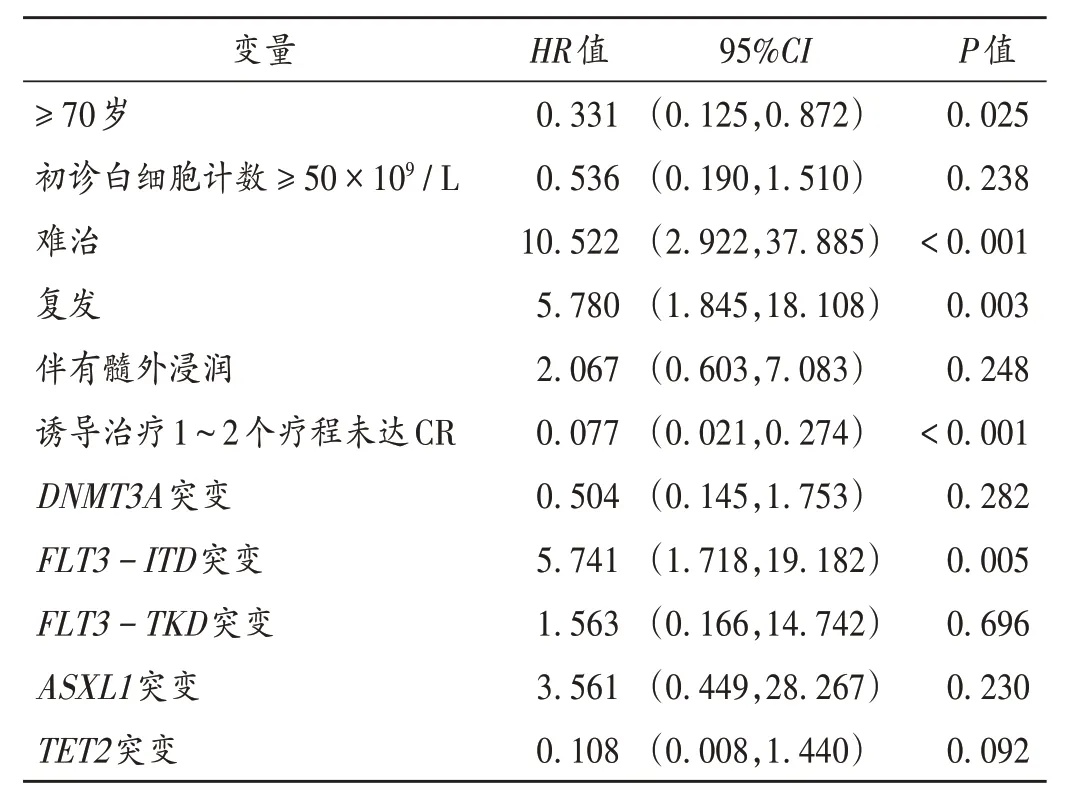
表4 影响老年AML患者OS的多因素分析Tab.4 Multivariate analysis of factors affecting the OS in elderly patients with AML
3 讨论
本研究中,老年AML 患者的基因突变频率较高(88.72%)。研究显示,老年AML 患者的基因突变个数随年龄的增长而增加[1]。PRASSEK 等[8]的研究显示,75岁以上老年AML患者的基因突变数为每例1~10个,中位基因突变数为每例4个,突变基因数与OS 无关。本研究结果与之有一定出入,并初步发现基因突变数与老年AML 患者预后有关,但仍需扩大样本量进一步研究证实。
FLT3 属Ⅲ型受体酪氨酸激酶家族成员,位于染色体13q12,主要在骨髓和淋巴的造血干细胞或祖细胞中表达,在成熟细胞中未观察到,故其在造血发育早期有重要意义[9]。目前,已知的FLT3基因突变主要包括ITD 和TKD,约1/ 3 的患者存在FLT3基因突变[10],且FLT3-ITD突变频率随年龄的增加而升高。本研究中,老年AML 患者FLT3-ITD突变频率为9.77%,与既往报道结果[11]相近。研究显示,合并FLT3-ITD突变患者的诱导缓解率低、复发率高,生存期短,预后差[12],美国国立综合癌症网络的AML 诊疗指南中已将FLT3突变作为AML 预后不良的指标[13]。本研究中,影响OS 的单因素及多因素分析显示,伴FLT3-ITD突变的老年AML 患者的OS 短于无FLT3-ITD突变的患者,提示FLT3-ITD基因突变在老年AML 患者中是预后不良指标,与既往研究结果[14-15]一致。但本研究中病例数较少,未进一步分析FLT3-ITD基因表达量及FLT3-ITD合并除WT1外其他基因突变对老年AML患者预后的影响。
DNA 甲基化是主要的表观遗传调控机制,主要参与染色质结构重塑和基因表达调控,如发生异常可引起基因突变、染色体杂合性丢失、原癌基因活化、抑癌基因沉默等,从而导致肿瘤。DNA 甲基转移酶(DNMT)是其关键酶,哺乳动物的DNMT 家族包括DNMT1,DN‑MT3A,DNMT3B[16-18]。其中,DNMT3A基因位于人类染色体2p23上,编码一种从头甲基转移酶,其突变可导致DNA 甲基化模式异常,在多种恶性肿瘤的发病机制中起重要作用。DNMT3AR882 突变是DNMT3A突变的主要形式,是AML 患者的重要不良预后分子学改变[19-20]。本研究中,老年AML 患者的DNMT3A基因突变频率较高,存在DNMT3A突变的老年AML 患者的OS短,预后较差,与既往研究结果[21]一致,提示DNMT3A是一个潜在的预后指标,且同时存在FLT3-ITD和DN⁃MT3A突变的患者预后更差[22]。
5%~10%的年龄> 65 岁患者的外周血细胞中可检测到TET2获得性失活突变,其可催化5 - 甲基胞嘧啶羟甲基化为5-羟甲基胞嘧啶,导致DNA高甲基化状态,启动致癌过程[23]。目前,TET2突变对预后的影响尚不明确。朱志娟等[24]认为,TET2基因低表达是正常核型AML 患者预后不良的指标。周柰岑等[25]的研究发现,伴TET2基因突变的患者预后优于TET2野生型的患者,但差异不显著。本研究中,影响OS 的单因素分析结果显示,TET2突变是影响老年AML 患者OS 的不良因素,但多因素分析结果提示,其并非老年AML 患者OS的独立不良预后因素。TET2突变对AML的影响存在不确定性。SOURA 等[26]认为可能与TET2突变和其他基因突变的关联尚未完全阐明有关。
传统的“3 + 7”方案已不能使老年AML 患者获益[27]。目前,老年AML 患者的治疗方式主要包括标准的“3+7”化疗、低强度化疗、姑息治疗。其中,低强度化疗已成为临床老年AML 的主要治疗方案。对于老年AML 患者,低强度化疗疗效优于“3+7”方案,可提高患者的诱导治疗反应[28]。本研究中,老年AML 患者的诱导治疗中,低强度化疗组诱导治疗1~2 个疗程的OR率、CR 率均高于标准化疗组,与既往研究结果[28]一致,但差异不显著,可能与本研究纳入的病例数较少且随访时间较短有关。
综上所述,老年AML患者基因突变频率较高,且存在多种突变基因,多基因突变较常见,WT1合并FLT3-ITD或WT1合并DNMT3A突变的患者OS 短,预后差,多种因素可影响老年AML 患者的预后,诱导治疗选择低强度化疗方案可在一定程度上提高疗效。
