脓毒症患者早期血清学指标对死亡的预测价值及诊断价值*
2023-06-23左和平吴佳丽梅斌
左和平, 吴佳丽, 梅斌
(1.安徽医科大学第二附属医院 EICU, 安徽 合肥 230601; 2.浙江大学附属第一医院 超声诊断科, 浙江 杭州 310013; 3.安徽医科大学第一附属医院 麻醉与围术期医学科, 安徽 合肥 230022)
脓毒症是由于宿主对感染产生的全身炎症反应综合征,并可能最终发展为严重的器官功能障碍、脓毒性休克或死亡,每年有超过1 900万人发生脓毒症,约600万人死亡, 该病具有极高的病死率以及遗留生理功能缺陷,目前仍是医院面临的重大难题、亦是全球性负担[1-3]。脓毒症的病理生理过程复杂,其早期识别和干预对其病理生理的逆转、降低病死率和致残率至关重要。目前对于感染所致脓毒症诊断仍以微生物培养作为金标准,但因其耗时长、抗生素的早期使用使血培养的敏感性降低,以血培养作为早期诊断标准存在很大局限性[4]。脓毒症患者的实验室指标和评分是临床上较容易获得指标,其对患者的诊断和评估仍发挥着重要的作用,本研究分析不同转归脓毒症患者的早期临床指标,以评价这些指标的临床价值。
1 资料与方法
1.1 一般资料
选取2019年1月—2021年9月明确诊断脓毒症患者作为研究对象,纳入标准:(1)符合脓毒症和脓毒性休克的诊断标准[4];(2)18~95周岁。排除标准:(1)入院24 h内死亡或自动出院者;(2)合并终末期恶性肿瘤者或行放化疗患者;(3)患有结缔组织病、血液系统恶性肿瘤、自身免疫性疾病、急性心肌梗死、急性肝炎等疾病;(4)临床资料不完整者。本研究获医院伦理委员会批准(批号YX2021-132)。
1.2 分组
根据患者患病后28 d生存情况分为存活组(n=69)和死亡组(n=42);根据是否发生休克又分为脓毒症组(n=58)和脓毒性休克组(n=53),脓毒性休克是指脓毒症患者出现持续性低血压,且在充分容量复苏后仍需血管活性药来维持平均动脉压≥65 mmHg、血乳酸水平>2 mmol/L;根据是否发生多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)分为脓毒症合并MODS组(n=51)和脓毒症未合并MODS组(n=60)。
1.3 观察指标
收集入组患者的一般资料,包括性别、年龄、原发感染部位、生存时间及疾病转归。入院24 h内对患者进行急性生理学与慢性健康评分(acute physiology and chronic health evaluation scoring system,APACHEⅡ) 、序贯器官衰竭(sequential organ failure assessment,SOFA)评分及入院24 h内取血检测C反应蛋白(c-reactive protein,CRP)、降钙素原(procalcitonin,PCT)、血常规、血清乳酸脱氢酶(lactate dehydrogenase,LDH)、总胆红素(tota bilirubin,TBIL)、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCR)、D-二聚体(D-Dimer)、血纤维蛋白原(fibrinogen,FIB)。
1.4 统计学分析
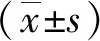
2 结果
2.1 临床资料
本研究最终纳入脓毒症患者111例,其中男59例、女52例,年龄24~93岁、平均(62.96±15.02)岁。根据原发感染部位分成肺部感染15例、腹腔感染29例、泌尿系感染19例、中枢感染3例、软组织感染10例、合并多部位感染35例。以28 d转归结果对生存组和死亡组进行分析,死亡组患者的年龄、APACHEⅡ评分、SOFA评分、血清LDH、BUN、SCR和D-Dimer高于生存组,而FIB低于生存组,差异有统计学意义(P<0.05)。见表1。
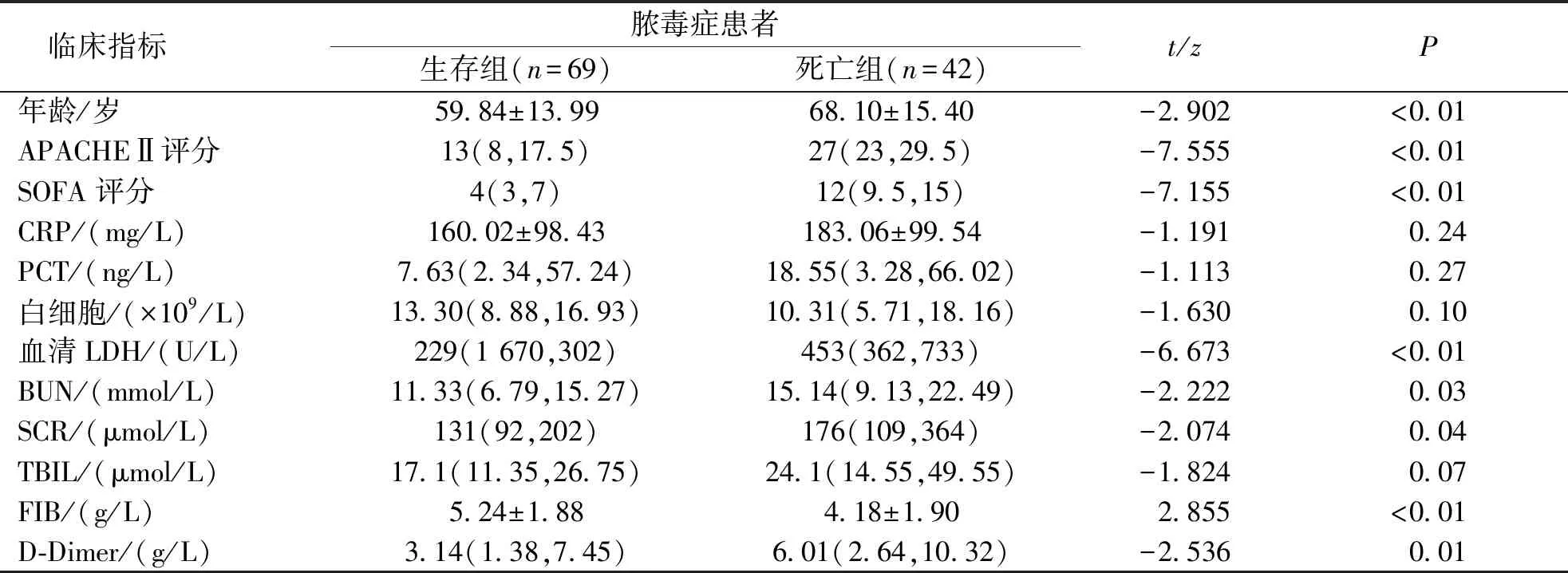
表1 生存组与死亡组临床资料单因素分析
2.2 脓毒性休克或合并MODS患者临床资料单因素分析
结果显示,脓毒症无休克与休克组比较、无合并MODS与合并MODS组比较,血清LDH、BUN、SCR、FIB及D-Dimer指标差异均有统计学意义(P<0.05);PCT在是否合并休克组差异有统计学意义(P<0.05),而CRP在两组比较差异均无统计学意义(P>0.05)。见表2、表3。
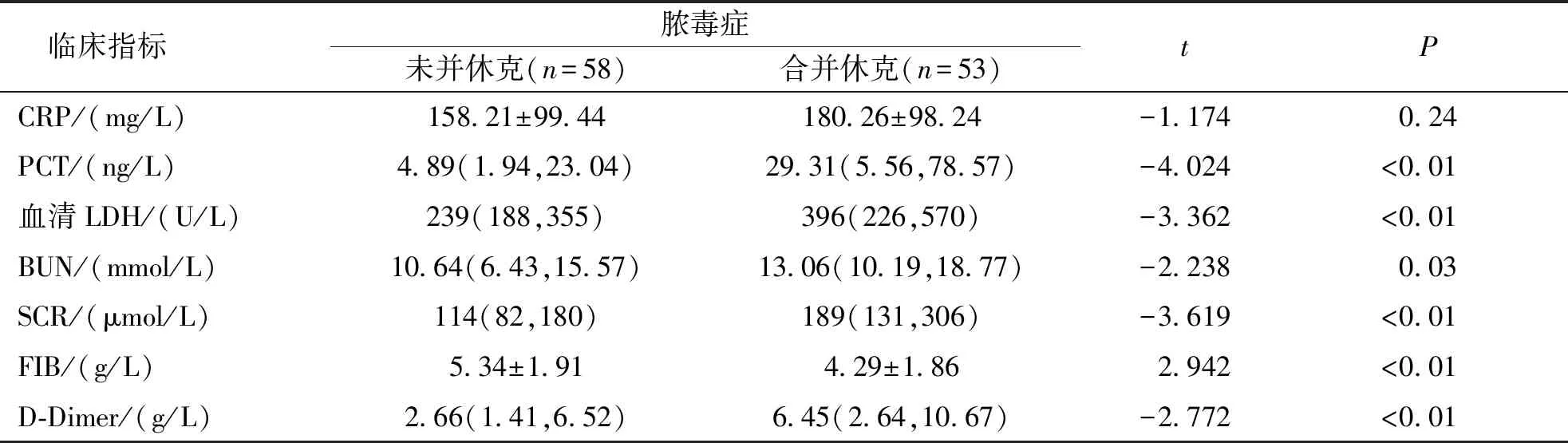
表2 脓毒症休克组与脓毒症无休克组患者血液学指标比较
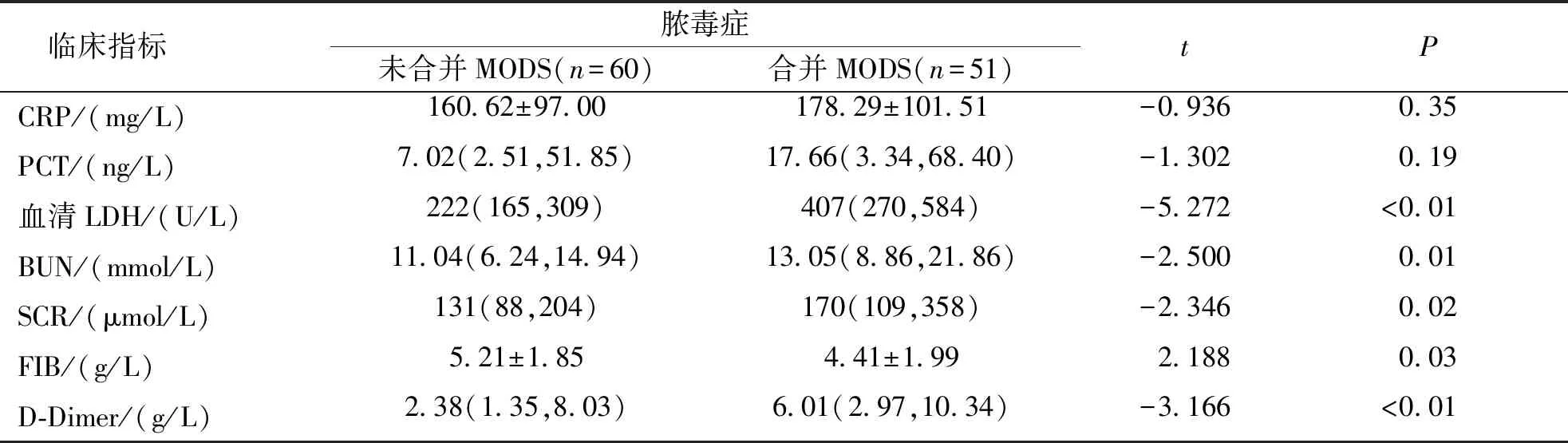
表3 脓毒症合并MODS组与脓毒症未合并MODS组患者血液学指标比较
2.3 脓毒症患者28 d预后Cox回归生存分析
以28 d生存状态为结局,将单因素分析存在意义指标纳入Cox比例风险回归模型,结果显示血清LDH的OR值1.001,95%CI(1.001~1.001)、FIB的OR值0.793,95%CI(0.655~0.961),差异均有统计学意义(P<0.05)。见表4。提示血清LDH、FIB是脓毒症患者死亡的危险因素。
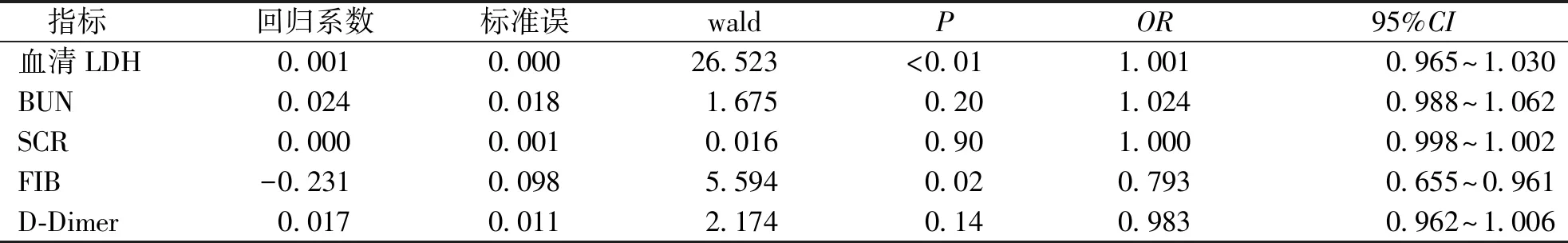
表4 脓毒症患者28 d生存预后的Cox回归分析
2.4 脓毒症患者各指标ROC曲线分析
以28 d生存状态为结局绘制ROC曲线,结果显示APACHEⅡ评分、SOFA评分及血清LDH对脓毒症患者28 d预后的预测价值较高,AUC分别为0.928、0.904、0.879,高于CRP、PCT、BUN、SCR、FIB及D-Dimer的预测价值。见表5。
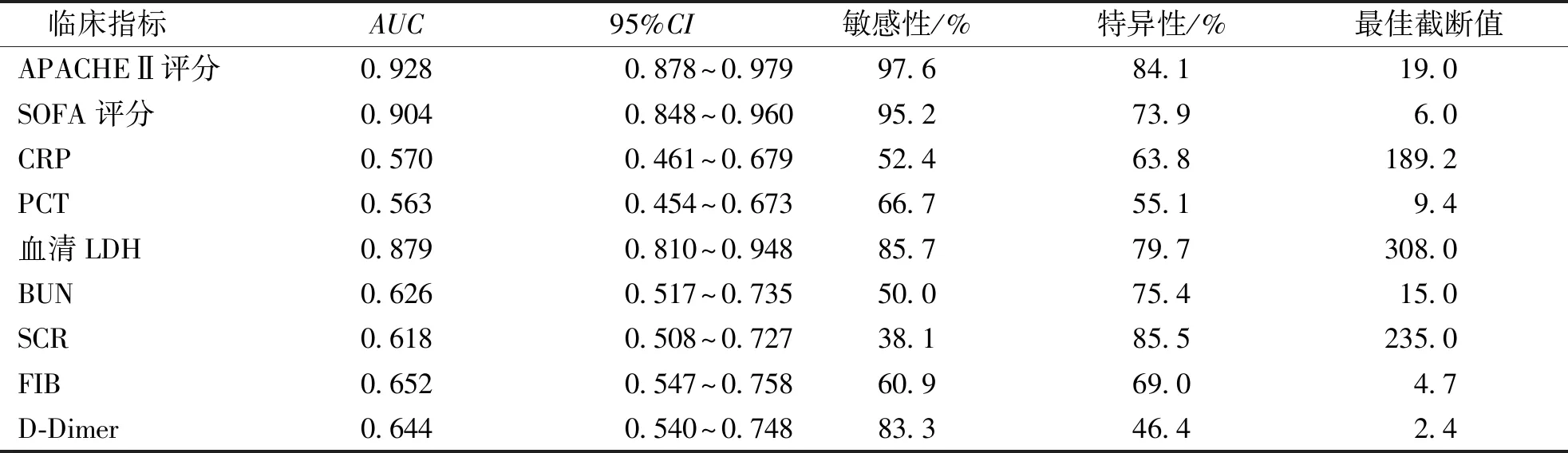
表5 影响脓毒症患者28 d预后相关风险因素
2.5 脓毒症患者危险因素Kaplan-Meier生存曲线
将以上单因素分析中有统计学意义指标纳入危险因素分析,以28 d生存状态为结局、以最佳截断值分组绘制Kaplan-Meier生存曲线(图1),高血清LDH、BUN、SCR和D-Dimer患者累计生存时间均显著缩短(P<0.05);而不同水平FIB患者的累计生存时间比较,差异无统计学意义(χ2=0.449,P=0.503)。见表6。
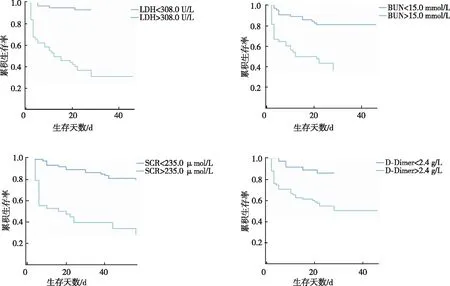
图1 不同预后脓毒症患者的Kaplan-Meier生存曲线
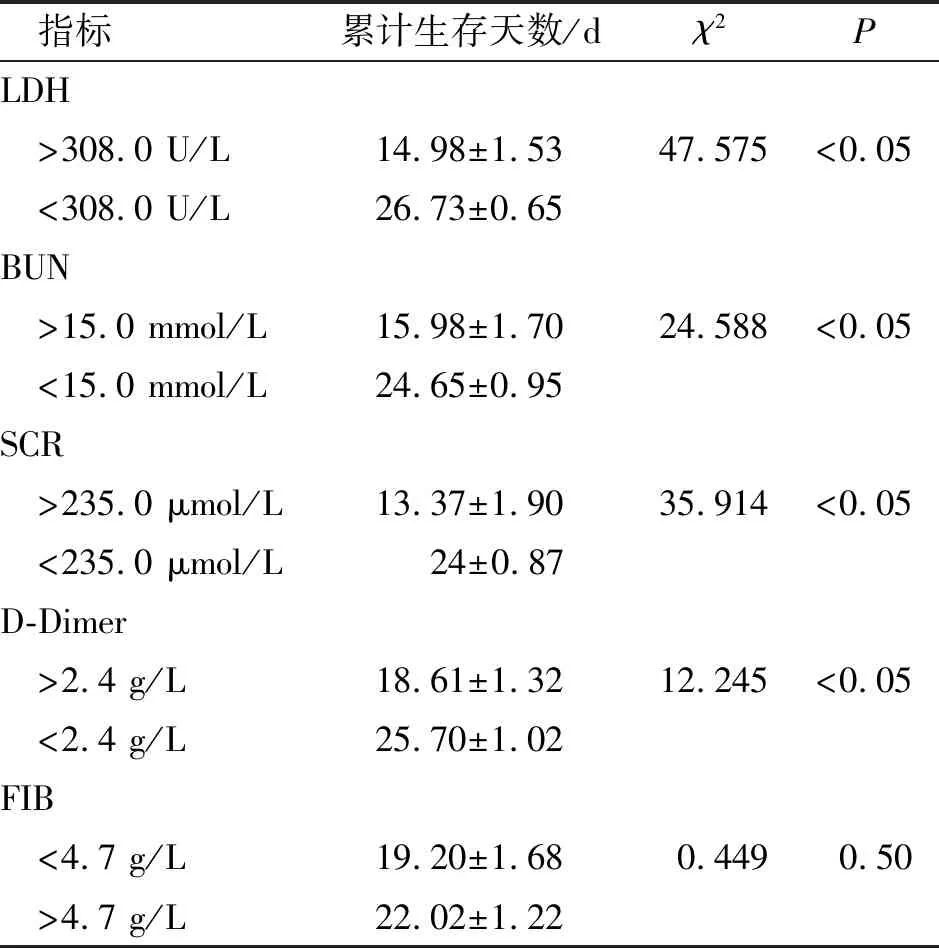
表6 各危险因素Kaplan-Meier生存曲线分析
3 讨论
尽管对脓毒症的临床研究已经较多,在治疗方面也取得重大进展,但是脓毒症仍有近一半的高死亡率[5],困扰广大临床医生,早期病情严重程度判断对治疗策具有重要作用。最初脓毒症被认为是过度炎症反应导致组织和器官损伤,研究者重视炎症指标在脓毒症患者中的评估作用,Jekarl等[6]指出PCT是脓毒症独立危险因素,刘大东等[7]研究中死亡组白细胞较生存组显著升高,与病情严重程度呈现正相关,但因炎症指标易受感染病原体类型、年龄、宿主反应能力、疾病状态等因素影响,年龄较大病情较重者可反应不典型[8],在本研究中虽然死亡组CRP、PCT较生存组高,但在两组之间却未见统计学意义,且AUC分别为0.570和0.563,其预测价值较低。近些年来APACHEⅡ和SOFA评分系统越来越多用于脓毒症患者的评估中,Daga等[9]研究指出APACHEⅡ评分可作为脓毒症早期预后的独立预测因子,当评分数值超过22.5预测死亡率的敏感性和特异性均超过80%,且SOFA评分预测早期死亡率的AUC为0.971,在本研究死亡组的APACHEⅡ和SOFA评分显著高于生存组,但不可忽略APACHEⅡ和SOFA评分均包括多个变量且依赖实验室结果,是一个耗时且复杂的项目。
近些年脓毒症在细胞免疫、凝血、微循环、能量代谢和器官功能障碍等方面的病理生理机制研究倍受关注,本研究收集脓毒症患者入院后24 h内血液指标,发现血清LDH、BUN、SCR、FIB、D-Dimer不仅在死亡与生存组之间存在统计学差异,亦在不同严重程度组存在统计学差异。既往研究发现机体为抵抗应激能够通过葡萄糖代谢重编快速产生能量,即无论机体是否缺氧,免疫细胞等可转换葡萄糖原有的能量代谢途径而增加糖酵解过程,血清LDH作为催化酶将丙酮酸转化为乳酸参与其中,此过程在脓毒症中起着关键作用[10-11],此外研究者发现内毒素、低血压等创伤下可造成组织受损、细胞通透性增加或细胞凋亡,亦可导致血清LDH增加及活性升高[12],本研究中死亡组血清LDH明显高于生存组,脓毒性休克或合并MODS者亦明显升高,经统计分析血清LDH对预后评估具有较高敏感性和特异性,为脓毒症患者的独立危险因素,与既往段金旗等[13]和Lu等[14]的研究结果一致。BUN是人体内蛋白质代谢的最终产物并通过肾脏代谢,内毒素及炎症反应不仅可增加机体对能量需求造成负氮平衡,同时内毒素刺激可致肾脏内尿素转运蛋白表达降低,肾血流量及肾内渗透压下降[15-16],严重脓毒症常可出现肾小管坏死至急性肾损伤[17],同时影响BUN代谢,出现BUN、SCR水平的升高,增加患者的病死率,在Zhao等[18]的一项队列研究中发现,BUN可作为脓毒症1年总生存率的独立预测因子,在范泉等[19]研究中BUN对脓毒症早期预后AUC为0.731(95%CI:0.635~0.827),本研究绘制Kaplan-Meier生存曲线亦发现高BUN、SCR的累计生存时间显著降低。凝血功能紊乱在脓毒症疾病的发展进程中发挥重要作用[20],早期内毒素及炎症因子促进组织因子释放,激活凝血系统并出现纤溶亢进,导致纤维蛋白降解产物增多,与本研究死亡组低FIB和高D-Dimer结果一致,但随着脓毒症疾病进展凝血及纤溶均可受抑制,出现血液高凝、纤维蛋白未降解至微血栓形成,最终导致弥漫性血管内凝血的出现[21],该过程还需更大样本及更深入研究进行阐述。本研究为单中心回顾性研究,且纳入样本量尚不足,存在一定的局限性,后续可行多中心前瞻性研究以明确相关指标的预测价值,其次未增加远期预后,后续仍需更大样本多中心长时间的研究,进一步了解在脓毒症患者中相关指标的临床价值。
综上所述,经过单因素及多因素分析可知血清LDH、BUN、SCR、FIB、D-Dimer均是脓毒症预后不良的危险因素,涉及炎症反应、细胞代谢、能量等方面,其中血清LDH对脓毒症预后具有较高的敏感性及特异性,结合其他指标对疾病严重程度及预后具有较高的预测价值。
