微钙化超声显示在乳腺癌诊断中的价值及与预后的关系*
2023-06-23陈潇叶大才李媚关海天龙金霞
陈潇, 叶大才, 李媚, 关海天, 龙金霞
(1.梧州市工人医院 超声医学科, 广西 梧州 543000; 2.梧州市工人医院 普外科, 广西 梧州 543000)
2018年流行病学调查显示乳腺癌发病率约占全球女性癌症的24.2%,位居第一[1],也是目前女性死亡率最高的癌症[2]。因此尽早识别乳腺癌显得尤为重要,这将有利于控制肿瘤的进展和改善患者的预后。有临床研究发现,超声在检出乳腺癌微钙化灶方面具有一定价值[3]。但其敏感度和特异度具体如何尚无统一定论,关于微钙化灶检出对预后影响的相关文献报告较少。据此,本研究选取91例乳腺癌患者作为研究对象,旨在探讨超声检出微钙化灶在乳腺癌诊断中价值及分析微钙化灶与预后的关系。
1 资料与方法
1.1 临床资料
收集2017年1月—2019年12月就诊、并随访至2021年12月的91例乳腺癌患者的临床资料。以病理结果为金标准,经金标准检出微钙化共46例。并根据患者随访期间是否出现肿瘤复发、转移或死亡情况,将91例乳腺癌患者分为预后不良组(n=38)与预后良好组(n=53),91例乳腺癌患者均为女性,年龄21~65岁,平均(42.32±2.45)岁;平均体质量指数(BMI)为(23.55±2.05)kg/m2。乳腺癌诊断符合“中国抗癌协会乳腺癌诊治指南与规范(2019年版)”标准[4],经病理检查确诊。乳腺癌微钙化诊断标准:经病理检查检出钙化“沙粒体”。(1)原位癌为镜下见腺管内细胞退变、坏死、沙粒体;(2)早期浸润性癌为镜下见腺管内有沙粒体;(3)浸润性癌为镜下见肿瘤细胞呈片状坏死,并深染钙化;(4)浸润性特殊癌为镜下见腺管内有沙粒体聚集,腺管壁钙化,间质内细微钙化灶。纳入标准:(1)病理结果为乳腺癌;(2)女性;(3)术前未接受放疗或免疫疗法治疗;(4)年龄≥18岁。排除标准:(1)哺乳期或妊娠阶段;(2)临床资料不全;(3)认知功能障碍。
1.2 检查方法
91例乳腺癌患者术前均予以超声检查。采用GE公司Logic E9型彩色多普勒超声诊断仪,探头频率10~15 MHz,选择直接探查法,指导患者取仰卧位,充分暴露两侧乳房后,触诊,了解可疑肿瘤部位、大小、硬度及活动度后,以乳头为中心,分别行纵、横、斜切面扫查,观察肿瘤大小、形态、边界、内部回声,有无微钙化等。微钙化检出标准[5]:(1)细点状微钙化为见针尖状强回声点,呈单个或多个散在分布,似星星状,后方无声影,钙化灶约为1 mm;(2)簇状钙化为见钙化点聚集成团,似银河状,后方有声影或不明显;(3)斑点状钙化为于病灶中心或近周边见单个或多个光斑,钙化灶>1 mm。符合上述任意一条即可确诊为微小钙化。
1.3 观察指标
(1)观察超声诊断微钙化的阳性预测值、阴性预测值、影像表现及受试者工作(ROC)曲线下面积(AUC)、敏感度、特异度;(2)对比预后不良组与预后良好组的基线资料,包括年龄、绝经情况、肿瘤直径、病变位置、病理类型、淋巴结转移、TNM分期、微钙化等。
1.4 统计学分析
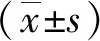
2 结果
2.1 微钙化与无钙化预测值比较
91例乳腺癌患者经超声检查后,微钙化预测值为86.67%,无钙化预测值为84.78%,与金标准相比,一致性较好(Kappa=0.714,P<0.001)。见表1。

表1 超声与金标准的微钙化与无钙化预测值比较
2.2 超声图像表现分析
经超声检出的39例微钙化乳腺癌患者中,肿块伴微钙化共29例、片状低回声伴微钙化2例、导管扩张伴微钙化4例、单纯微钙化共4 例。见图1和表2。

图1 微钙化乳腺癌超声图像表现
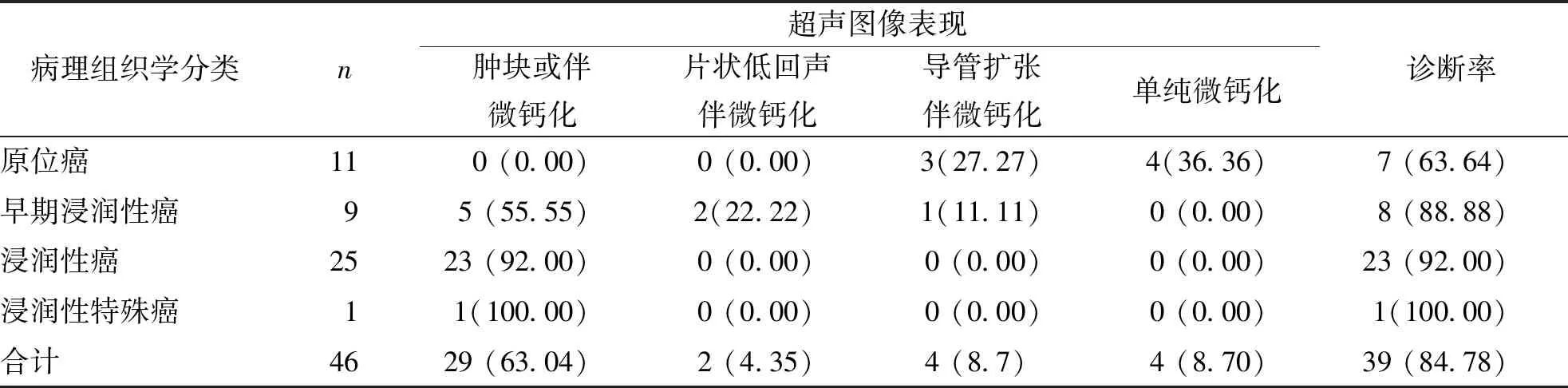
表2 不同组织学分类腺癌与超声图像表现对照[n(%)]
2.3 诊断效能分析
ROC曲线分析显示,超声诊断乳腺癌微钙化的AUC=0.857(P<0.05);标准错误为0.043;渐近95%置信区间为0.774~0.941;约登指数为0.715;敏感度为0.848%;特异度为0.867%。见图2。

图2 超声诊断乳腺癌的ROC曲线分析
2.4 预后不良的单因素分析
预后不良组与预后良好组在年龄、绝经情况、病变位置、病理类型等资料比较中,差异无统计学意义(P>0.05);而在肿瘤直径、淋巴结转移、TNM分期、微钙化等资料比较中,差异有统计学意义(P<0.05)。见表3。
2.5 二元logistic回归分析
以预后是否良好为因变量(不良=1,良好=2),以肿瘤直径(≥2 cm=1,<2 cm=2)、淋巴结转移(有=1,无=2)、TNM分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=2)、微钙化(有=1,无=2)为协变量,经二元logistic回归分析显示,肿瘤直径≥2 cm、淋巴结转移、TNM Ⅲ~Ⅳ期、微钙化为影响乳腺癌患者预后的独立危险因素(P<0.05)。见表4。
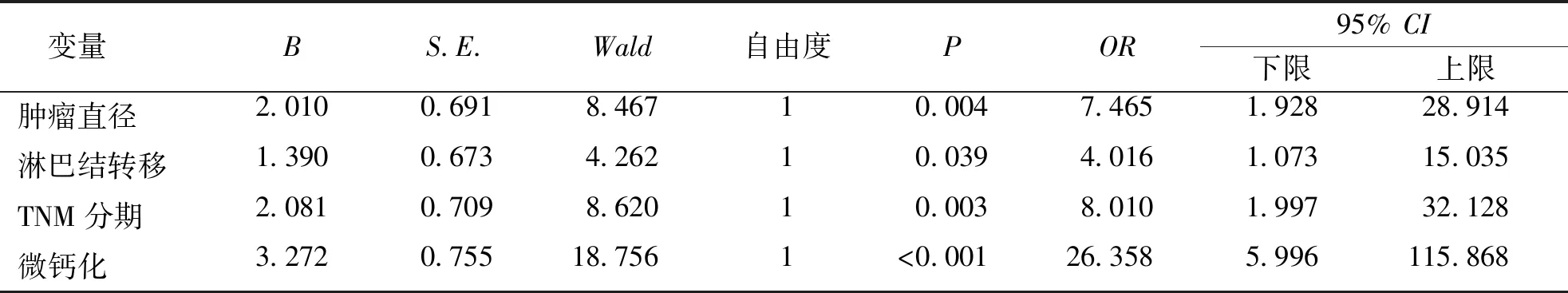
表4 影响乳腺癌患者预后的二元logistic回归分析
3 讨论
乳腺癌为临床较为常见的恶性肿瘤。其中,微钙化征象为临床诊断乳腺癌的重要依据[6]。据相关研究报道,乳腺癌患者出现微钙化灶几率高达30%~50%[7-8]。针对乳腺癌患者出现微钙化征象机制分析,发现可能与乳腺癌细胞代谢旺盛,血供不平衡致铁血黄素沉淀有关,进而形成微钙化[9]。但近年来,随着临床对乳腺疾病的进一步研究,发现钙化也会出现在乳腺良性病变患者中。针对其病理分析,发现乳腺良性病变患者的钙化多以粗大为主,故而本研究认为可通过该点判断乳腺良恶病变的不同。既往研究也指出,乳腺癌微钙化灶直径均<0.5 mm,符合乳腺癌钙化灶细小规律[10-11]。但也有少数乳腺癌患者的钙化灶呈粗大状,通常见于乳腺黏液腺癌[12]。在此情况下选择合适检查方法准确检出微钙化征象显得十分重要,有助于为临床诊断及治疗提供指导。
既往临床上常采用X线钼靶用于乳腺癌诊断,通过清晰显示乳腺癌微钙化灶形态、分布及数目等,为检出微钙化灶提供依据[13]。但因其存在辐射性,导致X线钼靶应用受到一定限制[14]。超声因具有无创、无辐射、可重复性操作等优势,在恶性肿瘤诊断中得到广泛应用[15-16]。本研究结果显示,91例乳腺癌患者经超声检出微钙化共39例,其中肿块伴微钙化占29例,片状低回声伴微钙化占2例、导管扩张伴微钙化和单纯微钙化各占4例。从上述结果得出,超声在单纯微钙化检出方面相对较低,可能与其分辨率有关,因此在原位癌或早期浸润性癌难显示、难定性单纯微钙化灶[17]。另外,受Cooper韧带、导管壁回声及乳腺纤维囊性变等因素的影响,超声也容易将这些结构的横断面误诊为微钙化[18]。而在浸润性癌、浸润性特殊癌阶段,临床表现较为突出,并不像原位癌或早期浸润性癌较为隐匿,故检出率相对较高[19]。
有研究表示,出现微钙化征象的乳腺癌患者,其危险性是未出现微钙化征象乳腺癌患者的1.68倍。故而其预后也更差,在本研究结果中也可见,存在微钙化灶的乳腺癌患者,其肿瘤复发、转移或死亡率更高。这可能是因为微钙化部分癌细胞能在特定情况下发生间质化改变,进而获得成骨功能及分泌成骨相关蛋白等因子,而骨相关蛋白的大量分泌与乳腺癌的转移及复发具有一定关联[20]。在韩敏等[21]研究结果中可见,微钙化是乳腺癌患者术后预后不良的危险因素。与本研究二元logistic回归分析结果“微钙化为影响乳腺癌患者预后的独立危险因素”基本一致,提示微钙化灶会对乳腺癌患者预后造成不利影响,临床应加以重视,通过准确检出,为患者制定最佳治疗方案。
综上所述,超声在乳腺癌患者中具有较为理想诊断效果,能通过检出微钙化灶为临床诊治提供指导意见,且微钙化灶是影响乳腺癌患者预后的危险因素之一。
