外周血NLR及LMR对局部晚期鼻咽癌长期生存预后的评估价值*
2023-06-23赵洪韬吴伟莉金风李媛媛龙金华罗秀玲唐红陈宇张芒周湾
赵洪韬, 吴伟莉, 金风, 李媛媛, 龙金华, 罗秀玲, 唐红, 陈宇, 张芒, 周湾
(1.贵州医科大学附属医院 头颈肿瘤科, 贵州 贵阳 550001; 2.贵州医科大学 临床医学院, 贵州 贵阳 550001; 3.贵州省肿瘤医院 头颈肿瘤科, 贵州 贵阳 550001)
早期鼻咽癌患者的症状一般不明显,难以发现,一旦确诊,约80%患者已处于局部晚期。早期鼻咽癌的5年生存率可达90%以上,而局部晚期鼻咽癌的患者亦达到74.5%~86%的5年生存率,究其原因得益于放射治疗技术和化疗方案的不断更新[1]。肿瘤淋巴远处转移(tumor node metastasis,TNM)分期系统是预测鼻咽癌预后的金标准,TNM结合血浆EB病毒(epstein-barr virus,EBV)DNA拷贝数对患者预后有重要的临床指导意义,但血浆EBV-DNA拷贝数的检测只能在级别较高的医院进行,并且检测水平存在一定的差异,因此需要寻找更简便的肿瘤预后指标来指导鼻咽癌的临床治疗。血常规是临床最基本的血液检验项目,外周血中许多细胞及蛋白等指标被发现与肿瘤的预后相关。中性粒细胞与淋巴细胞比值(neutrophils to lymphocytes ratio, NLR)是指外周血中中性粒细胞计数绝对值与淋巴细胞的计数绝对值的比值,淋巴细胞与单核细胞比值(lymphocytes to monocytes ratio, LMR)是指外周血中淋巴细胞计数绝对值与单核细胞的计数绝对值的比值,本研究选取了这两个已被证实与多个实体瘤预后相关的比值进行研究,同时结合指标的不同风险程度进行分组,综合分析其对局部晚期鼻咽癌长期生存的影响,旨在探寻一种简单易行且准确性较高的预后预测方法,为临床预测肿瘤患者预后提供一定指导作用。
1 对象与方法
1.1 研究对象
选取2013年3月—2015年9月收治的初治局部晚期鼻咽癌的患者200例。纳入标准:(1)完成多西紫杉醇+顺铂+氟尿嘧啶(TPF)方案(2~3周期)诱导化疗、调强放疗联合大剂量顺铂(DDP,2~3周期)同期化疗局部晚期鼻咽癌的患者;(2)有较完整的随访资料。200例患者中,男性139例、女性61例,年龄21~72 岁、平均(47.9±11.1)岁;根据TNM肿瘤分期法,T分期为3~4期115例、1~2期85例,N分期为0~2期有115例、3期85例;临床分期为Ⅲ期有57例、Ⅳ期143例。患者中位随访时间为54个月(8~86个月),45例患者在随访期间死亡,19例疾病进展,5年总生存率77.5%、无进展生存率68.0%。
1.2 研究方法
1.2.1治疗方法 (1)诱导化疗:TPF方案诱导化疗2~3周期,第1天,采用多西紫杉醇75 mg/m2、静脉滴注;第1~5天,采用顺铂75 mg/m2、分5 d用、输液泵持续泵入(10∶00~22∶00);第1~5天,氟尿嘧啶750 mg/(m2·d),输液泵持续泵入(22∶00~次日10∶00);21 d为1周期,共完成2~3个周期。(2)同期放化疗:诱导化疗结束后3周开始同期放化疗,采用调强放疗(intensity-modulated radiationtherapy,IMRT)技术,接受直线加速器6 mV-X线照射,根据ICRU50号及ICRU62号报告原则进行靶区勾画。鼻咽病灶剂量69.96~73.92 Gy/33次,有颈淋巴结转移患者的剂量69.96 Gy/33次,亚临床靶区及高危淋巴引流区剂量60.06 Gy/33次,低危淋巴引流区剂量50.96 Gy/28次;同期化疗采用顺铂 100 mg/m2,第1天,持续滴注,21~28 d为1周期,共完成2~3个周期。
1.2.2随访 于同期放化疗结束后随访,2年内每3月、2~5年每6月及5年后每1年复查一次,采用门诊或住院方式随访,记录患者5年的总生存期(overallsurvival,OS)及无进展生存期(progress free survival,PFS),OS时间定义为治疗开始之日~患者死亡时间,PFS时间定义为从治疗开始之日起至疾病进展(复发、转移等原因)、或者发生任何原因死亡的时间。
1.3 观察指标
收集患者首次化疗前72 h内的血常规报告,记录中性粒细胞、淋巴结细胞及单核细胞绝对值,计算外周血NLR与LMR。采用受试者工作特征曲线(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)分析确定2组指标的最佳临界值,并计算出相应曲线灵敏度、特异度,采用Kaplan-Meier法绘制生存曲线,并根据2组指标的最佳临界值对患者的OS及PFS的进行预后分析;根据NLR、LMR最佳临界值高低对200例患者进行分组(年龄、性别、T分期、N分期及临床分期在各组间的所占例数和百分比),并进行组间比较;采用单因素及多因素Cox风险模型对OS及PFS进行独立危险因素分析,确定影响鼻咽癌患者OS和PFS的预后因素。将NLR及LMR组合分析,其中NLR及LMR高于、等于,或小于、等于其最佳临界值,两者同时对鼻咽癌提示不良预后的结果分为高风险组;将NLR及LMR高于、等于,或小于、等于其最佳临界值,两者只有一个提示不良预后的结果分为中风险组;将NLR及LMR高于、等于,或小于、等于其最佳临界值,两者同时提示较好预后的结果分为低风险组;计算三组的OS率及PFS率,进行组间比较;对不同分组的T3-4及N3所占比例进行组间比较。
1.4 统计学分析
2 结果
2.1 NLR、LMR预测局部晚期鼻咽癌患者5年生存情况
200例患者治疗前外周血NLR为(3.76±0.23,范围1.06~27.38),LMR为(3.53±0.17,范围0.63~12.33)。根据NLR、LMR与局部晚期鼻咽癌患者5年生存率情况进行ROC曲线分析,NLR对患者5年生存率的诊断价值AUC=0.839(P<0.05)、灵敏度77.8%、特异度84.5%、最佳临界值为3.81;LMR对患者5年生存率的诊断价值AUC=0.781(P<0.05)、灵敏度97.4%、特异度55.6%、最佳临界值为2.03。见表1、图1。
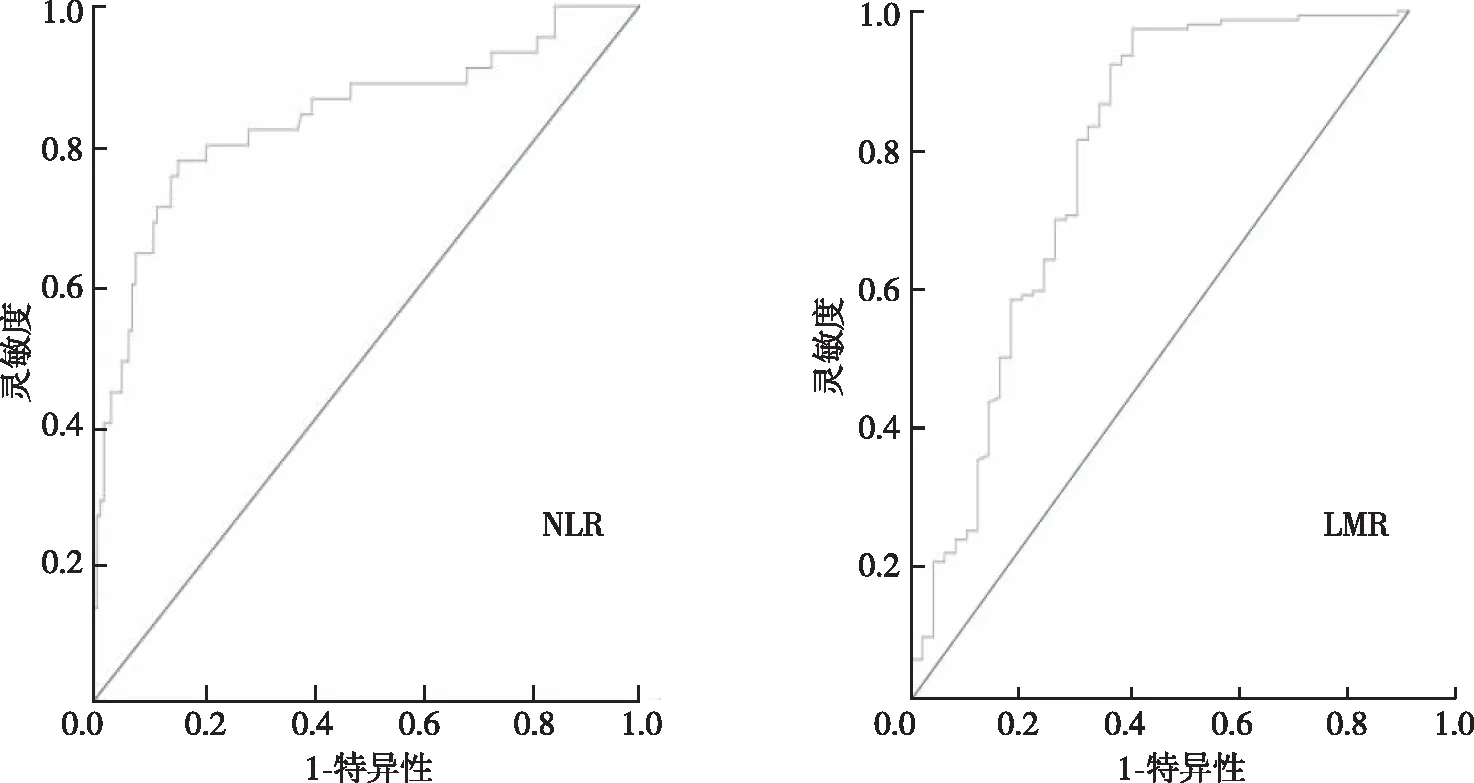
图1 NLR和LMR的ROC曲线
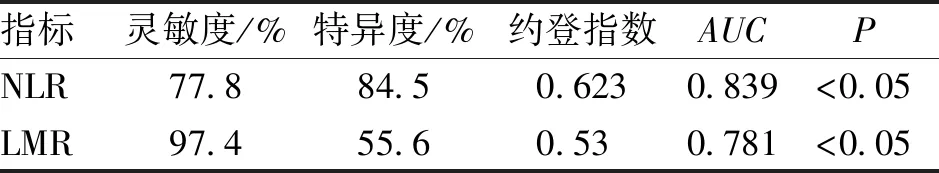
表1 外周血NLR与LMR对局部晚期鼻咽癌患者预后的评估价值
2.2 不同临界值NLR和LMR患者的一般资料差异性比较
根据NLR、LMR最佳临界值高低对200例局部晚期鼻咽癌患者进行分组,比较各组患者年龄、性别、T分期、N分期及临床分期的分布情况。见表2。
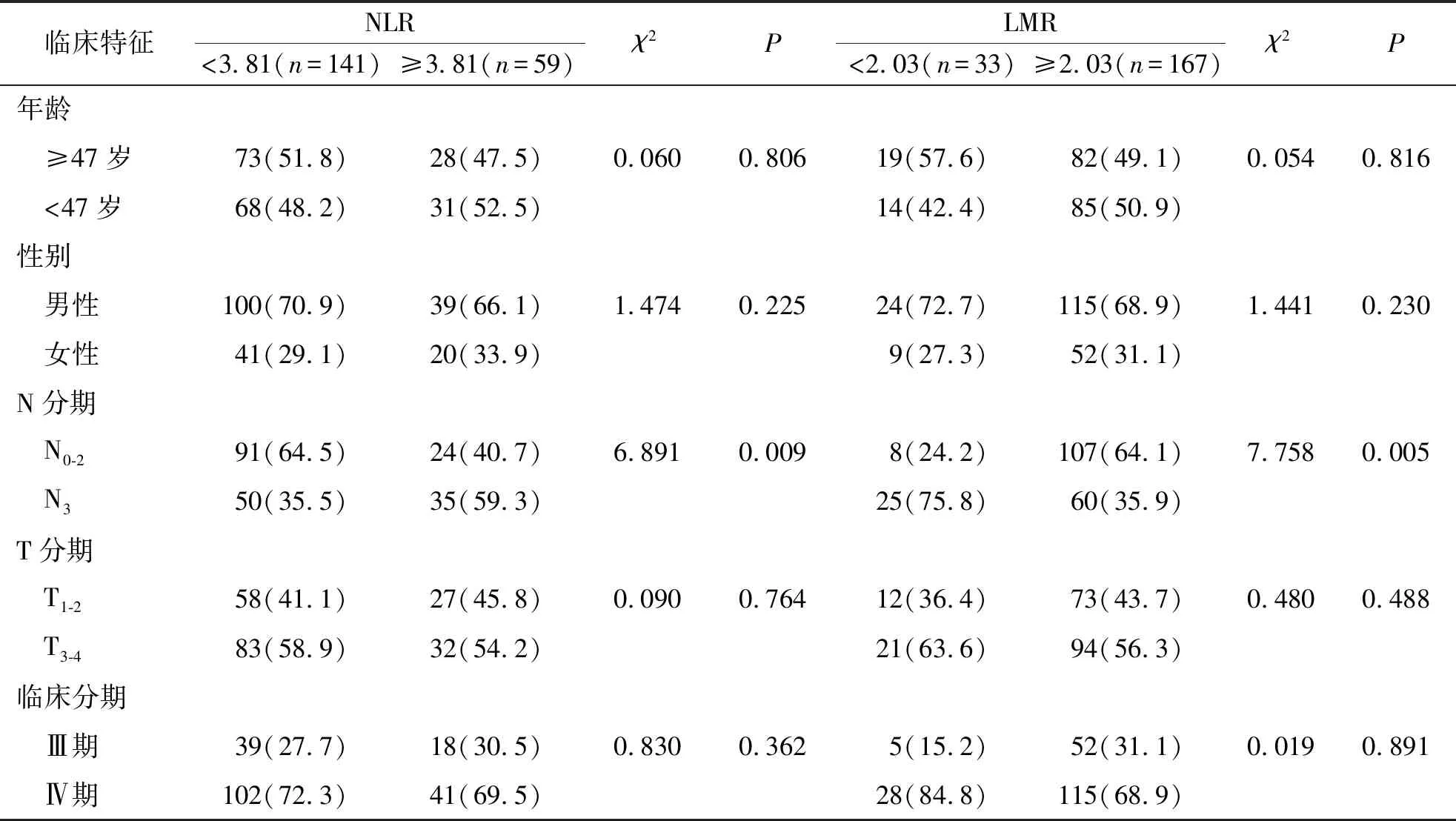
表2 一般临床资料[n(%)]
2.3 影响OS的独立危险因素分析
通过单因素及多因素Cox回归分析提示,N分期(HR=0.425,95%CI为0.185~0.975,P<0.05)、NLR≥3.81(HR=0.117,95%CI为0.048~0.282,P<0.05)、LMR<2.03(HR=0.449,95%CI为0.212~0.952,P<0.05)是OS独立危险因素,见表3。
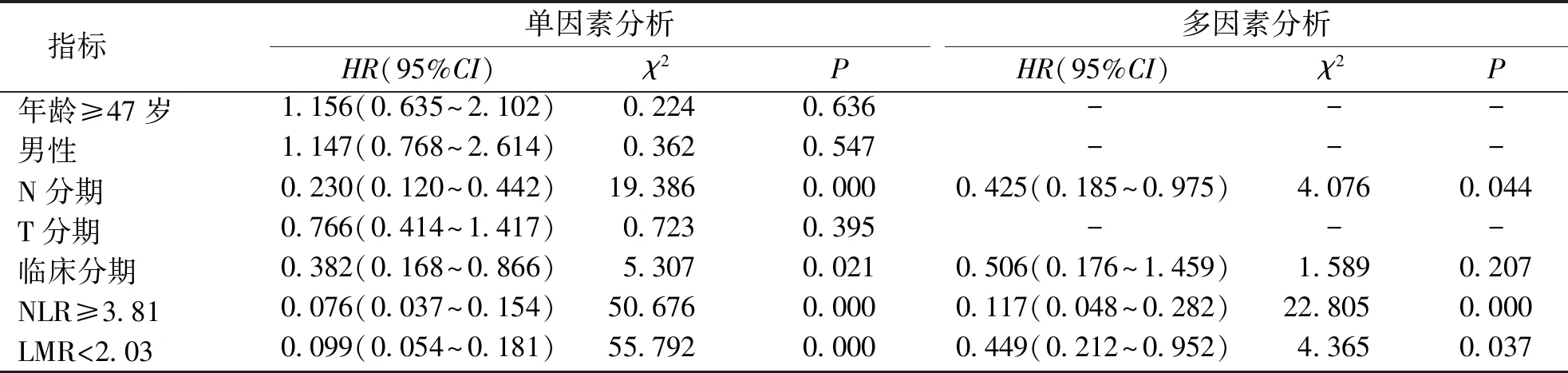
表3 影响局部晚期鼻咽癌患者总生存率的单因素及多因素Cox回归分析
2.4 影响PFS的独立危险因素分析
通过单因素及多因素Cox回归分析提示,N分期(HR=0.288,95%CI为0.141~0.589,P<0.05)、NLR≥3.81(HR=0.215,95%CI为0.110~0.420,P<0.05)是PFS的独立危险因素。见表4。
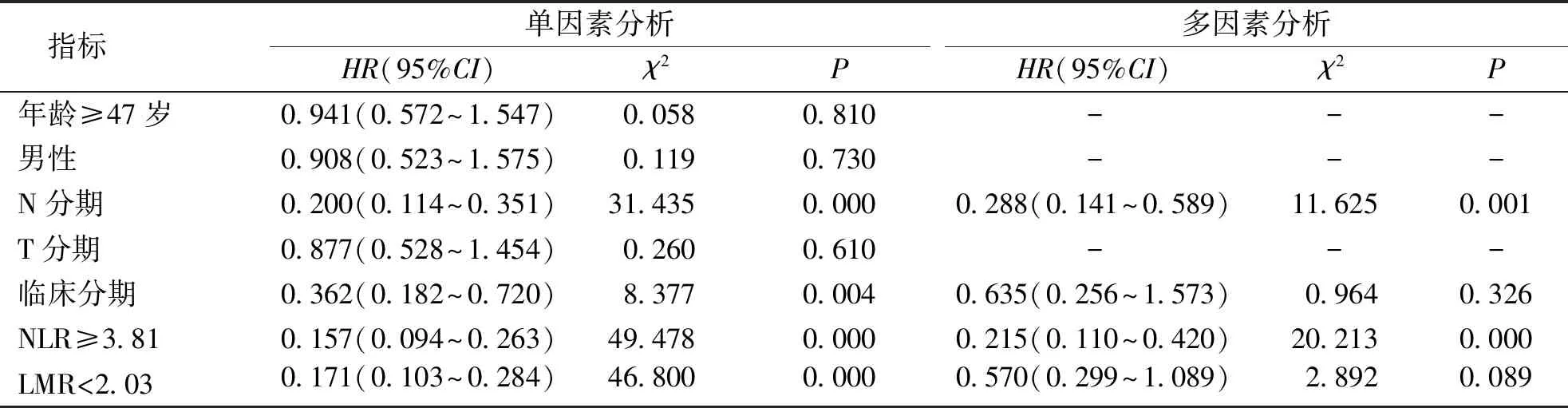
表4 影响局部晚期鼻咽癌患者无进展生存率的单因素及多因素Cox回归分析
2.5 NLR和LMR联合检测对局部晚期鼻咽癌患者预后的影响
危险因素分析结果显示,根据NLR和LMR联合检测结果,将200例局部晚期鼻咽癌患者分为3组:高风险组30例(NLR≥3.81且LMR<2.03)、中风险组35例(NLR<3.81且LMR<2.03,或NLR≥3.81且LMR≥2.03)及低风险组135例(NLR<3.81且LMR≥2.003。3组患者的5年OS率分别为13.3%、68.6%、94.1%,差异具有统计学意义(χ2=83.973,P<0.05);3组患者的5年PFS率分别为6.7%、57.1%、84.4%,差异具有统计学意义(χ2=47.286,P<0.05)。见表5。生存曲线见图2、图3。
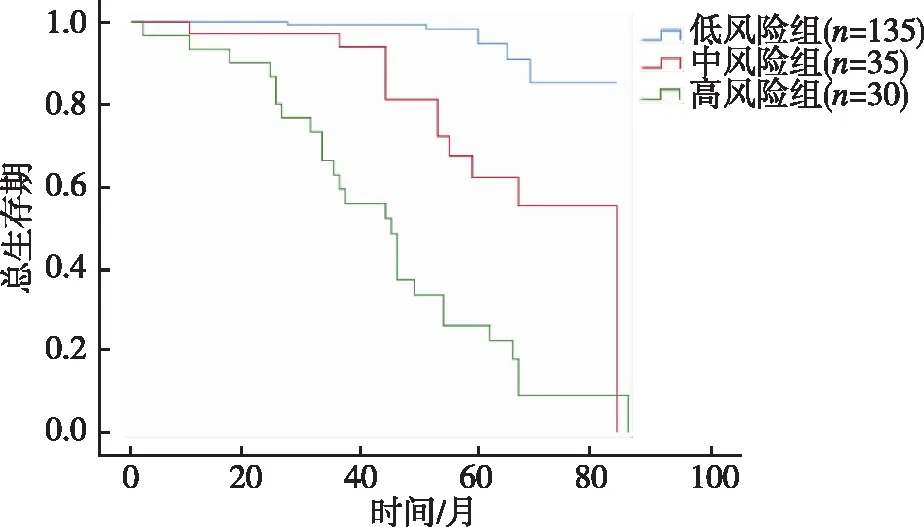
图2 不同风险组的总生存曲线
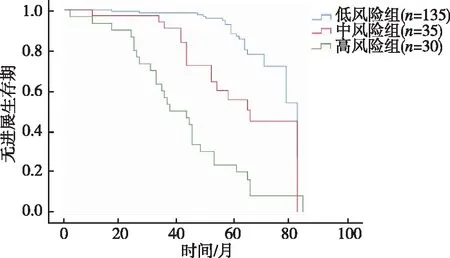
图3 不同风险组无进展生存曲线
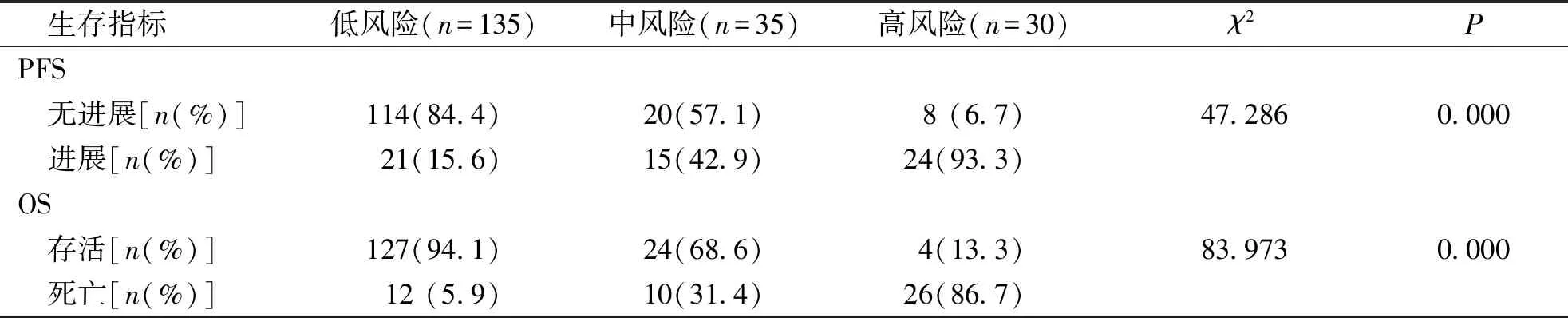
表5 不同风险分组局部晚期鼻咽癌患者的OS率及PFS率比较
2.6 不同风险局部晚期鼻咽癌患者的T、N分期比较
3组T分期为T3-4患者数所占比率分别为低风险组59.3%、中风险组45.7%及高风险组63.3%,组间差异无统计学意义(P>0.05);3组N分期为N3的患者数所占比率分别为低风险组35.6%,中风险组37.1%,高风险组80.0%,组间差异具有统计学意义(P<0.05)。见表6。
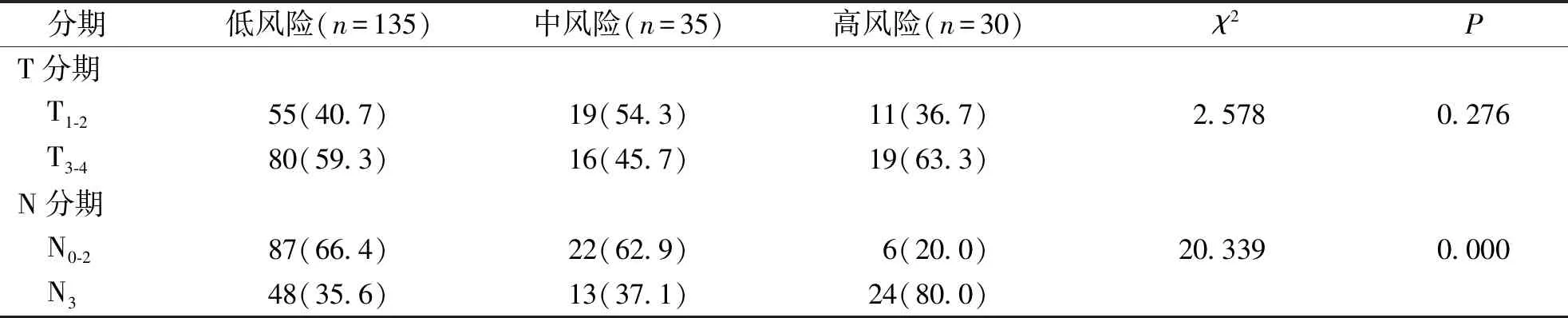
表6 不同风险组N分期比较[n(%)]
3 讨论
据统计,慢性炎症与世界上约25%的癌症有关[2],已被证实的有如胃癌的发生与幽门螺杆菌感染相关,乙肝病毒与丙肝病毒的感染可以增加肝癌的患病风险。这些研究一定程度上提示了炎症反应通过体内各种途径介导肿瘤的发生发展过程,证实了肿瘤与炎症的存在密切的联系。
炎症反应主要通过调控细胞因子和趋化因子来影响癌症的发生发展过程[3-4]。而在临床工作中,这些有调节作用的细胞因子和趋化因子通常无法被常规测量。但是,可以通过测量外周血中表达它们的细胞成分作为替代。近年来,已经提出基于这些外周血细胞计数的不同指标的组合标志物来研究其与肿瘤预后的相关性。其中中性粒细胞、淋巴细胞和单核细胞作为临床常用检验指标,其组合标志物的NLR和LMR被认为可能与多种恶性肿瘤的预后相关[5-8]。
近些年来,相关的研究表明NLR升高可能与肿瘤的发生、发展及预后不良相关,是一种预测因子[9-11]。NLR的升高在一定程度上提示肿瘤可能处于高代谢状态,发生发展更快,而同时患者的免疫功能也受到一定程度的抑制,其预后可能较差。本研究的结果发现,局部晚期鼻咽癌患者治疗前外周血NLR升高是其5年OS率和PFS率降低的独立危险因素,与An等[12]和Chang等[13]的研究结论一致。同时在Chang等[13]的研究中,也使用ROC曲线进行分析,得出NLR最佳截点值为3.73,但在该文中,纳入的3237例病例,纳入早期至晚期的患者,且占比例较多的局部晚期的治疗方式和化疗方案不统一。目前有关NLR与预后相关的研究多属于回顾性的研究,李晓惠等[14]不仅证明 NLR>3 是鼻咽癌患者的不良预后因素,还发现了NLR>3的患者其总生存率、无局部复发率、无远处转移率均远低于NLR≤3的患者。而在本文中,研究局部晚期鼻咽癌患者并应用相同的治疗模式和化疗方案后通过ROC曲线等方法得出结论,治疗前NLR对患者5年生存率的诊断价值AUC=0.839(P<0.05)、灵敏度77.8%、特异度84.5%、最佳临界值为3.81,且NLR≥3.81是预测局部晚期鼻咽癌患者OS率及PFS率降低的独立危险因素。虽然关于临界值目前没有统一的标准,但目前已有的相关报道表明,高NLR不利于患者预后。
LMR在一定程度上反应了宿主免疫和肿瘤微环境之间的平衡关系,较低的LMR可能提示宿主的免疫功能不全,并参与了肿瘤的发生发展,具体表现在两个方面:一是淋巴细胞的减少有助于肿瘤细胞避开肿瘤浸润淋巴细胞(TILs)的免疫监视,另外,外周血单核细胞可经过渗透,抵达肿瘤部位并且分化成肿瘤相关巨噬细胞,产生细胞因子,其可促进血管生成、免疫逃逸以及肿瘤细胞的增殖与转移[15]。目前,有一些研究称LMR在霍奇金淋巴瘤、非小细胞肺癌、急性白血病、转移性胃癌预后中有一定相关性;另一些研究表明在弥漫性大B细胞淋巴瘤等非霍奇金淋巴瘤中,治疗前外周血 LMR较低与患者预后不良相关[16]。但关于LMR与鼻咽癌预后的相关研究较少,一些研究报道证明LMR升高意味着单核细胞下降而抗原诱导的淋巴免疫细胞增殖,可能是 NPC患者预后的有利因素[17]。在张晶晶等[18]的研究中,发现LMR值下降提示NPC患者有更晚的分期和更差的预后,但发现LMR下降对总生存的预测作用相对于传统的AJCC分期和EBV-DNA,还是存在一定局限性。而从本研究得到的结果来看,局部晚期鼻咽癌患者外周血的LMR降低是其OS率的独立危险因素。目前LMR对恶性肿瘤患者的OS预测的最佳临界值也没有统一标准,本研究中通过ROC曲线分析得到2.03是预测局部晚期鼻咽癌患者预后不良的最佳临界值,且LMR<2.03是预测局部晚期鼻咽癌患者预后的独立危险因素。
此外,本研究联合了NLR及LMR对局部晚期鼻咽癌患者进行进一步分析后发现,高风险组(NLR≥3.81且LMR<2.03)5年OS率及PFS率明显降低,而低风险组(NLR<3.81且LMR≥2.03)患者的OS及PFS明显改善,提示我们将NLR和LMR联合起来,对局部晚期鼻咽癌患者进行分层分析,能够有效地预测其生存情况。其中,分组为高风险组的患者预后相对较差,在治疗上可以考虑使用如联合靶向治疗、免疫治疗等更积极的肿瘤治疗,以便有机会获得更好的生存。同时,我们在分组分析时发现,高风险组的N3分期的人数所占比例明显升高(高风险组80.0%、中风险组37.1%、低风险组35.6%,组间差异有统计学分析意义,P<0.05),而N分期越晚的患者其远转可能性越高,提示治疗前外周血NLR升高且LMR降低的患者可能有更差的N分期、临床分期及预后。
目前,找寻评估肿瘤预后预测因素的研究较多,但在临床工作中,TNM分期仍是预测鼻咽癌预后的首要方法。但因其有一定的局限性,较难针对个体做出精准的预测。本研究发现,高NLR且低LMR分组中,其N分期相对较晚,预后较差。NLR及LMR易检测,且重复性高,为预测局部晚期鼻咽癌预后提供了一种新的思路。同时,NLR升高与LMR降低都在一定程度上反应了患者免疫抑制状态及免疫功能不全,对于NLR高及LMR低的患者,本研究结果也为其是否采用靶向、免疫等相关治疗可能提供了一定参考价值。
综上所述,治疗前外周血NLR升高及LMR降低能够有效地预测局部晚期鼻咽癌患者放化疗后的OS率及PFS率,提示了治疗前外周血NLR和LMR有望成为预测局部晚期鼻咽癌患者长期生存的重要因素,并且两者联合检测对临床指导意义可能更大。
