mTORC1-TFEB信号通路对肝脏缺血再灌注损伤模型大鼠肝细胞线粒体结构和肝功能的影响*
2023-06-23唐天豪张莹吕宗伟胡玉香黄平张玉潘宁波
唐天豪, 张莹**, 吕宗伟, 胡玉香, 黄平, 张玉, 潘宁波
(1.贵州省人民医院 肝胆外科, 贵州 贵阳 550002; 2.贵州省人民医院 病理科, 贵州 贵阳 550002; 3.贵州省人民医院 信息科, 贵州 贵阳 550002; 4.广元市第一人名医院 胃肠外科, 四川 广元 628040)
肝脏缺血再灌注损伤(hepatic ischemia reperdusion injury,HIRI)是肝脏在遭受严重的缺血缺氧打击后导致肝功能恢复迟缓的并发症,是临床工作中亟待解决的问题。线粒体的结构功能损伤是HIRI的核心问题,而逆转线粒体损伤可有效减轻HIRI[1-3]。转录因子EB(transcription factor EB,TFEB)是一种能够调节细胞代谢、自噬和溶酶体等细胞活动的特殊蛋白,其转录活性受雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)介导的磷酸化机制调控,特异性抑制mTORC1作用的靶点,可减少TFEB磷酸化的发生、从而促进其转录活性[4-5]。近期研究发现,TFEB信号通路在急性肾损伤[6]、心肌[7]和脑[8]缺血再灌注损伤中均具有保护作用,同时TFEB还在细胞内通过维持线粒体自噬和生物发生之间的平衡以调控线粒体变化[9],而此通路在HIRI中研究甚少,本研究初步分析mTORC1-TFEB信号通路在HIRI中对线粒体的影响及意义,以期为HIRI防治提供一定的实验依据。
1 材料与方法
1.1 实验材料
1.1.1实验动物 36只雄性无特定病原体(specific pathogen free,SPF)级Sprague Dawley(SD)大鼠,体质量(240±10)g,购自辽宁长生生物技术股份有限公司,合格证号SCXK(辽)-2020-0001,研究获贵州中医药大学伦理委员会批准(编号20210094);大鼠自由饮食饮水,适应性喂养7 d。
1.1.2主要试剂及仪器 谷草转氨酶(aspartate aminotransferase,AST)试剂盒、谷丙转氨酶(alanine aminotransferase,ALT)试剂盒购自武汉伊莱瑞特生物科技股份有限公司,磷酸化mTORC1(p-mTORC1)一抗购自美国Cell Signaling Technology公司,TFEB一抗购自武汉三鹰生物技术有限公司,3-磷酸甘油醛脱氢酶(glyceraldehyde 3 phosphate dehydrogenase,GAPDH)抗体购自北京索莱宝科技有限公司。引物设计合成购自上海生工生物工程股份有限公司,RNA提取试剂盒购自北京天漠科技开发有限公司,SYBRTM Green PCR试剂盒和High Capacity cDNA 反转录试剂盒购自美国Thermo Fisher Scientific公司。CFX96荧光定量PCR仪、C1000 Thermal Cycler、ChemiDocTMTouch Imaging System凝胶成像分析系统来自美国Bio-Rad公司,JEM-1400PLUS透射电子显微镜来自日本JEOL公司,UCT-RT超薄切片机来自德国Leica公司,Multiskan GO 1510酶标仪来自美国Thermo Fisher Scientific公司,1580R型高速低温冷冻离心机来自丹麦Labogene公司,多功能电泳系统来自美国Hoefer公司。
1.2 动物分组及造模
36只SD雄性大鼠,随机均分为对照组、模型组及药物组,对照组和模型组大鼠术前持续3 d腹腔注射0.9%NaCl溶液(2.0 mL/kg·d),药物组大鼠术前持续3 d腹腔注射雷帕霉素溶液(2.0 mL/kg·d);各组大鼠禁食1 d后,2%戊巴比妥钠腔内注射麻醉,取腹部正中切口,逐层进入腹腔并解剖出第一肝门,模型组和药物组大鼠以无创血管夹夹闭第一肝门、使肝脏完全缺血30 min后取出血管夹,对照组大鼠不夹闭第一肝门,各组大鼠间断缝合关闭腹腔、置于清洁干燥鼠笼待苏醒。分别于术后24 h、72 h两个时间点每组随机取6只大鼠肝脏组织用于后续实验。
1.3 观察指标
1.3.1肝组织形态学特征 取固定在10%中性福尔马林的肝脏组织,常规制成石蜡切片、HE染色,于400倍光学显微镜下观察大鼠肝脏组织学特征,参照组织学活性指数[10]对肝脏组织结果进行计分,计分项包括坏死性炎症计分、结构改变、纤维化和肝硬化。
1.3.2透射电镜观察肝细胞线粒体超微结构 取大鼠肝脏组织切成约1 mm3的组织块,固定于1%饿酸中,梯度乙醇脱水、环氧树脂包埋后超薄切片、枸椽酸铅及醋酸铀双重染色后,嵌入环氧树脂,于8 000倍透射电镜下观察肝细胞内线粒体超微结构变化。
1.3.3检测AST及ALT 取部分肝脏组织,按照重量∶体积(g∶mL)=1∶9的比例加入PBS液,充分研磨匀浆、离心,取上清液按照比色法说明书测定谷草转氨酶(AST)和谷丙转氨酶(ALT)浓度。
1.3.4蛋白印迹实验(Western Blot)检测肝脏组织p-mTORC1、TFEB蛋白的表达 取肝脏组织100 mg研磨、裂解、匀浆后测定蛋白浓度;制备电泳上样样品,取50 μg蛋白进行10%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳分离蛋白、转膜、封闭,加入一抗p-mTORC1(1∶1 000)、TFEB(1∶1 000)孵育过夜,洗净后加入二抗孵育,再次洗净后采用增强化学发光法显色,通过Image lab 5.0凝胶成像系统软件分析目标带的灰度值。
1.3.5实时荧光PCR(RT-PCR)检测肝脏组织p-mTORC1、TFEB mRNA表达 取肝脏组织30 mg提取总mRNA,测定总浓度,使用反转录试剂盒反转录合成cDNA。以cDNA产物作为模板,配置反应体系:qPCR预混液10 μL、正向引物1 μL、反向引物1 μL、cDNA 1 μL、灭菌水7.0 μL。PCR扩增模式:94 ℃ 10 min,(94 ℃ 20 s、55 ℃ 20 s、72 ℃ 20 s)40个循环,以GAPDH蛋白为参照,利用2-ΔΔCT分析相关基因转录情况。引物序列见表1。
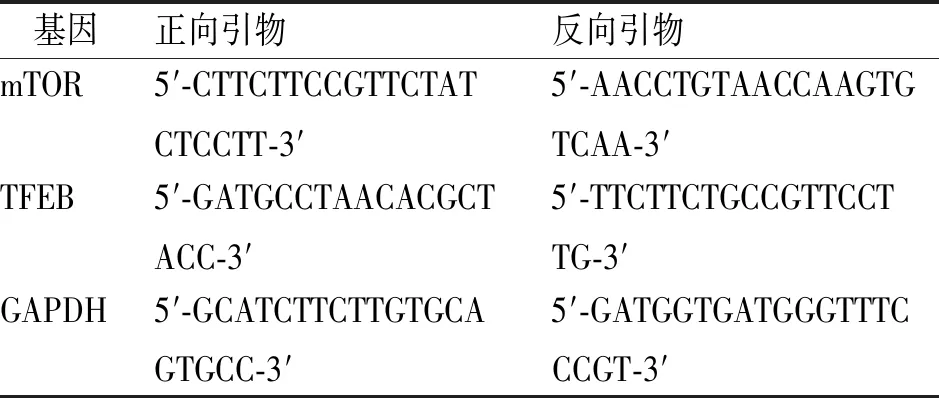
表1 引物序列
1.4 统计学分析
2 结果
2.1 肝组织形态学特征
术后24 h,对照组大鼠肝脏组织形态表现正常、结构完整,组织学活性指数总计分为0分;模型组大鼠肝脏组织中央静脉明显充血,肝小叶结构异常紊乱,肝细胞出现大量水肿、空泡样变性甚至坏死,组织学活性指数总计分显著升高;药物组肝脏组织细胞损伤程度较模型组轻,且组织学活性指数总计分较模型组降低(P<0.05)。术后72 h,对照组较术后24 h无明显变化,组织学活性指数总计分无变化(P>0.05);模型组及药物组肝脏损伤程度相对同组术后24 h减轻(P<0.05),组织学活性指数总计分较模型组均降低,且药物组减轻程度明显优于模型组(P<0.05)。见表2和图1。

图1 术后24及72 h时各组大鼠肝脏组织学(HE,×400)
表2 术后24 及72 h时各组大鼠肝脏组织学活性指数
2.2 肝细胞线粒体超微结构
术后24 h,对照组大鼠肝细胞内线粒体形态正常,大小居中,多呈圆或椭圆形状,内部嵴饱满,膜结构完整;模型组大鼠肝细胞内线粒体肿胀变形甚至破裂,内部嵴断裂严重,内外双层膜结构破损;药物组大鼠肝细胞内线粒体损伤程度较模型组明显减轻。术后72 h,对照组大鼠肝细胞相对术后24 h无明显变化;模型组及药物组大鼠肝细胞内线粒体破坏程度相对同组术后24 h时减轻,且药物组线粒体损伤减轻程度明显优于模型组。见图2。

注:红色箭头所示形态正常的线粒体,黄色箭头所示结构受损严重的线粒体,绿色箭头所示结构受损较轻的线粒体,蓝色箭头所示内质网。
2.3 肝脏组织AST、ALT水平
术后24 h,与对照组相比,模型组及药物组大鼠肝脏的AST、ALT表达水平升高,差异有统计学意义(P<0.05);与模型组相比,药物组大鼠肝脏的AST、ALT表达水平降低,差异有统计学意义(P<0.05)。术后72 h,与对照组相比,模型组及药物组大鼠肝脏AST、ALT表达水平升高,差异有统计学意义(P<0.05);与模型组相比,药物组大鼠肝脏AST、ALT表达水平降低,差异有统计学意义(P<0.05)。与同组术后24 h比较,术后72 h模型组及药物组大鼠肝脏AST、ALT表达水平降低,差异有统计学意义(P<0.05)。见表3。

表3 术后24 及72 h时各组大鼠肝脏组织AST及ALT水平
2.4 肝脏组织p-mTORC1、TFEB蛋白的表达
术后24 h,与对照组相比,模型组及药物组大鼠肝脏组织p-mTORC1蛋白表达水平降低而TFEB 蛋白表达水平升高,差异有统计学意义(P<0.05);与模型组相比,药物组大鼠肝脏的p-mTORC1 蛋白表达水平降低而TFEB蛋白表达水平升高,差异有统计学意义(P<0.05)。术后72 h,与对照组相比,模型组及药物组大鼠肝脏的p-mTORC1蛋白表达水平降低而TFEB蛋白表达水平升高,差异有统计学意义(P<0.05);与模型组相比,药物组大鼠肝脏p-mTORC1 蛋白表达水平降低而TFEB蛋白表达水平升高,差异有统计学意义(P<0.05)。与同组术后24 h比较,术后72 h模型组及药物组大鼠肝脏p-mTORC1蛋白表达水平升高而TFEB蛋白表达水平降低,差异有统计学意义(P<0.05)。见表4和图3。
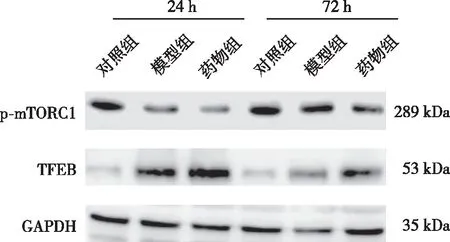
图3 术后24及72 h时各组大鼠肝脏组织p-mTORC1和TFEB蛋白表达

表4 术后24及72 h时各组大鼠肝脏组织p-mTORC1、TFEB蛋白表达
2.5 肝脏组织p-mTORC1、TFEB mRNA表达
术后24 h,与对照组相比,模型组及药物组大鼠肝脏p-mTORC1 mRNA表达水平降低、TFEB mRNA表达水平升高,差异有统计学意义(P<0.05);与模型组相比,药物组大鼠肝脏p-mTORC1 mRNA表达水平降低、TFEB mRNA表达水平升高,差异有统计学意义(P<0.05)。术后72 h,与对照组相比,模型组及药物组大鼠肝脏p-mTORC1 mRNA表达水平降低、TFEB mRNA表达水平升高,差异有统计学意义(P<0.05);与模型组相比,药物组大鼠肝脏p-mTORC1 mRNA表达水平降低、TFEB mRNA表达水平升高,差异有统计学意义(P<0.05)。与同组术后24 h比较,术后72 h模型组及药物组大鼠肝脏p-mTORC1 mRNA表达水平升高、TFEB mRNA表达水平降低,差异有统计学意义(P<0.05)。见表5。

表5 术后24及72 h时各组大鼠肝脏组织p-mTORC1、TFEB mRNA表达
3 讨论
HIRI是指肝脏血供在一定时间内被完全中断,血流急速恢复供应后肝功能却不能及时恢复,甚至会继续增加肝脏结构和功能的破坏程度,进一步诱发多种肝脏并发症。HIRI常发生于肿瘤切除术、肝脏移植术以及重度休克等治疗期间,严重影响患者术后恢复质量。而HIRI发生机制仍不明确,相关研究发现可能与氧化应激反应、线粒体结构功能受损、细胞程序性死亡以及炎症反应等相关[11-13],其中线粒体结构功能的变化在HIRI中更为举足轻重[14]。
肝脏是人体内能量代谢的中枢,是各种生命活动代谢的重要场所,其细胞内富含大量的线粒体,能够为细胞生命活动提供足够的能量补给,因此肝脏线粒体结构功能改变在HIRI中的作用成为近期研究热点[15-17],同时相关实验也发现在HIRI中肝脏损伤的程度与线粒体损伤程度呈正相关[18],抑制线粒体损伤、促进线粒体恢复有助于降低HIRI。TFEB作为人类小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)家族中的一员,在参与调节自噬和溶酶体生物发生的同时,TFEB也在调控细胞内线粒体稳态中发挥着尤其重要的作用[19]。因此有理由推测mTORC1-TFEB信号通路在HIRI中对线粒体有一定影响作用,可通过改善线粒体损伤减轻HIRI。
mTORC1是一组对雷帕霉素敏感的特殊蛋白,主要由Raptor、mLST8和mTOR结合而成,能密切调控细胞生长发育、细胞自噬以及能量代谢[20],其磷酸化机制作用Ser211调控TFEB的亚细胞定位和活性,可导致磷酸化状态的TFEB与细胞质伴侣的酪氨酸3-单加氧酶/色氨酸5-单加氧酶活化蛋白(tyrosine 3-monooxygenase/tryptophan 5-monooxygenase activation protein,YWHAZ/14-3-3)结合后停留在细胞质中失去生物活性;而抑制mTORC1的活性后可促进TFEB发生去磷酸化进行核转移,与细胞核内调控原件结合参与细胞多个生物反应[9,21]。自噬是将被标记的细胞质相关成分送至溶酶体进行生物降解和成分回收利用的一种细胞内稳态机制,可大致分为巨自噬、微自噬以及伴侣自噬[22],而线粒体自噬作为微自噬中的一种形式,以被标记的受损线粒体为主要目标进行识别、融合及降解,对于维持线粒体质量尤其重要[23]。当线粒体在细胞内遭受严重打击时,内膜发生变化通透性增加,启动经典的PINK1/Parkin线粒体自噬途径来清除受损严重的线粒体。TFEB作为自噬通路的关键因子,可以通过上调自噬通路相关蛋白的表达水平参与线粒体自噬,从而吞噬受损的线粒体[6],并且TFEB的过表达还可以减少线粒体损伤进一步累积,达到减轻线粒体损伤的目的[24]。因此在本研究中,再灌注早期(24 h)时,模型组TFEB正常活化过程受阻,导致线粒体损伤累积过重无法被及时清除,在电镜下观察到的线粒体肿胀破坏严重,形态结构不复存在,残存的正常线粒体为数不多,肝脏组织破坏严重且肝功能明显受损;药物组在特异性抑制剂雷帕霉素的预处理下,p-mTORC1蛋白和mRNA的表达较模型组明显降低,而TFEB蛋白和mRNA的表达较模型组显著升高,TFEB过表达后启动生物反应,损伤严重的线粒体能够及时被清除,因此电镜下观察到的线粒体破坏程度较模型组显著减轻,尚未完全损坏,膜结构相对完整,而且肝脏组织结构、功能损伤程度明显减轻,肝细胞变性、坏死以及肝组织中AST、ALT表达水平较模型组明显下降。TFEB不仅通过上调自噬活性减轻线粒体损伤的积累,同时还可以诱导线粒体生物发生,从而减轻线粒体损伤并促进线粒体恢复[25]。再灌注晚期(72 h)时,药物组TFEB的相关表达仍处于一个高水平状态,线粒体形态恢复效果明显优于模型组,AST、ALT表达水平下降明显,肝脏恢复程度也明显优于模型组,提示促进线粒体恢复,可降低HIRI,促进肝功能恢复。
综上所述,mTORC1-TFEB信号通路激活后通过减轻线粒体损伤、促进线粒体恢复,从而改善肝功能、降低肝脏缺血再灌注损伤程度。
