circRNA_001653对急性心肌梗死心肌细胞凋亡的作用及机制*
2023-06-23李川谢景臣赵展庆
李川, 谢景臣, 赵展庆**
(1.海南西部中心医院 重症医学科, 海南 儋州 571799; 2.海南西部中心医院 呼吸内科, 海南 儋州 571799)
急性心肌梗死(acute myocardial infarction, AMI)由心脏冠状动脉氧气和营养供应不足导致,以心肌细胞不可逆转的凋亡、急性或持续性心肌缺血缺氧引起的心肌坏死为特征[1-3]。最近研究表明,一些非编码RNA(non coding RNAs),如环状RNA(circular RNAs, circRNA)或微小RNA(microRNAs, miRNA)可以作为基因调控网络中的分子,参与AMI发生和发展中的多种生物学机制[4-5]。本研究通过筛选高通量基因表达(gene expression omnibus, GEO)数据库发现hsa-circ_001653在AMI中表达增强,但是其影响AMI的潜在分子机制仍有待进一步探讨。miR-324-5p是miRNAs中一员,有研究显示其高表达能够减少心肌细胞凋亡、改善心脏功能、并在AMI中发挥保护作用[6]。ELAV样RNA结合蛋白1(ELAV RNA-binding protein 1, ELAVL1)基因也被称为HuR,其作为一种RNA结合蛋白,能够对细胞增殖凋亡等生物学行为进行调控,有研究表明ELAVL1能够通过调控CUGBP1促进心肌细胞凋亡,加重AMI进展[7]。本研究拟探讨circRNA_001653对AMI大鼠心肌细胞凋亡的作用及其潜在分子机制,从而为研究AMI的分子靶向治疗手段开辟新的思路。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 大鼠心肌细胞H9C2购自美国典型菌种保藏中心。
1.1.2主要试剂与仪器 miRNA模拟物由上海吉玛公司设计并合成;RNeasyMinElute试剂盒(沃森生物)、荧光原位杂交(fluorescence in situ hybridization, FISH)试剂盒、Annexin V-FITC/PI凋亡检测试剂盒、原位末端标记法(TdT-mediated dUTP nick end labeling, TUNEL)试剂盒及免疫组织化学试剂盒(碧云天生物),RNA免疫沉淀(RNA immunoprecipitation, RIP)试剂盒(吉赛生物),TRIzol试剂盒(美国Thermo Fisher),逆转录和SYBRPremixEXTaq试剂盒(日本Takara),放射免疫沉淀法缓冲液(radioimmunoprecipitation assay buffer, RIPA)裂解液和二喹啉甲酸(bicinchoninic acid, BCA)试剂盒(博士德生物),相关抗体(美国Abcam),含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific protease 3, Caspase-3)、Caspase-9活力试剂盒(纪宁实业),1%的2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazoliumchloride, TTC)溶液(森贝伽生物),腺病毒纯化浓缩试剂盒(德国Millipore),萤光素酶报告载体(美国Life Technologies);低氧培养箱(E5019,北京艾克赛仑),倒置荧光显微镜(LF200,广州莱特光电),酶标仪(SpectraMax 190,美谷生物),紫外分光光度计(Alpha-1900Splus,上海谱元),流式细胞仪(FACSCantoⅡ,美国BD)。
1.2 研究方法
1.2.1生物信息分析 从国家生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库获取AMI相关芯片信息(GSE160717)并进行分析,差异circRNAs筛选条件为Padj<0.05和|logFC|≥2。通过circinteractome(https://circinteractome.nia.nih.gov/)得到circRNA和miRNA的特异性结合位点,在miRDB(http://mirdb.org/index.html)获取miRNA的下游靶基因,通过注释可视化和集成发现数据库(the Database for Annotation, Visualization and Integrated Discovery,DAVID;https://david.ncifcrf.gov/home.jsp.)进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析,使用DisGeNET数据库(https://www.disgenet.org)查询与AMI相关的基因,借助String 数据库(https://string-db.org)用于分析蛋白间互作用关系。
1.2.2细胞培养和处理 H9C2细胞置于含10%胎牛血清(fetal bovine serum, FBS)、1%青霉素/链霉素(penicillin/streptomycin, P/S)的高糖培养基中,在37 ℃含5%CO2的条件下培养。常氧条件下培养的细胞被设置为Normoxia组;缺氧条件下(1%O2、5%CO2及94%N2)培养的细胞被设置为Hypoxia组,依据缺氧不同时间(12 h、24 h及48 h)将缺氧细胞分为Hypoxia 12 h组、Hypoxia 24 h组、Hypoxia 48 h组。此外,细胞缺氧诱导48 h前转染相应载体并分为sh-NC组(细胞转染sh-circ_001653阴性对照载体、缺氧诱导48 h)、sh-circ_001653组(细胞转染sh-circ_001653载体、缺氧诱导48 h)、circ-NC组(细胞转染circ_001653阴性对照载体、缺氧诱导48 h)、circ_001653组(细胞转染circ_001653载体、缺氧诱导48 h)、circ_001653+miR-NC组(细胞转染circ_001653和miR-NC载体、缺氧诱导48 h)、circ_001653+miR-324-5p mimic组(细胞转染circ_001653和miR-324-5p载体、缺氧诱导48 h)、miR-NC组(细胞转染miR-NC载体、缺氧诱导48 h)、miR-324-5p mimic组(细胞转染miR-324-5p、缺氧诱导48 h)、miR-324-5p mimic+pcDNA3.1组(细胞转染miR-324-5p mimic和pcDNA3.1、缺氧诱导48 h)、miR-324-5p mimic+ELAVL1组(细胞转染miR-324-5p mimic和ELAVL1、缺氧诱导48 h),转染步骤依据LipofectamineTM3000试剂盒说明书完成。
1.2.3实时荧光定量PCR(real-time quantitative PCR,RT-qPCR) 收集“1.2.2”项下Normoxia组、Hypoxia 12 h组、Hypoxia 24 h组及Hypoxia 48 h组细胞,用TRIzol试剂盒提取细胞中的总RNA,使用分光光度计测定RNA的浓度和纯度;使用逆转录试剂盒将RNA逆转录成互补DNA(complementary DNA,cDNA),以上述cDNA为模板,分别扩增各个基因及内参片段后用SYBRPremixEXTaq试剂盒进行实时荧光定量PCR实验,引物序列见表1。设置反应程序为95 ℃ 10 min,95 ℃ 30 s、60 ℃ 20 s、72 ℃ 15 s。用2-ΔΔCt法计算mRNA 相对表达量,miR-324-5p内参为U6、circ_001653和ELAVL1内参为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)。

表1 RT-qPCR序列
1.2.4Caspase-3及Caspase-9活性检测 采用Caspase-3、Caspase-9试剂盒检测各组细胞中Caspase-3及Caspase-9活性。收集“1.2.2”项下Normoxia组、Hypoxia 48 h组、sh-NC组、sh-circ_001653组、circ-NC组、circ_001653组、circ_001653+miR-NC组、circ_001653+miR-324-5p mimic组、miR-NC组、miR-324-5p mimic组、miR-324-5p mimic+pcDNA3.1组、miR-324-5p mimic+ELAVL1组细胞,4 ℃下500 r/min离心2~3 min,收集细胞;使用预冷的PBS洗涤细胞2~3次,取上清;细胞中加预冷的裂解缓冲液100 μL,振荡离心后置于冰上保存备用。Bradford 法进行蛋白定量,取含20~50 μg蛋白的裂解上清10 μL,加入显色底物10 μL,37 ℃避光反应1~2 h后测定450 nm处吸光度(absorbance,A)值确定Caspase 3和Caspase-9活性程度。
1.2.5细胞凋亡检测 取“1.2.2”项下Normoxia组、Hypoxia-48 h组、sh-NC组、sh-circ_001653组、circ-NC组、circ_001653组、circ_001653+miR-NC组、circ_001653+miR-324-5p mimic组、miR-NC组、miR-324-5p mimic组、miR-324-5p mimic+pcDNA3.1组、miR-324-5p mimic+ELAVL1组细胞,用Annexin V-FITC/PI凋亡检测试剂盒检测细胞凋亡情况。加适量0.25%胰蛋白酶消化,制成单细胞悬液,4 ℃下1 000 r/min离心5 min;弃上清,PBS洗涤2~3次再次离心,使用Binding buffer 500 μL重悬细胞,添加Annexin V-FITC和Propidium Iodide(PI)染色液各5 μL,混匀后避光孵育20 min,流式细胞仪检测细胞凋亡。
1.2.6核糖核酸酶R(ribonuclease R, RNase R)试验 按RNeasyMinElute试剂盒说明书进行操作,收集“1.2.2”项下Hypoxia-48 h组细胞、用TRIzol法提取细胞总RNA。将细胞分为实验组(RNase R 处理,RNase R+)与对照组(等量的双蒸馏水,RNase R-),在同一样本中取RNA 10 μg ,分别加入2组中,37 ℃孵育20 min,RNase R消化后采用RT-qPCR测定浓度。
1.2.7荧光原位杂交(fluorescence in situ hybridization,FISH)实验 收集“1.2.2”项下Hypoxia-48 h组细胞,采用FISH试剂盒检测circ_001653的亚细胞定位,滴预杂交液孵育60 min,去除预杂交液后滴加杂交液(含探针 circ_001653),35 ℃杂交过夜。杂交后柠檬酸钠(saline sodium citrate, SSC)溶液洗去杂交液,滴加4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole, DAPI)染液,室温避光孵育10 min,PBS 洗涤后滴加抗荧光淬灭封片剂封片,倒置荧光显微镜拍照。
1.2.8萤光素酶活性测定 收集“1.2.2”项下Hypoxia-48 h组细胞,分别采用circinteractome和miRDB数据库预测circ_001653、ELAVL1的3′-非翻译区(UTR)区与miR-324-5p的特异性结合位点。将含有miR-324-5p结合位点的circ_001653、ELAVL1的 3′-UTR序列克隆到萤光素酶报告载体,将携带野生型(wild type,WT)和突变型(mutant type,MUT)circ_001653、ELAVL1的 3′-UTR序列的报告载体分别与miR-324-5p mimic 或miR-324-5p-NC两两共转染至细胞,转染48 h后对萤光素酶活性进行测定,萤光素酶活性为萤火虫萤光素酶和海肾荧光素酶的比值。
1.3 统计学分析
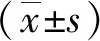
2 结果
2.1 circ_001653表达
AMI相关芯片GSE160717中包含3个AMI患者样本和3个正常对照样本的circRNAs信息,筛选后发现66个circRNAs在AMI中表达上调,其中circ_001653在AMI患者中的表达较正常对照组显著上调。之后检测circ_001653在Hypoxia处理的原代心肌细胞中的表达水平,结果显示,原代心肌细胞在Hypoxia处理后,circ_001653的表达水平在12 h、24 h、48 h时间点呈时间依赖性升高(P<0.05)。见图1。
注:A为芯片检测出的132个差异circRNAs,B为差异表达的circRNAs热图(红色表示上调miRNA,蓝色表示下调miRNA),C为H9C2细胞中circ_001653的RT-qPCR检测结果;(1)与Normoxia组比较,P<0.05。
2.2 Caspase-3、Caspase-9的活力及细胞凋亡
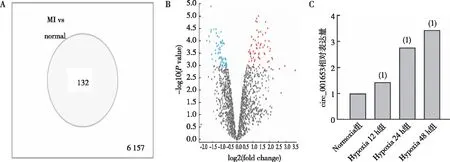
与Normoxia组相比,Hypoxia 48 h组大鼠心肌细胞H9C2细胞凋亡率增加(P<0.05),Caspase-3、Caspase-9活力升高(P<0.05);与sh-NC组相比,sh-circ_001653组细胞凋亡率降低,Caspase-3、Caspase-9活力减弱(P<0.05)。见图2。
注:A为流式细胞术检测细胞凋亡率情况,B为细胞凋亡率定量结果,C、D分别为Caspase-3和Caspase-9活力测定;(1)与Normoxia组比较,P<0.05;(2)与sh-NC组比较,P<0.05。
2.3 miR-324-5p与circ_001653的结合关系
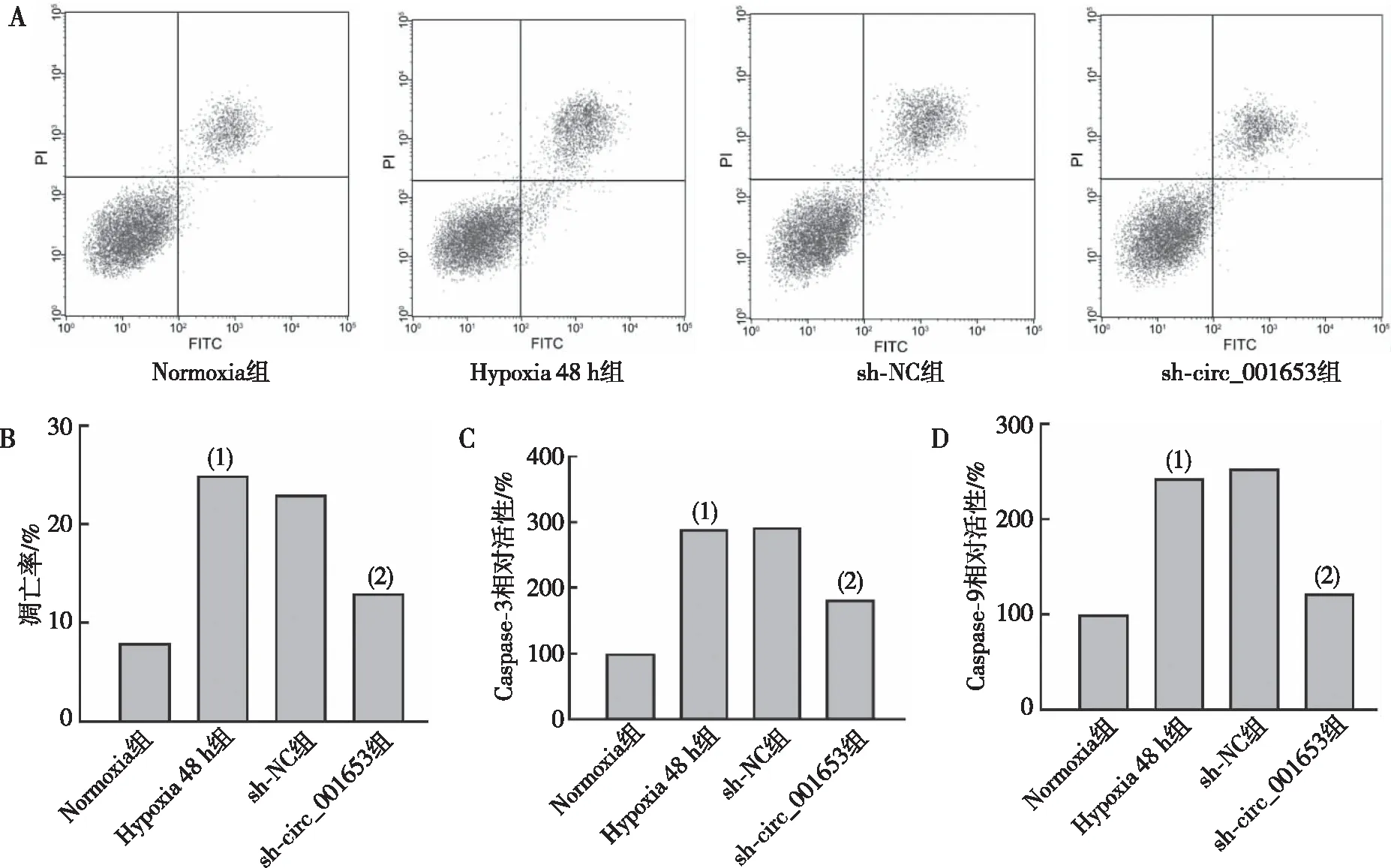
RNase确定circ_001653的环状结构(图3A),FISH技术对circ_001653表达进行定位,发现其主要在胞质中表达(图3B);为进一步探究circ_001653和miR-324-5p的潜在作用机制,借助靶向关系在线预测网站数据库得到特异性结合位点(图3C);双萤光素酶报告实验结果显示(图3D),相对于circ_001653-WT和miR-NC共转染组,circ_001653-WT和miR-324-5p mimic共转染组荧光素酶活性降低(P<0.05)。
注:A为RNase实验结果,B为FISH实验结果(红色表示细胞质,蓝色表示细胞核,400×),C为靶向关系预测结果,D为双萤光素酶分析报告实验结果;(1)与RNase R-组比较,P<0.05;(2)与miR-NC组比较,P<0.05。
2.4 miR-324-5p表达及circ_001653对缺氧诱导心肌细胞的影响
与Normoxia组比较,Hypoxia处理后的原代心肌细胞中miR-324-5p表达于12 h、24 h 及48 h,呈时间依赖性下降(P<0.05);与circ-NC组相比,circ_001653组细胞凋亡率增加(P<0.05),Caspase-3及Caspase-9活力升高(P<0.05);与circ_001653+miR-NC组相比,circ_001653+miR-324-5p mimic组细胞凋亡率、Caspase-3及Caspase-9活力均下降(P<0.05)。见图4。
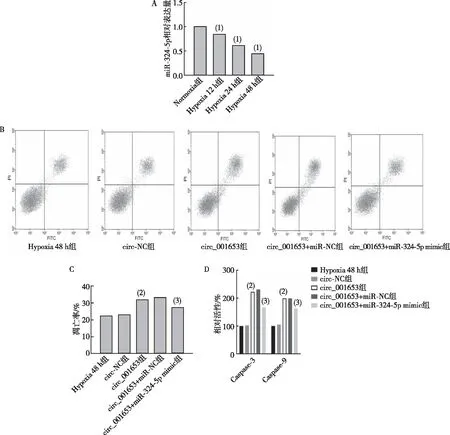
注:A为流式细胞术检测细胞凋亡情况,B为各组细胞中miR-324-5p的RT-qPCR检测结果,C为各组细胞凋亡率统计,D为Caspase-3及Caspase-9活力测定;(1)与Normoxia组相比,P<0.05;(2)与circ-NC组比较,P<0.05;(3)与circ_001653+miR-NC组比较,P<0.05。
2.5 ELAVL1与miR-324-5p的靶向关系
miRDB数据库预测得到264个miR-324-5p的下游靶基因,通过DAVID数据库进行KEGG富集分析,结果显示有48个基因显著富集通路(图5A);腺苷酸激活蛋白激酶[adenosine 5′-monophosphate (AMP)-activated protein kinase,AMPK]信号通路(P=0.016 92,Fold Enrichment=3.95×105)是AMI进展中的一条重要通路,该通路中包括6个基因[6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶4(6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 4,PFKFB4)、人肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)、蛋白质磷酸酶2调节亚基5D(protein phosphatase 2, regulatory subunit 5D,PPP2R5D)、胰岛素样生长因子-1(insulin-like growth factor,IGF1)、ELAV样RNA结合蛋白1(ELAV like RNA binding protein 1,ELAVL1)及叉头框蛋白O1(forkhead box O1,FOXO1)],结合以往文献分析后、最终将ELAVL1纳入本研究,图5B表明了miR-324-5p与ELAVL1的特异性结合位点,双萤光素酶报告实验证实ELAVL1确为miR-324-5p的直接靶点(图5C)。
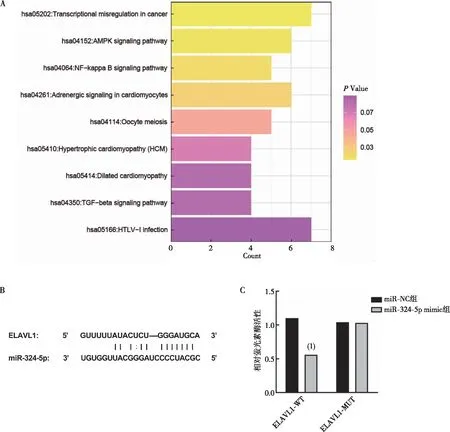
注:A为KEGG富集分析结果(颜色由红色到黄色表示P值由大到小),B为靶向结合序列,C为双萤光素酶报告实验结果;(1)与miR-NC组比较,P<0.05。
2.6 ELAVL1和miR-324-5p对缺氧处理心肌细胞的作用
与Normoxia组相比,ELAVL1在Hypoxia呈时间依赖性提高,且在缺氧诱导48 h达到最高(P<0.05);与miR-NC组相比,miR-324-5p mimic组细胞凋亡率、Caspase-3及Caspase-9活力均下降(P<0.05);与miR-324-5p mimic+pcDNA3.1组相比,miR-324-5p mimic+ELAVL1组细胞凋亡率、Caspase-3及Caspase-9活力均升高(P<0.05)。见图6。
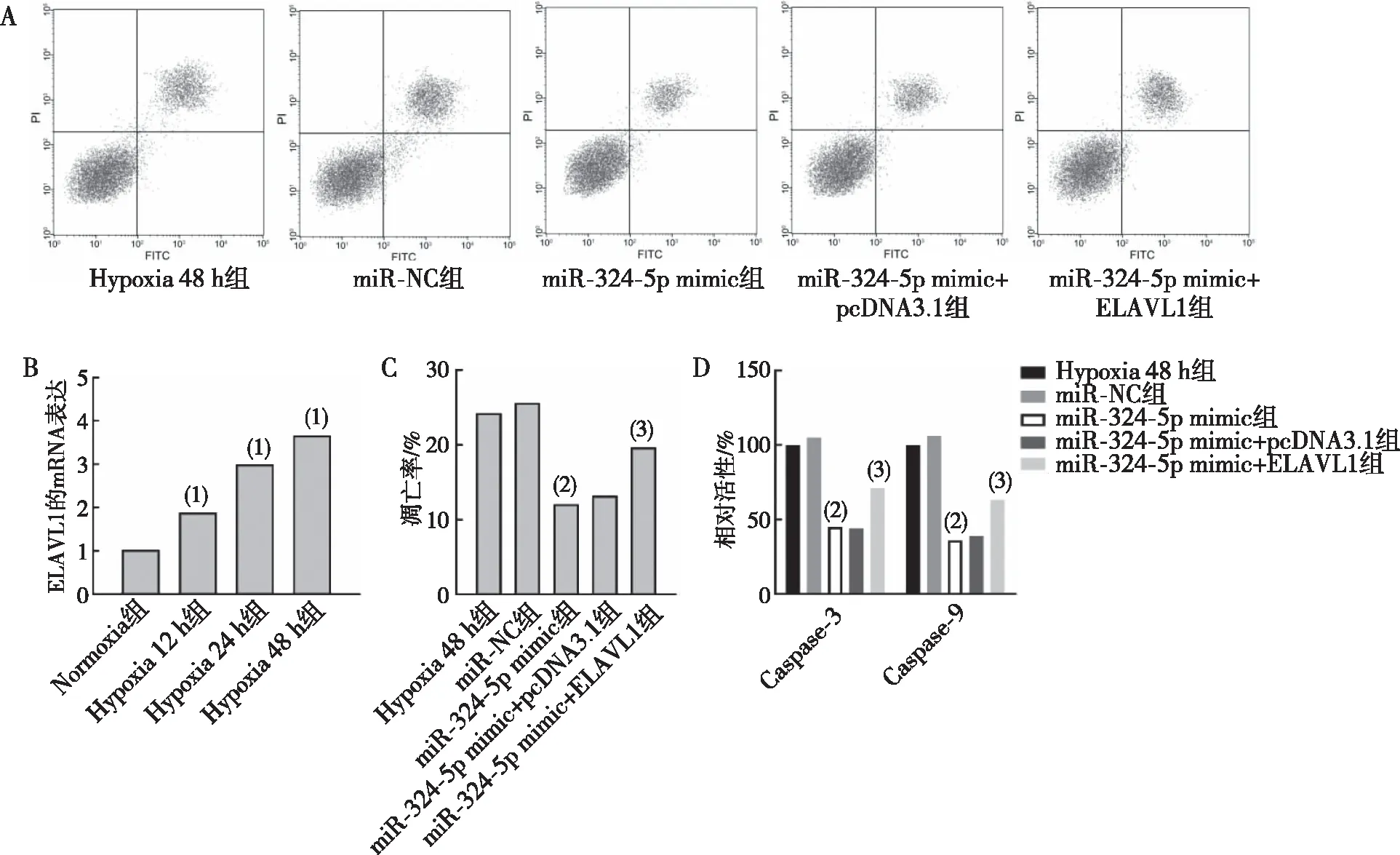
注:A为各组细胞凋亡检测结果,B为各组细胞ELAVL1的mRNA表达检测结果,C为各组细胞凋亡率统计结果,D为各组细胞Caspase-3及Caspase-9活性;(1) 与Normoxia组比较,P<0.05;(2) 与miR-NC组比较,P<0.05;(3) 与miR-324-5p mimic+pcDNA3.1组比较,P<0.05。
3 讨论
发生AMI后,梗死边缘区的缺血应激可诱导存活心肌细胞凋亡,促进心肌在缺氧等环境刺激下发生心室重构和心力衰竭[8-10],AMI也是影响心血管疾病患者存活率和生活质量的重要因素[11]。研究心肌细胞凋亡和抗凋亡机制,并且在AMI发生的早期干预心肌细胞凋亡可以显著改善AMI的预后[12-14]。缺氧是导致AMI的主要危险因素,缺氧会引起心肌细胞代谢紊乱、功能异常,从而引发心肌细胞损伤和凋亡[15-16]。本研究在体外环境下构建缺氧处理的心肌细胞模型,探究circ_001653对AMI体外心肌细胞模型凋亡的影响,以期明确其与AMI发生发展的密切关系,对防治AMI具有重要意义。本研究结果表明,缺氧诱导的心肌细胞中circ_001653呈高表达,且于48h达到最高,提示其可能在AMI的进展中发挥作用。此外,敲减心肌细胞中circ_001653的表达,结果显示心肌细胞凋亡率下降,Caspase-3、Caspase-9的活力降低,这也初步明确circ_001653可能通过调节缺氧诱导的心肌细胞凋亡等参与了AMI的进程。
随后本研究通过生物信息学在线预测网站获取了circ_001653的潜在结合靶点,将miR-324-5p纳入研究并在体外验证了circ_001653与miR-324-5p轴之间的关系。既往研究已表明miR-324-5p在心肌细胞氧化应激和凋亡中起调节作用,可通过调节MTFR进而抑制线粒体分裂、细胞凋亡及心肌梗死[17]。本研究同样发现在缺氧处理的心肌细胞中miR-324-5p的表达也呈时间依赖性减少,功能实验进一步证实了circ_001653过表达能够促进缺氧诱导的心肌细胞的凋亡;加入miR-324-5p后,circ_001653对心肌细胞的作用被部分挽救,提示circ_001653可以通过靶向结合miR-324-5p进而调控心肌细胞的凋亡。
为了更好地了解circ_001653在AMI中的作用,进一步寻找miR-324-5p的下游靶点,通过KEGG富集分析,在富集通路中发现了AMPK信号通路,AMPK信号通路被证实是影响AMI进展的重要通路[18-19]。因此,选择对富集在AMPK通路中的基因进行分析,将AMPK信号通路中的基因与AMI的疾病风险基因进行蛋白相互作用分析并且结合以往文献[7],最终将ELAVL1纳入研究。之后本研究证实了miR-324-5p对ELAVL1有负调控作用,进一步发现,miR-324-5p在缺氧诱导的心肌细胞凋亡中的抑制作用可以被过表达ELAVL1部分逆转。
综上所述,本研究探讨了circ_001653在AMI过程中的作用,结果表明circ_001653可通过吸附miR-324-5p,上调ELAVL1的表达,促进心肌细胞凋亡,本研究从体外实验的角度为AMI的发病机制与治疗手段的探索提供了新的线索。
