辣椒素对CIA大鼠关节滑膜组织抗炎作用及机制*
2023-06-23李雨王杰陈铭勰艾丽霞张耀文何子晗吴遵秋李蓉
李雨, 王杰, 陈铭勰, 艾丽霞, 张耀文, 何子晗, 吴遵秋*, 李蓉*
(贵州医科大学 基础医学院, 贵州 贵阳 550025)
类风湿性关节炎(rheumatoid arthritis,RA)是一种发病率较高的慢性自身免疫性疾病,基本病理表现为关节滑膜炎症、滑膜组织过度增生及血管翳形成,并逐渐出现关节软骨和骨破坏,最终导致关节畸形和功能丧失[1-3]。治疗RA的药物主要有非甾体抗炎药物、糖皮质激素类药物、生物制剂等,但存在不良反应较多或价格昂贵等缺点[4-6],所以新型药物的研发备受重视,辣椒素等中药有效单体成分已成为近年来研究的新热点[7]。辣椒素(capsaicin,CAP)是辣椒中最主要的生物活性成分[8-9],具有抗炎、抗肿瘤及抗氧化等药理作用[10],可作为类风湿性关节炎的神经调节剂[11],且有研究证明P38MAPK信号通路与类风湿性关节炎的炎症细胞激活、滑膜异常增生等病理过程密切相关[12],被认为是细胞信息传递的交汇点和共同通路,目前未见CAP通过P38MAPK信号通路治疗RA炎症的报道,因此本研究建立胶原诱导性关节炎(collagen induced arthritis,CIA)大鼠模型,基于P38MAPK信号通路探究CAP对 CIA 模型大鼠的抗炎作用及其机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 清洁级雄性Sprague Dawley(SD)大鼠48只,由贵州医科大学动物中心提供[SYXF(黔)2018-0001]。
1.1.2主要试剂与仪器 辣椒素(CATO公司),不完全弗氏佐剂(Incomplete Freund's Adjuvant,IFA,美国Sigma),牛Ⅱ型胶原蛋白(美国Chondrex),大鼠IL-17 ELISA试剂盒(杭州联科生物技术股份有限公司),逆转录试剂盒(索莱宝科技有限公司),β-actin、p-MKK3、p-P38MAPK、MMP-13、Casepase-3抗体、HRP标记的山羊抗兔IgG(华安生物科技公司);水平电泳槽(DYY-DI 31D,北京六一仪器厂),冷冻高速离心机(美国thermo公司),高压蒸汽灭菌锅(上海申安医疗器械厂),超净工作台(吴江市伟峰净化设备有限公司),Quanity One凝胶成像分析系统(美国BIO-RAD公司),DYY-5型稳压稳流电泳仪(北京六一仪器厂),酶标仪(美国 BioTek),实时荧光定量PCR仪(美国ABI)。
1.2 研究方法
1.2.1动物分组 48只雄性SD大鼠,随机分成空白组(normal,Nor组)、模型组(model,Mod组)、雷公藤治疗组(tripterygium wilfordii,GTW组)及CAP高(3 mg/kg)、中(2 mg/kg)、低剂量(1 mg/kg)组,每组8只。
1.2.2CIA大鼠模型的建立 将牛Ⅱ型胶原蛋白与IFA 按1∶1充分乳化,40只大鼠尾根部皮下注射0.2 mL上述乳剂进行初次免疫,1周后于大鼠足跖部皮下注射0.1 mL上述乳剂加强免疫[13-14];Nor组大鼠采用等体积生理盐水代替。加强免疫1周后,通过关节炎指数(arthritis index,AI)评分判定造模情况。
1.2.3给药 造模2周后,CAP高、中、低剂量组分别给予3 mg/kg、2 mg/kg、1 mg/kg的CAP溶液灌胃,GTW组给予40 mg/kg雷公藤溶液灌胃,Nor组及Mod组给予10 mL/kg生理盐水灌胃,每日1次,连续给药3周[15]。
1.3 观察指标
1.3.1大鼠足肿胀度及AI测定 于造模前1 d至灌胃给药3周后,每周测量1次大鼠足容积,测量方法为:使用导管连接同等大小两个注射器,右侧注射器使用马克笔标注并加水至标注处,以大鼠后足踝关节转折部位处为界限并标记,将大鼠足爪浸入至左侧注射器,抽取右侧注射器上升的水至标注处,读取抽取的水体积数即为大鼠的后侧足容积[16];并于灌胃给药前1 d至灌胃给药3周后,每周进行1次大鼠右后足AI评分,总分为4分,AI评分标准见表1[17]。

表1 AI评分标准
1.3.2大鼠滑膜组织学特征 灌胃给药3周后,将各组大鼠的膝关节处滑膜组织取出,使用10%中性甲醛固定,15%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)脱钙,梯度乙醇及二甲苯脱水透明,常规石蜡包埋切片,HE染色,光学显微镜下观察滑膜组织学特征。
1.3.3大鼠血清IL-17含量 灌胃给药3周后,将大鼠心脏取出的全血室温静置20 min,3 000 r/min离心15min后取血清,按照测试试剂盒的说明书,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测定大鼠血清样品的IL-17含量,在450 nm波长下采用酶标仪测定其吸光度值,通过绘制标准曲线计算各组样本浓度。
1.3.4大鼠滑膜组织中MKK3、P38MAPK、MMP-13和Caspase-3 mRNA表达 灌胃给药3周后,取大鼠滑膜组织加氯仿、振荡、静置,离心取上清后加异丙醇、静置,离心弃上清后加75%乙醇、洗涤沉淀、弃上清,晾干、加入DEPC 水溶解后得到RNA样品;取RNA样品水溶液1 μL于超微量紫外分光光度计上测A 260/A 280值,测定后配制逆转录反应体系将RNA逆转录为cDNA,采用实时荧光定量PCR(quantitative realtime PCR,qPCR)检测滑膜组织中MKK3、P38MAPK、MMP-13和Caspase-3 mRNA表达。qPCR条件为:预变性95 ℃ 30 s;循环反应,95 ℃ 10 s,60 ℃ 30 s,循环40次;溶解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。用2-ΔΔCt计算法处理数据。引物序列见表2。

表2 RT-PCR引物序列
1.3.5大鼠滑膜组织中p-MKK3、p-P38MAPK、MMP-13和Caspase-3蛋白表达 灌胃给药3周后,取出大鼠滑膜组织,加入放射免疫沉淀(radio immunoprecipitation assay,RIPA)裂解液、苯甲基碘酰氟(phenylmethanesulfonyl fluoride,PMSF)、磷酸酶抑制剂及蛋白酶抑制剂进行研磨,提取出蛋白质,采用BCA法测量提取的蛋白质浓度后,制胶、上样、电泳、转膜,用5%脱脂奶封闭2 h,分别加入一抗β-actin抗体、p-MKK3抗体、p-P38MAPK抗体、MMP-13抗体、Caspase-3抗体(1∶1 000),4 ℃过夜,洗膜,二抗(1∶10 000)孵育2 h,洗膜,曝光显影,使用Image J软件对蛋白条带灰度值进行分析。
1.4 统计学分析
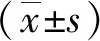
2 结果
2.1 大鼠足肿胀度
与Nor组相比,Mod组大鼠足肿度增大(P<0.001)。与Mod组相比,灌胃3周后GTW组大鼠足肿度明显减小(P<0.001),CAP高剂量组、中剂量组足肿度减小(P<0.01),CAP低剂量组足肿度有所减小(P<0.05);CAP 高剂量组与GTW组相比,差异无统计学意义(P>0.05)。见表3。
表3 大鼠足肿度
2.2 大鼠右后足AI评分
与Nor组相比,Mod组大鼠AI评分显著升高(P<0.001)。与Mod组相比,灌胃3周后各给药组大鼠AI评分均降低,且CAP 高剂量组、GTW 组明显降低,差异有统计学意义(P<0.01,P<0.05)。见表4。

表4 大鼠右后足AI评分
2.3 大鼠滑膜组织学特征
Nor组大鼠未见成簇的滑膜细胞、炎性细胞浸润及血管翳形成;与Nor组相比,Mod组大鼠滑膜组织有明显的炎性细胞浸润、大量成纤维细胞聚集和血管增生,部分区域软骨陷窝基本消失。与Mod组相比,GTW组大鼠滑膜组织有少量炎性细胞浸润、成纤维细胞聚集及滑膜组织轻度充血;CAP 低剂量组炎性细胞浸润有所改善,软骨组织中度增生,部分软骨细胞肿胀坏死;CAP 中剂量组滑膜衬里下层大量纤维组织增生,且出现由软骨破坏导致的关节翳形成,疑似个体差异;CAP 高剂量组关节腔内滑膜组织充血明显减轻,未见明显炎性细胞浸润,也未见成纤维细胞成簇及分布密度改变。见图1。

注:A为CAP高剂量组;B为CAP中剂量组;C为CAP低剂量组;D为Mod组;E为GTW组,F为Nor组。
2.4 大鼠血清IL-17含量
与Nor组相比,Mod组大鼠血清中IL-17含量明显升高(P<0.01)。与Mod组相比,CAP高剂量组和GTW组血清中IL-17含量显著降低(P<0.01)、CAP 中剂量组血清中IL-17含量降低(P<0.05);而CAP低剂量组与Mod组相比,差异无统计学意义(P>0.05)。见表5。

表5 大鼠血清IL-17含量
2.5 大鼠滑膜组织中MKK3、P38MAPK、MMP-13和Caspase-3 mRNA的表达
与Nor组相比,Mod组大鼠MKK3、P38MAPK、MMP-13 mRNA表达升高(P<0.01),Caspase-3 mRNA表达降低(P<0.01)。与Mod组相比,CAP高剂量组和GTW组MKK3、P38MAPK、MMP-13mRNA表达降低(P<0.05),Caspase-3 mRNA表达升高(P<0.01);CAP中、低剂量组MKK3、P38MAPK、MMP-13和Caspase-3mRNA表达,差异无统计学意义(P>0.05)。 见图2。

注:(1)与Nor组比较,P<0.05;(2)与Mod组比较,P<0.05;(3)与GTW组比较,P<0.05。
2.6 大鼠滑膜组织中p-MKK3、p-P38MAPK、MMP-13和Caspase-3蛋白表达
与Nor组相比,Mod组大鼠p-MKK3、p-P38MAPK、MMP-13蛋白表达升高(P<0.01),Caspase-3蛋白表达降低(P<0.01)。与Mod组相比,CAP高剂量组和GTW组大鼠p-MKK3、p-P38MAPK、MMP-13蛋白表达降低(P<0.01),Caspase-3蛋白表达升高(P<0.01);CAP 中、低剂量组p-MKK3、p-P38MAPK、MMP-13和Caspase-3蛋白表达,差异无统计学意义(P>0.05)。见图3。
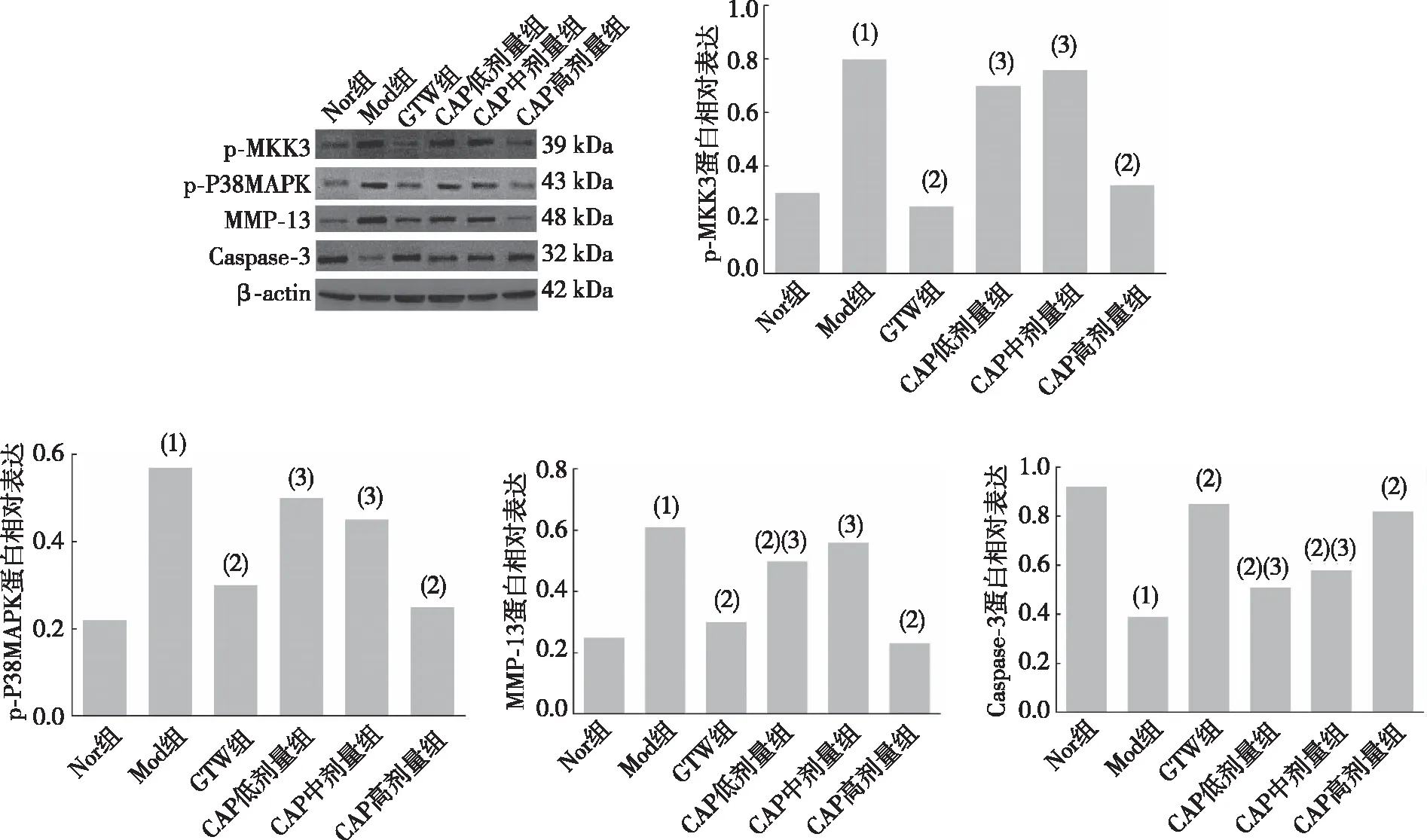
注:(1)与Nor组比较,P<0.05;(2)与Mod组比较,P<0.05;(3)与GTW组比较,P<0.05。
3 讨论
RA是一种以侵蚀性、对称性多关节炎为主要临床表现的慢性、全身性自身免疫性疾病,病理变化以关节滑膜炎症为主[18-19]。本研究通过牛Ⅱ型胶原与IFA造模后,造模组与Nor组大鼠相比,造模组大鼠后踝关节出现明显肿胀、畸形,AI评分明显升高,提示造模成功。经药物治疗3周后,病理切片可看出Mod组大鼠大量炎性细胞浸润、成纤维细胞聚集;而CAP 高剂量组和GTW组病理变化明显减轻,仅见少量炎性细胞浸润和成纤维细胞聚集,提示CAP在缓解RA炎症方面有良好的作用。
已有研究证明RA可导致P38MAPK信号通路异常激活,而异常激活的P38MAPK信号通路又进一步加重RA的炎性反应[20-21]。P38是丝裂原活化蛋白激酶(MAPK)家族中控制RA炎性反应最重要的成员;MKK3是P38MAPK活化所必须的上游因子,过量磷酸化的MKK3可加重RA滑膜炎症;MMP-13是P38MAPK的重要下游因子,活化的P38MAPK可通过上调MMP-13的表达导致Ⅱ型胶原进行性降解、促进滑膜细胞增生[22-23];此外,被激活的P38MAPK还可上调介导RA炎症的促炎因子IL-17表达[24],下调促进RA滑膜细胞凋亡的促凋亡因子Caspase-3表达[25]。综上可知,可通过抑制P38MAPK信号通路的活化改善RA的炎性反应。
本研究通过检测大鼠滑膜关节组织中MKK3、P38MAPK、MMP-13、Caspase-3 mRNA及相关蛋白表达量变化和血清中IL-17含量变化,探究CAP对RA的抗炎作用机制。ELISA实验结果显示,Mod组IL-17含量较Nor组升高,经CAP治疗后,各组大鼠血清IL-17含量降低,且CAP 高剂量组与GTW组IL-17含量相近,提示CAP治疗RA的作用可能与其抑制促炎因子IL-17表达有关。PCR和WB实验结果显示,与Nor组相比,Mod组MKK3、P38MAPK、MMP-13表达升高,Caspase-3表达降低;与Mod组相比,CAP 高剂量组和GTW组MKK3、P38MAPK、MMP-13表达降低,Caspase-3表达升高,CAP 中、低剂量组差异无统计学意义,提示CAP可能抑制了P38MAPK信号通路的活化,且CAP 高剂量组与GTW组疗效相近。
综上所述,MKK3/P38MAPK/MMP-13信号通路、RA与CAP三者密切相关。本研究结果表明,CAP对RA有良好的抗炎作用,揭示其可能机制为抑制MKK3/P38MAPK/MMP-13信号通路的活化,减少炎症因子IL-17的释放,解除对促凋亡因子Caspase-3的抑制,从而达到改善RA的炎症浸润及骨破坏的目的。基于此研究,CAP可能成为雷公藤的替代疗法,但本研究结果仅仅是初步提示,后续实验可探究CAP作用于RA的其他分子机制,有利于进一步开发CAP的药用价值,同时也为临床上CAP治疗RA提供理论依据。
