血红蛋白氧载体联合依达拉奉局部预灌注对急性脑梗死模型大鼠神经元的保护作用及机制*
2023-06-23周正龙胡俞成韩润敏彭瀚杨华向欣
周正龙, 胡俞成, 韩润敏, 彭瀚, 杨华, 向欣*
(1.贵州医科大学附属医院 神经外科, 贵州 贵阳 550004; 2.济源市中医院 神经外科, 河南 济源 459000)
急性脑梗死(acute cerebral infarction, ACI)是较为常见的一种急性脑血管疾病,具有较高的临床病发率及致残致死率[1-2]。ACI起病急、治疗时间窗短,关键在于尽早开通闭塞血管以使缺血脑区获得有效灌注[3-5]。血红蛋白氧载体(hemoglobin oxygen carrier,HBOC)是运输和传递氧分子的小分子物质,具有恢复缺血组织供氧的能力,为缺血组织供应、转运氧桥,以增加缺血脑组织的氧供,对于缺血性脑血管疾病预后的改善具有显著意义[6-8]。依达拉奉(edaravone,EDA)是一种常用于ACI的自由基清除剂,其分子质量低、容易穿透血脑屏障,具有消除神经细胞水肿、促进炎症吸收、减轻炎性反应等神经保护作用的能力[9-11]。有研究发现,联合用药能更好地应对ACI脑缺血后的级联反应,是ACI治疗的研究热点[12-14]。推测在HBOC与EDA联合治疗ACI的过程中,可能会表现出较单一药物治疗方案更明显的协同保护作用,其涉及的保护机制也可能会更加多元化。因此,本研究结合HBOC与EDA的网络药理学和生物学验证,探讨二者联合治疗对ACI的神经保护作用及可能机制,为ACI灌注治疗方法提供新思路。
1 材料与方法
1.1 实验材料
1.1.1动物来源 清洁级雄性成年SD大鼠120只,8~12周龄,体质量250~300 g,由贵州医科大学动物实验中心提供[SYXK(黔)2018-0001],研究获得贵州医科大学伦理委员会批准(1600286)。实验过程中大鼠自由进食进水,实验室温度21~23 ℃,湿度40%~60%。
1.1.2主要仪器与试剂 微量注射泵购自宿州百意医疗器械有限公司,生物组织自动组织脱水机购自武汉俊杰电子有限公司,流式细胞仪购自美国BD Bioscience公司,SDS-PAGE凝胶制备试剂盒购自上海生工生物工程股份有限公司,一步法快速Western blot试剂盒购自北京康为世纪生物科技有限公司,半胱氨酸天冬氨酸蛋白酶3 (Caspase-3)、缺氧诱导因子-1α (HIF-1α)、白细胞介素-6 (IL-6)、肿瘤坏死因子-α (TNF-α)、内参甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自北京康为世纪生物科技有限公司;HBOC-201购自北京润方生物医药研究有限公司,EDA注射液购自南京先声东元制药有限公司。
1.2 研究方法
1.2.1网络药理分析数据库及软件 PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/),PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/),Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/),OMIM数据库(https://omim.org/),Genecards数据库(https://www.genecards.org/),David数据库(https://david.ncifcrf.gov/),STRING数据库(https://string-db.org/),Venny2.1在线软件作图工具平台(https://bioinfogp.cnb.csic.es/ tools/ venny/),Uniprot数据库(https:// www.uniprot.org/),Cytoscape3.9.1软件,R4.2.1软件等。
1.2.2药物及疾病靶点筛选 在NCBI的PubChem数据库中检索HBOC及EDA的基本信息,使用PharmMapper数据库和Swiss Target Prediction数据库获取靶点,经uniprot数据库对靶点名称矫正统一、去除重复靶点,分别获得HBOC及EDA对应靶点;使用OMIM、GeneCards数据库以“acute cerebral infarction”为关键词进行检索,去除重复靶点后获得ACI对应靶点。
1.2.3共同靶点的筛选及“药物-靶点-疾病”网络的构建 在Venny2.1在线软件作图工具平台上输入药物靶点与疾病靶点,将获得的HBOC、EDA和ACI的靶点相交,绘制维恩图提取共同靶点;将共同靶点输入Cytoscape 3.9.1软件中,绘制出“药物-靶点-疾病”网络图。
1.2.4基因通路和功能分析 将预测的共同靶点导入DAVID数据库,采用GO富集分析及KEGG通路富集分析HBOC联合EDA治疗ACI中的生物过程及信号通路,设置P<0.05为筛选条件,选择排名靠前的生物过程及信号通路,使用R语言对富集结果进行可视化,绘制条形图与气泡图。
1.2.5“药物-靶点-疾病-关键通路”网络的构建与核心靶点的获得 选择P值最小的前4个通路的气泡图,在Cytoscape 3.9.1软件中构建“药物-靶点-疾病-关键通路”的网络图并进行可视化分析;将关键通路的对应靶点导入STRING数据库,将物种设置为“Homo sapiens”,检索蛋白质相互作用关系,设置最低的相互作用阈值(中等置信度=0.4),其他参数保持在默认值;结果被保存为TSV文件后,导入到Cytoscape 3.9.1软件中,将节点的大小和颜色与程度相关,并将边缘的厚度与联合评分相关,绘制出蛋白质相互作用网络(protein-protein interaction networks,PPI),筛选核心靶点。
1.2.6实验动物模型的制备及分组 将大鼠按随机数字表法分为假手术组、模型组、HBOC治疗组、EDA治疗组、HBOC联合EDA治疗组(联合治疗组),每组24只。按参考文献[15]方法建立大鼠大脑中动脉梗死(middle cerebral artery occlusion,MCAO)模型,建模3 h后,采用微量注射泵将生理盐水(6 mL/kg)、HBOC(6 mL/kg)、EDA注射液(1.5 mL/kg)、或HBOC(6 mL/kg)和EDA注射液(1.5 mL/kg)联合经微导管分别持续泵入模型组、HBOC治疗组、EDA治疗组、联合治疗组大鼠颈外动脉远端,除假手术组外其余各组大鼠继续梗死1 h后取出线栓,恢复血流进行再灌注;而假手术组仅分离大鼠动脉,不插入线栓,即仅给予麻醉及颈正中切口,然后缝合。
1.2.7神经功能缺损评分 术后24 h,运用Zea Longa法神经功能缺损评分标准对各组大鼠进行神经功能缺损评分:神经缺损症状不明显、活动正常为0分,提尾时病灶对侧前肢体不完全伸直为1分,向患侧对侧转圈为2分,向患侧对侧倾倒为3分,活动障碍、意识丧失为4分。
1.2.8脑缺血梗死灶及脑水肿体积的测定 完成神经功能评分后,将大鼠腹腔注射10%水合氯醛(300 mg/kg)麻醉后断头处死,立即取出脑组织放入-20 ℃冰箱,冷冻20 min后放置于脑槽内,从额极开始向后切下厚度约2 mm的5张连续冠状脑组织切片,并迅速置于10 mL含1% 2, 3, 5-氯化三苯基四氮唑(TTC)的磷酸盐缓冲液(PBS)中, 37 ℃避光培养30 min,每5 min晃动、翻面1次(保证脑片着色均匀)。染色结束后,将切片转移到4%多聚甲醛溶液中固定24 h,取出固定好的脑切片拍照留存,应用Image J软件(Image J 1.37v)图像分析软件进行数据分析,按参考文献[16]计算脑梗死灶体积及脑水肿体积。
1.2.9苏木精-伊红(HE)染色观察脑组织神经元变化 每组随机取6只大鼠,于术后24 h麻醉断头处死,迅速取出患侧额叶脑皮质组织,用4%多聚甲醛固定标本2 h,蒸馏水浸泡4 h,脱水、浸蜡、包埋、切片等处理后进行HE染色。高倍镜下(400×)观察各切片相同部位的大脑皮质区神经元形态,每组随机选择皮质区的5个视野拍照。
1.2.10流式细胞术检测脑组织细胞凋亡 参考文献[17],每组随机取6只大鼠,于术后24 h麻醉断头处死,收集患侧额叶脑皮质组织,用400 μL预冷PBS洗涤脑细胞2次,用30 μm孔径的过滤器过滤,并调节细胞浓度为1×109CFU/L,以2 000 r/min离心10 min,弃上清液后加入1×膜联蛋白V(Annexin V)结合液400 μL及膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)染色液5 μL,轻悬混匀于2~8 ℃避光条件下孵育15 min,再加入碘化丙啶(PI)染色液10 μL,轻悬混匀,2~8 ℃避光条件下孵育5 min,立即用流式细胞仪检测。流式细胞仪激发波长为488 nm,Annexin V以FITC标记,配合PI同时染色检测凋亡,使用525 nm的带通滤片检测FITC,使用610 nm的带通滤片检测PI,分别通过FITC和PI对数荧光散点图分析凋亡细胞、活细胞和坏死细胞百分率。根据判读标准,在双变量流式细胞仪的散点图上,左下象限显示活细胞,左上象限显示坏死细胞,右上象限为晚期凋亡细胞,右下象限为早期凋亡细胞。在每一散点图的下方列出各象限的比例,可得到该散点图中坏死细胞百分率、晚期凋亡细胞百分率、早期凋亡细胞百分率及活细胞百分率。
1.2.11Western blot验证核心靶点基因的表达 每组随机取6只大鼠,于术后24 h麻醉断头处死,迅速取出患侧额叶脑皮质组织加入含有适量液氮的研钵里,研磨后加入组织裂解液,放入组织匀浆机中进行匀浆,使组织尽量碾碎,在冰上静置15~30 min使之充分裂解。将匀浆液放入离心管中12 000 r/min离心30 min,上清转移至新的预冷离心管中,处理蛋白随后上样。采用SDS-PAGE分离总蛋白,随后用湿转法转移至PVDF膜上,将一抗(Caspase-3、HIF-1α、IL-6、TNF-α、GAPDH)用抗体稀释液按适当的比例进行稀释,PVDF膜用一抗于4 ℃孵育过夜,然后用二抗室温孵育2 h后显影。将胶片进行扫描,采用凝胶成像系统分析蛋白条带的灰度值,目的蛋白条带灰度值与内参蛋白条带灰度值的比值等于目的蛋白的相对表达水平。
1.3 统计学分析
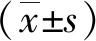
2 结果
2.1 共同靶点的筛选及“药物-靶点-疾病”网络构建
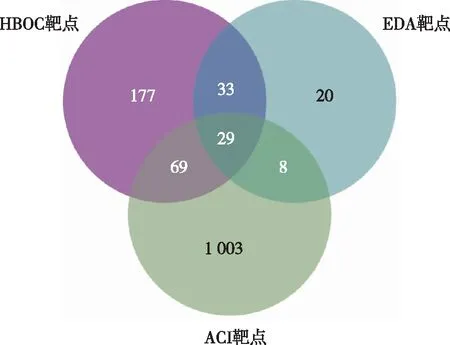
通过文献数据库结合PharmMapper、Swiss Target Prediction及Uniprot数据库,获得HBOC对应靶点308个、EDA对应靶点90个、ACI对应靶点1 109个,在Venny 2.1在线软件作图工具平台上,绘制维恩图,结果显示HBOC、EDA和ACI共同靶点106个,见图1。在Cytoscape 3.9.1软件中输入药物与疾病的共同靶点,构建“HBOC/EDA-靶点-ACI”网络图,见图2。
注:紫色为HBOC对应靶点,蓝色为EDA对应靶点,绿色为ACI对应靶点,药物与疾病的交集为共同靶点。
注:黄色为药物HBOC及EDA、蓝色为药物与疾病的106个共同靶点、红色为疾病ACI。
2.2 GO富集分析和KEGG通路富集分析
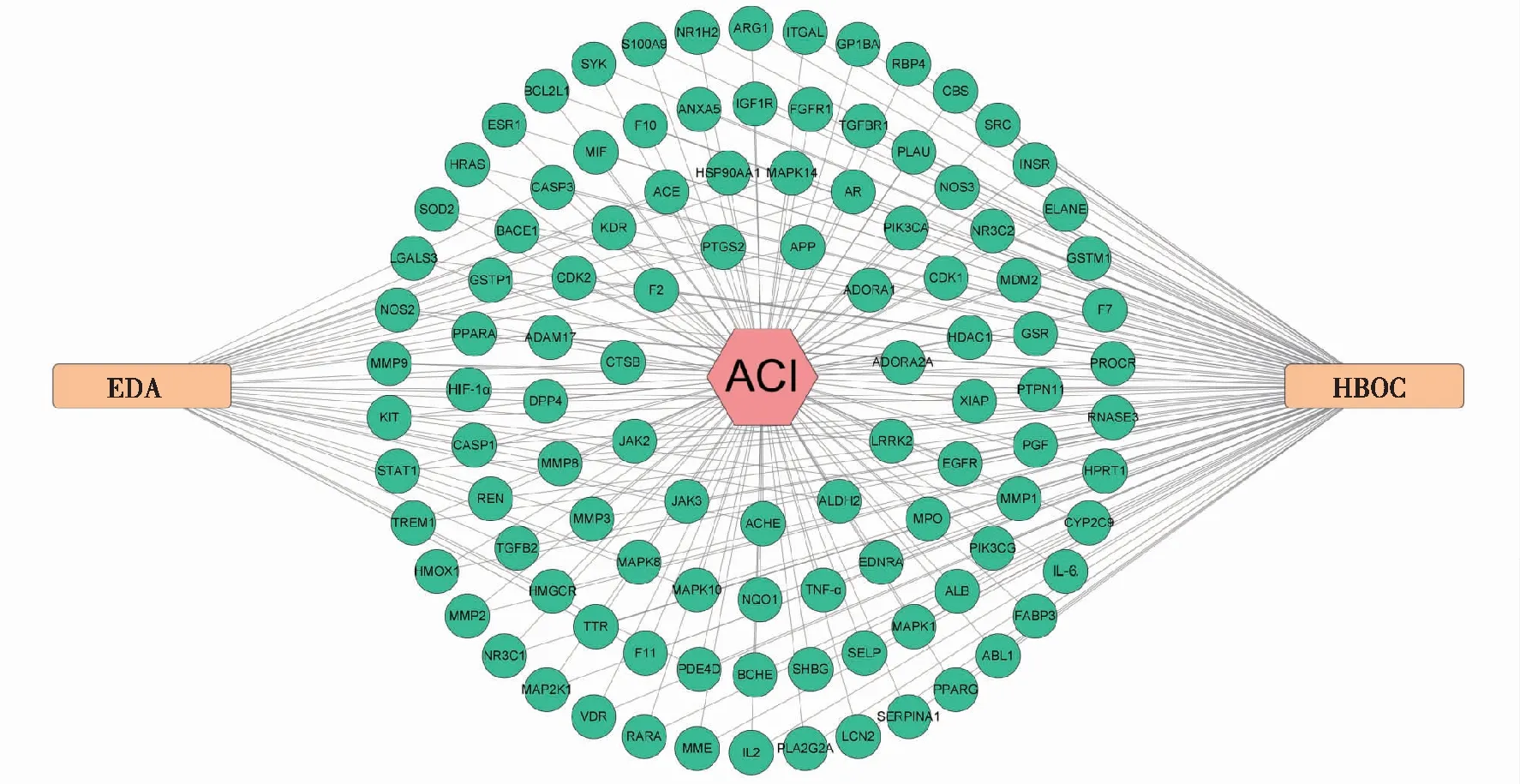
将HBOC联合EDA治疗ACI的共同靶点导入DAVID数据库进行GO富集分析及KEGG通路富集分析。GO富集分析显示共同靶点与凋亡过程的调控、对缺氧的反应、药物反应等生物过程相关,KEGG通路富集分析显示共同靶点主要参与IL-17信号通路、HIF-1信号通路、TNF信号通路等。见图3。
注:A为共同靶点的GO富集分析结果中P值排名前10的途径绘制的条形图,BP为生物学过程、CC为细胞组分、MF为分子功能;B为共同靶点的KEGG通路富集分析结果中P值排名前20的通路绘制的气泡图。
2.3 “药物-疾病-靶点-关键通路”网络的构建及核心靶点的获得
结果显示,在前4个关键通路中有32个靶点被富集(图4)。为了进一步探讨在关键通路中可能存在的核心靶点,构建关键通路中富集的32个靶点PPI网络图结果显示Caspase-3、HIF-1α,IL-6、TNF-α等靶点的节点相对较大,颜色相对较暗,提示有较高的度值,表明它们可能是HBOC和EDA联合治疗ACI的关键靶点,可能在评价治疗效果中发挥重要作用(图5)。

注:浅红色ACI,紫色代表4种关键通路,绿色表示参与通路的32个靶点,浅棕色代表药物(EDA与HBOC);节点之间的边缘代表它们之间的相互作用。
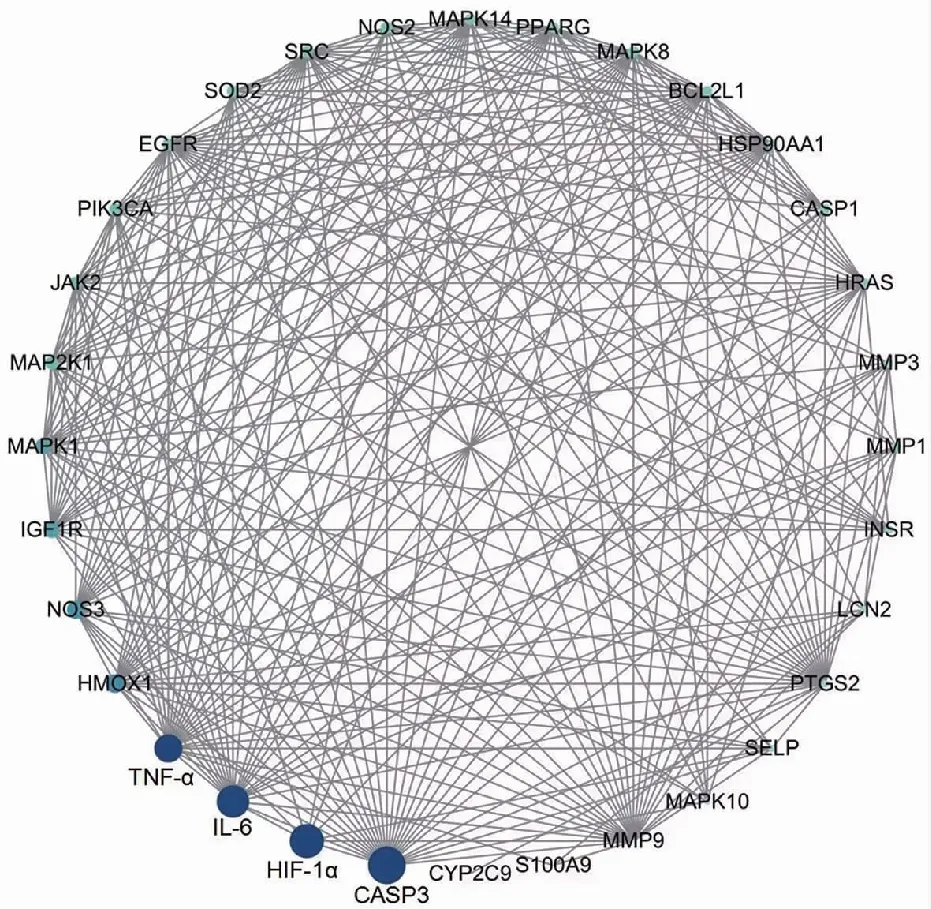
注:圆形节点代表靶点,节点之间的直线表示两个连接蛋白之间的相互作用;圆圈越大,颜色越深,度值就越大;线越厚,蛋白质之间的结合就越近。
2.4 大鼠神经功能评分
术后24 h,模型组和各治疗组大鼠的神经功能缺损评分均高于假手术组,差异有统计学意义(P<0.5); HBOC治疗组、EDA治疗组和联合治疗组的神经功能评分低于模型组,差异有统计学意义(P<0.05),联合治疗组低于HBOC治疗组和EDA治疗组,差异有统计学意义(P<0.05)。见表1。
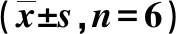
表1 各组大鼠术后24 h的神经功能评分比较
2.5 大鼠脑梗死灶体积与脑水肿体积
术后24 h,与假手术组比较,模型组、HBOC治疗组、EDA治疗组和联合治疗组大鼠的脑梗死灶体积和脑水肿体积增加,差异有统计学意义(P<0.05);与模型组比较,HBOC治疗组,EDA治疗组和联合治疗组的脑梗死灶体积和脑水肿体积明显减少,差异有统计学意义(P<0.05)。其中,联合治疗组脑梗死体积和脑水肿体积明显低于HBOC治疗组和EDA治疗组,差异有统计学意义(P<0.05)。见表2。
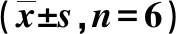
表2 各组大鼠术后24 h脑梗死灶体积及脑水肿体积比较
2.6 大鼠脑组织神经元形态观察
结果显示,术后24 h,假手术组大鼠脑组织中可观察到正常神经元细胞,神经元排列密集整齐、层次清晰、结构完整,神经元形态圆润、轮廓清晰、胞内胞质均匀、细胞核正常居中;模型组大鼠脑组织中神经元细胞结构明显异常,细胞排列相对紊乱,形态不规则,大量细胞皱缩,核染色质固缩、边集、碎片化,大量凋亡小体形成;HBOC治疗组、EDA治疗组和联合治疗组大鼠脑组织中正常神经元细胞数量出现不同程度减少,胞体肿胀变形,排列疏松,形态不规则,核仁不同程度固缩、碎片化。HBOC治疗组与EDA治疗组大鼠脑组织中神经元细胞排列较模型组清楚,较联合治疗组紊乱。联合治疗组大鼠脑组织中神经元细胞排列规则,边界清晰,碎片化核仁和凋亡小体显著减少。见图6。
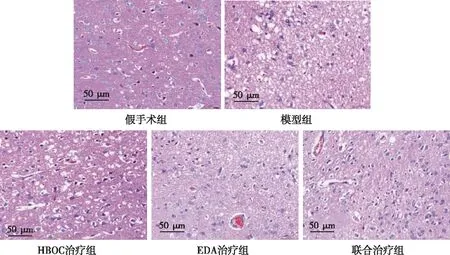
图6 各组大鼠术后24 h脑组织中神经元形态
2.7 大鼠脑组织细胞凋亡
术后24 h,与假手术组比较,模型组、HBOC治疗组、EDA治疗组和联合治疗组大鼠脑组织出现大量细胞坏死、凋亡细胞数量增多、正常细胞数量减少,差异有统计学意义(P<0.05);与模型组比较,HBOC治疗组、EDA治疗组和联合治疗组的凋亡细胞数量减少、正常细胞增多,差异有统计学意义(P<0.05);联合治疗组坏死细胞和凋亡细胞数量低于HBOC治疗组与EDA治疗组,差异有统计学意义(P<0.05)。见图7和表3。
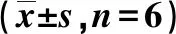
表3 各组大鼠术后24 h脑组织的细胞凋亡率比较
图7 各组大鼠术后24 h脑组织的流式细胞术检测结果
2.8 关键靶点蛋白的表达
术后24 h,与假手术组比较,模型组、HBOC治疗组、EDA治疗组和联合治疗组大鼠脑组织的Caspase-3、HIF-1α、IL-6、TNF-α蛋白表达水平上调,差异有统计学意义(P<0.05);与模型组比较,HBOC治疗组、EDA治疗组和联合治疗组的Caspase-3、HIF-1α、IL-6、TNF-α 蛋白表达水平下调,其中,联合治疗组的Caspase-3、HIF-1α、IL-6、TNF-α 蛋白表达水平低于HBOC治疗组与EDA治疗组,差异有统计学意义(P<0.05)。见图8。
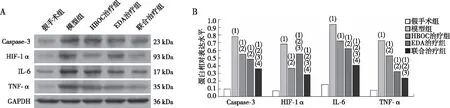
注:A为Caspase-3、HIF-1α、IL-6、TNF-α蛋白的Western blot检测结果,B为Caspase-3、HIF-1α、IL-6、TNF-α蛋白的定量结果;(1)与假手术组相比,P<0.05;(2)与模型组相比,P<0.05;(3)与HBOC治疗组相比,P<0.05;(4)与EDA治疗组相比,P<0.05。
3 讨论
ACI发生以后,缺血脑组织会发生一系列级联反应,梗死局部间质水肿、脑血管受压、微血栓聚集,进而使红细胞无法到达病灶部位,组织缺血缺氧对半暗带进一步损害,最终导致更大面积的病损及更严重的神经功能缺失[18]。针对治疗缺血性损伤的多种方法,联合治疗比单一治疗策略具有优势[19-20]。本研究结合HBOC与EDA的网络药理学和生物学验证,探讨其联合治疗对ACI的神经保护作用及相关机制。
网络药理学是一个多学科的研究领域,通过建立数据库、建立网络、分析网络和进行实验验证来解释疾病的发展过程[21-22]。网络药理学利用组学整合了系统生物学,为从生物平衡的角度探索中药或天然活性物质的作用机制和开发中药活性成分提供了有力的工具。此外,还可以直观地呈现药物-靶点-疾病的网络图,可以预测治疗过程中的作用靶点和信号通路,进而预测其潜在的作用机制,这是开发新药的有效途径之一[23-25]。本研究通过网络药理学预测HBOC联合EDA治疗ACI的106个共同靶点,并分析了这些靶点的GO富集分析和KEGG通路富集分析,预测在治疗过程中可能发挥的作用,并检测靶点的程度值。结果显示这些靶点参与凋亡过程的调控、对缺氧的反应等生物过程,并可能通过IL-17信号通路、HIF-1信号通路、TNF信号通路等途径在ACI治疗中起神经保护作用。
为了进一步探讨在关键通路中可能存在的核心靶点,本研究构建了通路中富集的32个靶点的PPI网络,结果显示Caspase-3、HIF-1α,IL-6、TNF-α可作为HBOC和EDA联合治疗ACI的关键靶点。研究证实,脑组织缺血缺氧后会启动细胞凋亡程序,细胞凋亡的过程是水解底物的级联放大反应过程[26]。Caspase-3作为Caspase家族蛋白的凋亡执行因子,是细胞凋亡级联反应的最终执行蛋白[27]。脑缺血损伤发生后,细胞内会生成大量氧自由基,随着细胞膜被逐渐破坏,溶酶体、线粒体等细胞器均受到不同程度损伤,凋亡蛋白Caspase-3经不同途径被激活,最终导致细胞凋亡。HIF-1是一种转录因子,它存在于人体和哺乳类动物的细胞内,对细胞的代谢调节以及介导机体适应低氧环境起关键性作用[28]。HIF-1α在细胞缺血缺氧时表达上调,位于下游的促凋亡基因表达受到调控后表达增加,进一步促进细胞凋亡,HIF-1α表达的上调与细胞凋亡呈正相关的关系[29]。缺血性脑损伤伴随着明显的炎性反应,炎性反应由炎症细胞的积聚和炎症介质的表达引起并加重,炎性反应的抑制可以保护缺血性脑损伤[30]。在炎性反应中,IL-6、TNF-α起着重要作用。IL-6是脑缺血炎性反应的关键介质,其介导的神经炎症加重了脑损伤,在缺血和缺氧刺激下,IL-6在神经元和胶质细胞中表达明显升高,而抑制IL-6表达可以减轻缺血缺氧造成的损伤[31]。TNF-α是脑梗死后的重要炎性因子,可直接损伤脑组织,同时能诱导局部组织产生炎性因子,引起炎症级联反应[32]。经生物信息学预测,在本研究中,Caspase-3、HIF-1α,IL-6、TNF-α可作为HBOC和EDA联合治疗ACI的关键靶点。本研究结果也显示,检测Caspase-3、HIF-1α,IL-6、TNF-α含量的变化可能作为HBOC和EDA联合治疗ACI的关键指标,可能在评价治疗效果中发挥重要作用。
本研究的生物学实验主要在行为学水平、细胞水平、分子水平等方面进行疗效评估。神经功能评分是评价脑损伤病情预后的重要依据[8]。本研究采用改良的神经功能缺损评分标准评价HBOC联合EDA对ACI大鼠神经功能的改善效果,结果显示联合用药后大鼠神经功能评分显著降低。此外,研究发现联合治疗在减轻脑梗死体积和水肿体积的作用上均较单独治疗有更好的效果。提示联合治疗方案对大鼠脑梗死后的神经功能缺损症状有明显的改善作用,且其疗效优于单独用药方案。另一方面,本研究通过HE染色观察各组大鼠脑组织神经元变化,结果表明联合用药能有效改善脑缺血的神经元病变。
在本研究中,模型组、HBOC治疗组、EDA治疗组和联合治疗组大鼠脑组织的Caspase-3和 HIF-1α蛋白表达水平均较假手术组明显升高,同时通过流式细胞术检测大鼠脑组织细胞凋亡程度显示模型组、HBOC治疗组、EDA治疗组和联合治疗组出现大量细胞坏死,细胞凋亡数量增多,正常细胞数量明显减少,说明脑梗死后细胞凋亡程序被启动,凋亡因子Caspase-3和 HIF-1α蛋白表达水平上调。通过与模型组比较,HBOC治疗组、EDA治疗组和联合治疗组的Caspase-3和 HIF-1α蛋白表达水平均有不同程度的降低,流式细胞术显示脑组织凋亡、坏死细胞比例减少、正常细胞增多,说明在脑梗后凋亡程序的启动中,各治疗组对细胞凋亡均表现出不同的抑制作用。其中,联合治疗组细胞坏死和细胞凋亡数量明显低于HBOC治疗组与EDA治疗组,表明联合治疗对脑梗死后启动的凋亡程序具有更明显的抑制作用,通过下调凋亡因子Caspase-3和 HIF-1α蛋白表达水平,从而发挥更明显的神经保护作用。此外,本研究发现,IL-6、TNF-α等炎症因子在脑梗死后的蛋白表达水平表现出明显升高趋势,提示脑梗死后炎性反应被激活。与模型组比较,HBOC治疗组、EDA治疗组和联合用药治疗组的IL-6、TNF-α蛋白表达水平均有不同程度的降低,说明各治疗组对脑梗死后出现的炎性反应均有不同程度的抑制作用。其中,联合治疗组的IL-6、TNF-α 蛋白表达水平明显低于HBOC治疗组与EDA治疗组,说明联合用药对脑梗死后的炎性反应的抑制作用更大,从而发挥更明显的神经保护作用。
综上,本研究通过网络药理学分析,预测HBOC与EDA联合用药的协同效应,并通过生物学实验在行为学水平、细胞水平、分子水平等方面进行疗效评估,初步证明HBOC和EDA联合治疗可以明显改善大鼠神经功能缺损症状,减轻脑水肿和梗死体积,抑制细胞凋亡,且疗效较单一用药更为明显,其联合用药的神经保护作用机制可能通过多靶点、多途径方式减轻炎症反应与细胞凋亡。本研究为今后临床实验的开展和ACI的治疗提供了新的思路。
