清肾颗粒对腺嘌呤致肾纤维化大鼠Nrf2/ARE 信号通路及氧化应激的干预作用*
2023-06-23陈诺金华呼琴王亿平刘敏张叶青
陈诺,金华,呼琴,王亿平,刘敏,张叶青
1 安徽中医药大学研究生院 安徽合肥 230012
2 安徽中医药大学第一附属医院 安徽合肥 230031
慢性肾脏病(chronic kidney disease,CKD)已经成为一个严重威胁人类健康的重要疾病。CKD 的病理基础是肾小球硬化和肾间质纤维化(renal interstitial fibrosis,RIF),最终导致终末期肾脏病(End-stage renal disease,ESRD)的出现。氧化应激在CKD 病情进展中扮演十分重要的角色,是RIF 发生的重要病理机制[1]。Nrf2/ARE 信号通路在抗炎、抗氧化、抑制细胞死亡和促进血管生成中发挥重要作用,是体内内源性抗氧化系统的活性通路,有望为肾病的诊断和治疗提供新的靶标[2]。
中医药在治疗慢性肾衰竭等慢性疾病方面具有显著疗效,可有效延缓其进展[1]。清肾颗粒是安徽省名中医、安徽省中医药领军人才王亿平教授的临床基础经验方。前期临床研究已证实[1,3],CKD 湿热证患者体内氧化应激反应显著增强,清肾颗粒不但具有清热化湿祛瘀功效,而且可以抑制CKD 患者的氧化应激,增强抗氧化能力,进而延缓肾纤维化的进展。为进一步了解清肾颗粒在肾纤维化中的作用,本研究通过腺嘌呤诱导大鼠肾纤维化,通过Nrf2/ARE 途径阐明其作用机理。
材料与方法
1 材料
1.1 实验动物 2 月龄SPF 级雄性SD 大鼠50 只,体质量(200±10)g,购自斯贝福(北京)生物技术有限公司,动物许可证号:SCKX(京)2019-0010,NO.110324210103597984。动物相关处置均符合《中华人民共和国实验动物管理条例》要求。
1.2 实验药物与试剂 清肾颗粒由生大黄、茵陈、黄连、白花蛇舌草、丹参、泽泻等药物组成,由安徽中医药大学第一附属医院院内制剂(皖药制字BZ20080011),10g/袋(约含生药34g)。
1.3 主要试剂 腺嘌呤购自Solarbio;SCr、BUN、UA试剂盒均购自南京建成生物工程研究院;PBS 试剂购自Hyclone;ROS 购自碧云天;兔抗Nrf-2 抗体购自Bioss;GAPDH 购自Zsbio;山羊抗小鼠IgG、山羊抗兔IgG 购自Zsbio。
2 方法
2.1 造模 选用SPF 级SD 大鼠50 只,在7d 内进行适应性饲养,将其随机分为正常组、模型组、清肾颗粒低、中、高剂量组,每组10 只。除正常组之外,其他各组大鼠均建立腺嘌呤肾纤维化模型。在100ml 生理盐水中加入2.5g 的腺嘌呤,制成浓度为2.5%悬浮液,灌胃给药,剂量为200mg·kg-1·d-1(即0.8mL·100g-1·d-1)。腺嘌呤容易沉淀,所以在灌胃操作中,一定要将腺嘌呤悬浊液混合均匀,以备随时使用。正常组大鼠连续28d 每日给予相同剂量生理盐水灌胃1 次。
2.2 分组及给药 从造模后第1 天开始,每天以4mL给药1 次,持续12 周。清肾颗粒高、中、低剂量组分别 按16.0g·kg-1·d-1、8.0g·kg-1·d-1、4.0g·kg-1·d-1的 剂量灌胃,而正常组和模型组则给予同等剂量的生理盐水。
2.3 动物取材方法 在最后1 次给药12h 后,每组大鼠用2.5mL·kg-12%戊巴比妥钠麻醉,并将其置于手术台上,打开腹腔,于腹主动脉无菌采血,离心并分离血清,取血清,于-80℃下贮存,测定SCr,BUN,UA 等各项指标。切除大鼠双肾并记录重量,修剪组织,并于0.9%的生理盐水中清洗,分离后一部分肾组织并迅速放入液氮中,随后移至-80℃的冰箱中保存,蛋白含量通过Western blot 测定。剩余肾脏置于4%多聚甲醛内保存,做好病理学检查的准备。采集各组大鼠标本后,处死并放于医疗垃圾袋中,将其送交安徽中医药大学科研实验中心进行集中处置。
2.4 肾脏组织病理学检查 由专业技术人员指导制备肾脏组织石蜡切片,根据 HE、MASSON 的试剂盒说明书进行染色。封片后,用光学显微镜观察肾脏组织的病理变化程度。
2.5 血生化相关指标检测 取出血清,检测SCr、BUN、UA 等的含量,操作严格按照试剂盒说明书执行。
2.6 肾脏相关指标检测
2.6.1 ROS(活性氧含量)检测 取肾组织细胞,根据活性氧检测试剂盒的说明,用流式细胞术测定活性氧水平。
2.6.2 Western Blot 法检测 称取定量大鼠肾组织,用RIPA 裂解液提取总蛋白。运用BCA 法检测蛋白浓度。主要步骤如下:首先,通过分离凝胶电泳分离蛋白,并转移到PVDF 膜上。转模完毕之后,加入Western 封闭液(5%脱脂奶粉)室温封闭2h;随后加入一抗Nrf2(1∶1000 稀释)、HO-1(1∶500 稀释)、4℃孵育过夜,TBST 洗涤3 次后,室温孵育HRP 标记的兔二抗(1∶20000 稀释)1.2h;使用ECL 发光试剂盒来检测蛋白。采用Image J 软件进行胶片条带的分析。
3 统计学处理
数据处理运用SPSS23.0 进行分析。计量资料用(±s)表示;2 组之间使用t 检验进行比较;运用单因素方差分析进行多组间比较;若数据不符合正态分布或方差不齐则进行非参数检验;采用卡方检验或Fisher 精确概率法对计数资料进行统计。P<0.05 被视为有统计学意义。
结 果
1 大鼠一般情况
实验过程中由于灌胃不当出血致死2 只,1 只因麻醉药物过量而死亡,1 只死因不明。最终正常组有10 只大鼠、模型组存活8 只、清肾颗粒高剂量组存活9 只、中剂量组有10 只大鼠、低剂量组还剩下9 只。正常组大鼠状态良好,饮食正常,活动好,反应灵敏,体毛光滑有光泽,体重、饮食量以及饮水量正常。正常组大鼠精神、进食、活动、体重、饮食及饮水量均正常、反应敏捷、体毛光亮。模型组大鼠较正常组大鼠精神、进食、活动、体重、饮食及饮水量均不佳,反应迟钝,体毛杂乱黯淡。各治疗组大鼠精神、活动、皮毛状态较模型组大鼠均有明显的改善。
2 各组大鼠肾功能指标的变化
与正常组比较,模型组大鼠BUN、Scr 和UA 浓度均显著升高(P<0.05)。与模型组比较,清肾颗粒低、中、高剂量组大鼠BUN、Scr 和UA 浓度均显著下降(P<0.05);且清肾颗粒高剂量组的BUN、Scr 和UA浓度显著低于中、低剂量组(P<0.05)。见表1。
表1 各组大鼠BUN、Scr 和UA 比较(±s)
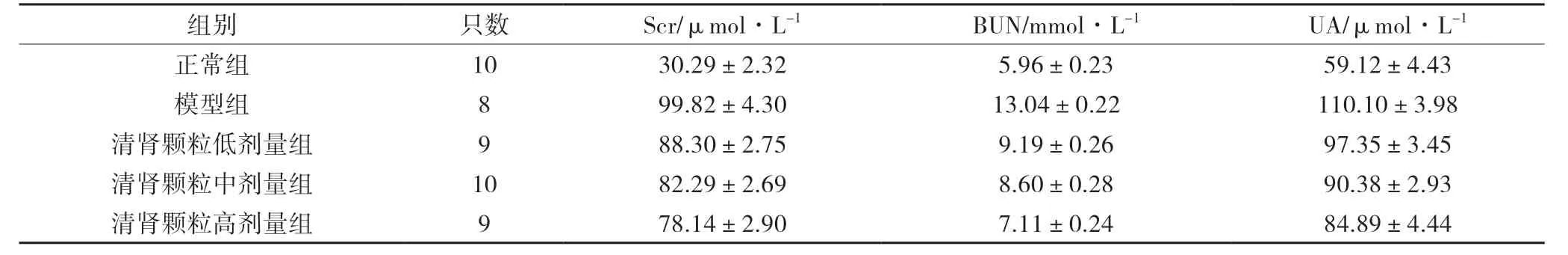
表1 各组大鼠BUN、Scr 和UA 比较(±s)
组别 只数 Scr/μmol·L-1 BUN/mmol·L-1 UA/μmol·L-1正常组 10 30.29±2.32 5.96±0.23 59.12±4.43模型组 8 99.82±4.30 13.04±0.22 110.10±3.98清肾颗粒低剂量组 9 88.30±2.75 9.19±0.26 97.35±3.45清肾颗粒中剂量组 10 82.29±2.69 8.60±0.28 90.38±2.93清肾颗粒高剂量组 9 78.14±2.90 7.11±0.24 84.89±4.44
3 各组大鼠肾组织中ROS 含量的比较
与正常组比较,模型组大鼠肾组织ROS 含量升高(P<0.05)。与模型组比较,清肾颗粒低、中、高剂量组ROS 含量均显著下降(P<0.05);且清肾颗粒高剂量组的ROS 含量显著低于中、低剂量组(P<0.05)。见表2、图1。
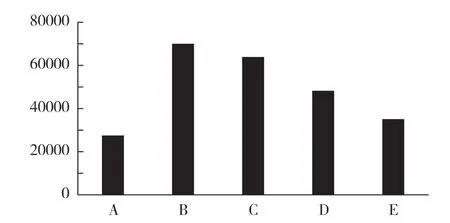
图1 各组细胞ROS 平均荧光强度比较(±s)相关柱状
表2 各组细胞ROS 平均荧光强度比较(±s)

表2 各组细胞ROS 平均荧光强度比较(±s)
组别 只数 ROS(平均荧光强度)正常组 10 27528.00±725.34模型组 8 70046.00±998.25清肾颗粒低剂量组 9 63924.67±689.77清肾颗粒中剂量组 10 48261.33±1750.50清肾颗粒高剂量组 9 35113.00±1065.53
4 各组大鼠肾组织中Nrf2、HO-1 蛋白表达比较
与正常组比较,模型组大鼠的Nrf2、HO-1 蛋白表达均显著降低(P<0.05)。与模型组比较,清肾颗粒低、中、高剂量组大鼠Nrf2、HO-1 蛋白表达均显著升高(P<0.05);且清肾颗粒高剂量组的Nrf2、HO-1 蛋白表达程度显著高于中、低剂量组(P<0.05)。见表3,图2。

图2 各组大鼠蛋白电泳
表3 各组大鼠肾组织Nrf2、HO-1 蛋白表达比较(±s)
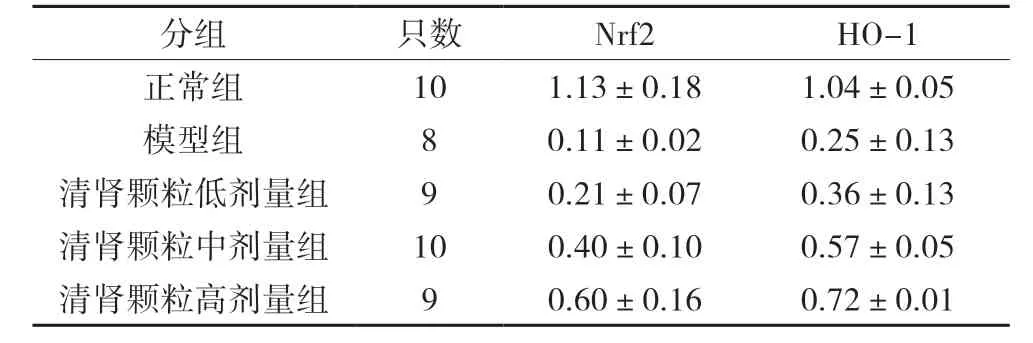
表3 各组大鼠肾组织Nrf2、HO-1 蛋白表达比较(±s)
分组 只数 Nrf2 HO-1正常组 10 1.13±0.18 1.04±0.05模型组 8 0.11±0.02 0.25±0.13清肾颗粒低剂量组 9 0.21±0.07 0.36±0.13清肾颗粒中剂量组 10 0.40±0.10 0.57±0.05清肾颗粒高剂量组 9 0.60±0.16 0.72±0.01
5 各组大鼠的肾脏病理改变
正常组肾小球、肾小管及肾间质未见异常。模型组正常肾小球数目明显下降数量显著减少,肾小球内可见系膜基质增多和系膜细胞增生,伴有部分肾小球萎缩或代偿性肥大;肾小管萎缩,小管上皮细胞肿胀、脱落,部分管腔有明显扩张,内可见棕褐色腺嘌呤结晶沉积;肾间质增宽,成纤维细胞及胶原纤维增多,单核、淋巴细胞明显浸润,蓝染胶原纤维分布于纤维化区域。各治疗组与模型组比较,上述病理改变有所减轻。见图3。
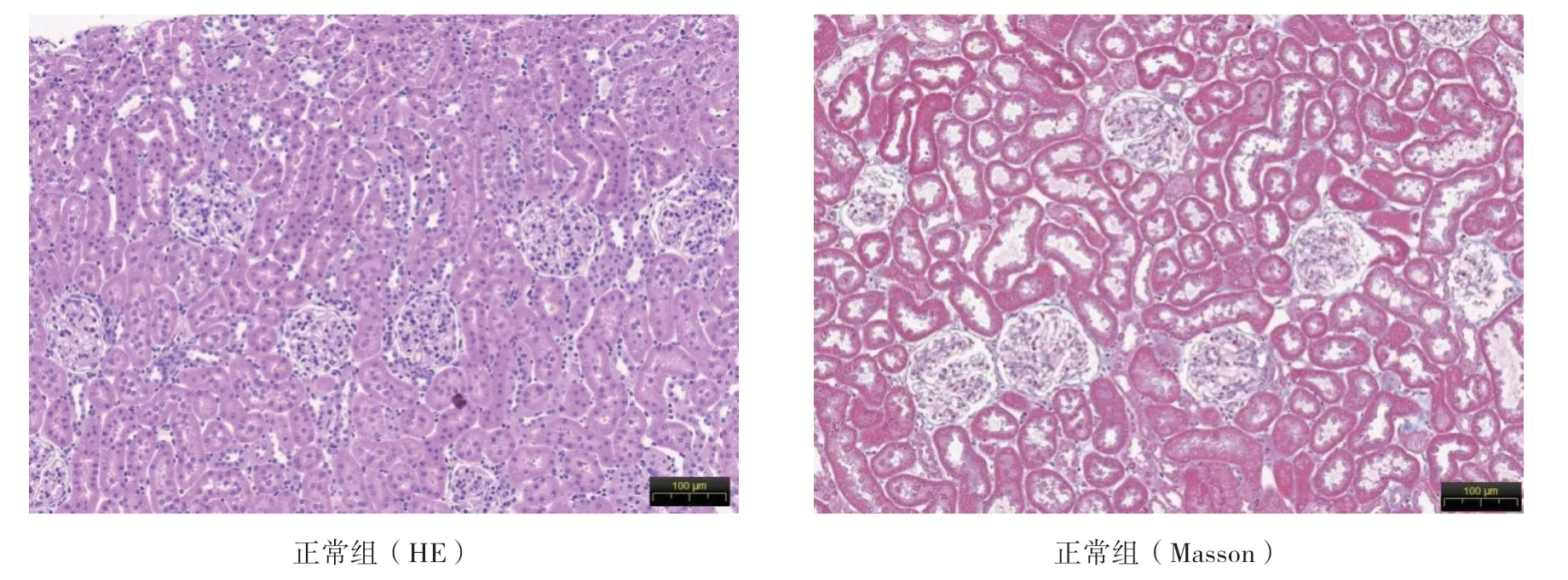
图3 A 各组大鼠的肾脏病理改变

图3 B 各组大鼠的肾脏病理改变
讨 论
慢性肾衰竭在中国古代文献中并无与之相适应的病名,近代医学文献将其纳入“水肿”“关格”“癃闭”“虚劳”等范畴[4]。诸多医家均把湿热郁滞作为肾病的主因,是慢性肾病的始动因素,因此在治疗中应突出清利湿热[5]。王亿平教授根据慢性肾衰的病机特征自拟“清肾颗粒”,其作用是清热化湿,活血祛瘀[6]。本方中,生大黄泻热逐瘀,荡涤胃肠湿热瘀毒,为君药;白花蛇舌草清热解毒利湿,茵陈清利湿热,黄连清热燥湿,泻火解毒,三药合用共为臣药;佐以茯苓、白术、白豆蔻、薏苡仁、扁豆、猪苓、泽泻、车前草健脾益气、利水渗湿消肿;并辅以益母草和丹参活血化瘀。这些药物合用,具有清热化湿祛瘀之功。
本研究所选择的腺嘌呤诱导CRF 大鼠模型是实验中常用的CRF 动物模型,大鼠长期给予腺嘌呤灌胃可沉积于肾小管及间质引起堵塞,产生类似人类CRF代谢异常,在生物化学和形态学上都与人类CRF 相似,与单侧输尿管梗阻、马兜铃酸肾病等其他肾间质纤维化模型相比较,腺嘌呤大鼠的肾小管损伤更为严重。因此腺嘌呤CRF 模型对肾间质纤维化、慢性间质性肾炎和局灶节段性肾小球硬化的研究有一定的参考价值[7]。血肌酐、尿素氮、尿酸这些肾脏损害的指标在肾功能受损的情况下会在血液中蓄积[8]。在腺嘌呤灌胃后,模型组大鼠血液Scr、BUN 和UA 浓度升高,并且肾组织出现了肾小管萎缩、肾间质纤维化、炎性细胞浸润等病理学变化,提示造模成功。在予不同浓度清肾颗粒后,大鼠血液中Scr、BUN 和UA 明显降低,肾脏组织病理学变化得到改善,表明清肾颗粒具有抗肾脏纤维化作用,与其他研究结论一致[9]。
氧化应激(oxdative stress),指氧化剂(活性氧(ROS)、活性氮(RNS)、自由基)与抗氧化剂之间的氧化还原平衡失衡[10]。体内氧化与抗氧化系统在正常情况下维持着动态平衡。但是这种平衡状态在机体发生病变时被打破[11]。Patricia Tomás-Simó 等[12]研究发现与健康个体相比,CKD 患者表现出明显更高的氧化应激水平,并且随着eGFR 的下降,这些变化加剧,在CKD 分期之间具有显著差异,并随着病情恶化而增加,同时抗氧化能力下降。前期研究证实[13-14],活性氧(ROS)通过氧化应激反应介导NF-κB 活化,进而激活炎症因子,诱导人肾小管上皮细胞(HK-2)转分化和加速肾纤维化大鼠的RIF 进程;清肾颗粒能够通过抗氧化机制,减轻肾小管损伤,抑制肾小管EMT,延缓RIF 进展。
Nrf2-ARE 信号通路是抗氧化应激的经典信号通路。在基础条件下,Nrf2 通过结合其主要抑制剂Keap-1 而保持转录活性,Keap-1 针对Nrf2 进行蛋白酶体降解,维持在细胞质中。在氧化应激环境中,Nrf2与Keap1 从细胞质中分离并向核内迁移,并与Maf 形成异源二聚体(ARE)共同作用,激活Nrf2-ARE 信号途径,从而激活下游的许多保护基因(如血红素加氧酶-1(heme oxygenase-1,HO-1)、对氧磷酶(PON)-1等)的转录,进而抵御各种刺激引起的氧化应激损害[15-17]。此次研究发现,腺嘌呤慢性肾衰竭大鼠肾组织中的总Nrf2、核Nrf2、HO-1 等蛋白表达水平显著降低,考虑Nrf2 激活及其下游抗氧化分子在慢性肾衰竭肾组织中的反常减少。这可能与尿毒症动物对氧化应激和炎症的生物反应能力受损,以及它们对残肾的破坏性后果,这与前期研究结果一致[18-21]。
本研究结果表明,清肾颗粒可降低腺嘌呤肾纤维化大鼠血清中SCr、BUN、UA 含量,减轻肾组织病理损伤;并且还可以显著增加腺嘌呤肾纤维化大鼠肾组织中Nrf2、HO-1 蛋白表达量,提示清肾颗粒具有抗氧化应激的能力,其作用机制可能与Nrf2/ARE 信号通路的激活有关,从而保护肾脏并延缓肾纤维化进程。这为清肾颗粒治疗慢性肾衰竭的临床应用提供科学理论依据。
