二氧化硫对木纳格葡萄采后糖含量及糖代谢途径的影响
2023-06-20常雪花闫波雯翟荣臻
常雪花,闫波雯,翟荣臻,张 政,吴 斌,魏 佳,
(1.巴音郭楞职业技术学院,新疆库尔勒 841000;2.新疆农业科学院农产品贮藏加工所,乌鲁木齐 830091)
0 引 言
【研究意义】木纳格葡萄果皮薄,采后贮藏过程中容易受到机械损伤、病原菌和真菌的侵害,又因为葡萄含糖量高达15%~25%[1],长时间贮藏[2]会受到侵染使含糖量下降。二氧化硫(sulfur dioxide,SO2)是常用的鲜食葡萄保鲜剂。目前SO2在葡萄保鲜中的作用研究多集中在提高果实抗病性方面,但关于SO2调控葡萄糖代谢途径缺乏系统研究。采前不同处理方式会对发育果实中的糖代谢会产生影响。研究SO2对葡萄采后糖代谢机制的调控作用,对优化葡萄采后SO2保鲜技术有重要意义。【前人研究进展】赖呈纯等[3]研究发现摘心处理有利于巨峰葡萄果实糖分的快速积累。王萌等[4]研究发现芸苔素内酯处理有利于提高糖代谢相关酶的活性。贺琰等[5]研究发现采用外源油菜素内酯处理葡萄能提高果实发育过程中糖代谢酶的活性。【本研究切入点】目前,仅有个别研究探讨SO2类保鲜剂对葡萄采后糖含量及糖代谢相关酶活性的影响[6, 7],但并未从分子层面探讨SO2对葡萄采后糖代谢途径的影响。需研究SO2对木纳格葡萄采后糖含量及糖代谢途径的影响。【拟解决的关键问题】运用高效液相色谱技术(High Performance Liquid Chromatography,HPLC)与荧光定量PCR(Real-time quantitative-PCR,qPCR)相结合方法,分析SO2调控果实糖代谢的主要途径,研究SO2对葡萄采后糖代谢机制的调控作用,为葡萄采后SO2保鲜技术的优化提供重要理论依据与技术支撑。
1 材料与方法
1.1 材 料
1.1.1 木纳格葡萄
木纳格葡萄成熟期(可溶性固形物含量≥18%)采收于新疆阿图什市商业果园。采收后用冷藏车立即运输至新疆农业科学院,在(0±2)℃预冷24 h,挑选颜色均一、无机械伤的果实。
1.1.2 试 剂
蔗糖、葡萄糖、果糖(标准品) (德国Dr.Ehrenstorfer股份有限公司);十六烷基三甲基溴化铵、酚仿(北京索莱宝科技有限公司);氯仿、异戊醇(天津市致远化学试剂有限公司);氯化锂(Sigma公司);“TIAN Script RT Kit”试剂盒(天根生化科技有限公司);FastStart Essential DNA Green Master (罗氏公司)。所有试剂均为分析纯。
1.1.3 仪器与设备
AltusA-10型高效液相色谱(美国PerkinElmer公司);MS105DU型分析天平(瑞士Mettler Toledo公司);LDZX-50KBS型灭菌器(上海申安医疗器械有限公司);Hettich D-78532型微型离心机(德国Hettich公司);OSE-MP25型TGear Plate微孔板离心机(天根生化科技有限公司);DYY-6D型核酸电泳仪(北京市六一仪器厂);BioPhotometer D30型核酸蛋白测定仪(德国Eppendorf公司);Biometra型PCR仪(德国耶拿分析仪器公司)。
1.2 方 法
1.2.1 原料预处理
42筐(每个聚乙烯(PE)筐(35 cm×25 cm×20 cm)中装约7 kg葡萄)。将42筐葡萄随机分为2组:(1)SO2处理(21筐),顶部内衬吸水纸和SO2保鲜纸(SO2缓释型葡萄专用保鲜纸:主要成分为焦亚硫酸钠,由新疆乌鲁木齐格瑞德保鲜科技有限公司提供,经中国绿色食品协会许可);(2)对照组(CK,21筐),置于相同条件下,顶部内衬吸水纸。处理后,将所有葡萄放入0.03 mm厚PE袋中,(0±0.5)℃,相对湿度(RH)为90%~95%,保存60 d。每隔10 d从每个重复样本中随机收集50个水果的样品,液氮冻样置于-80℃冰箱保存。
对照组(0、10、30、60 d)和SO2处理组(10、30、60 d)分别取冷冻样品各10 g,将其包裹在锡箔纸中并贴上标签。每个样品含3个平行样本,送公司测序。分别取葡萄组织分析代谢和基因表达。
1.2.2 HPLC测定葡萄中蔗糖、葡萄糖、果糖含量
1.2.2.1 材料预处理
糖含量分析采用文献方法[8]。将0.50 g葡萄粉加入50 mL超纯水中,超声30 min, 12 000 r/min,4℃离心30 min,取上清液,过0.22 μm水相滤膜后待测。每个处理3个平行。
1.2.2.2 标准品母液和标准工作液
用纯水配制1 000 mg /L蔗糖、葡萄糖和果糖标准品母液,避光储存于-4℃冰箱。标准品工作液由标准品母液稀释配制并绘制标准曲线,浓度梯度为0.10、0.20、0.50、1.00、2.00、5.00和10.00 mg/L。
1.2.2.3 回收率
通过回收率试验评价测定方法的准确性。取CK组第30 d样品、SO2处理组第30 d样品分别添加已知量的标准溶液(各100 mg/L)。每次添加是在葡萄样品静置20 min时加入各标准溶液,在相同色谱下分析,计算回收率。
回收率(%)=
(1)
重复测定(n=3)标准溶液的每一种糖并证明测定方法的准确性。保留时间及峰面积的测量被用来评估测定方法的重复性及再现性。
1.2.2.4 色谱条件
色谱柱:钙离子交换柱(安捷伦Hi-Plex Ca 8.0 μm,7.7 mm×300 mm)。
仪器条件:流动相:纯水;检测器:RI检测器;柱温:60℃;流速:0.4 mL/min;进样量:10 μL。
1.2.3 糖代谢相关基因荧光定量表达
1.2.3.1 总RNA的提取
木纳格葡萄中总RNA的提取方法参考前期研究方法[9]。取200 mg葡萄组织冻样,放入2.0 mL离心管,依次加入65℃预热的十六烷基三甲基溴化铵缓冲液1 mL,震荡混匀,65℃水浴20 min;加入1 mL体积比为24∶1的氯仿-异戊醇混匀,离心,取上清液;将上清液至于1.5 mL离心管,加1/4体积10 mol/L LiCl,4℃冰箱沉降8~12 h;沉降后,离心,去上清液加入预冷75%乙醇500 μL,离心去上清液;加入500 μL SSET缓冲液溶解沉淀,转移至1.5 mL离心管;加入等体积的酚仿混匀,离心,上清液转移至1.5 mL离心管;加入等体积24∶1的氯仿-异戊醇,重复上一步骤;取上清,加入2.5倍体积无水乙醇,混匀;-80℃条件下沉降30~60 min;离心,去上清;加1 mL预冷75%乙醇漂洗沉淀,离心,重复2次;添加1 mL预冷无水乙醇再次漂洗管内沉淀,去上清,自然干燥;加入20 μL DEPC-H2O溶解RNA,-80℃保存,待测。琼脂凝胶电泳检测RNA的完整性,检测方法参照前期方法[9]。
1.2.3.2 RNA反转录
总RNA采用天根“TIAN Script RT Kit”试剂盒反转录为cDNA。
1.2.3.3 糖代谢相关基因cDNA片段扩增
内参基因Actin参照前期设计[9],糖代谢基因特异性引物采用DNAman 6.0根据GeneBank中已登陆的氨基酸保守序列设计,送往生物公司合成。表1
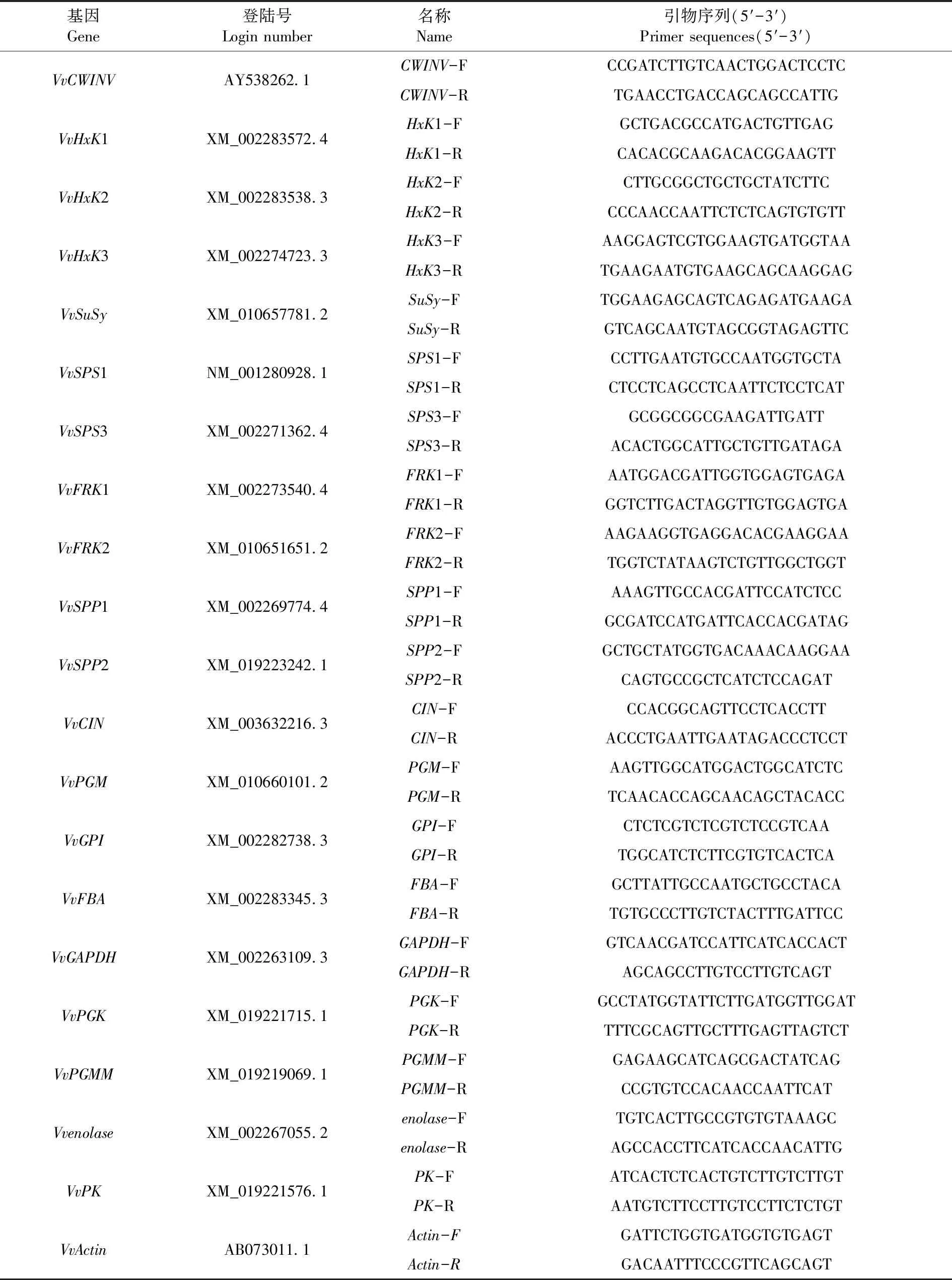
表1 木纳格葡萄糖代谢相关基因引物序列
1.2.3.4 实时荧光定量PCR
采用罗氏FastStart Essential DNA Green Master试剂盒测定基因表达水平。
1.3 数据处理
使用Sigma Plot 12.5软件作图,SPSS 19.0进行数据分析。*、**、ns分别表示P<0.05差异显著、P<0.01差异极显著和P>0.05无显著性差异。
2 结果与分析
2.1 木纳格葡萄中蔗糖、葡萄糖和果糖含量的测定
研究表明,葡萄糖、蔗糖和果糖相应的验证参数。校准曲线在范围内线性回归良好(R2=0.994 8~0.999 6)。相对标准偏差值介于0.009 0和0.020 0,回收率91.25%~98.00%。建立的测定方法能够同时定量测定果实中蔗糖、葡萄糖和果糖的含量。图1,表2
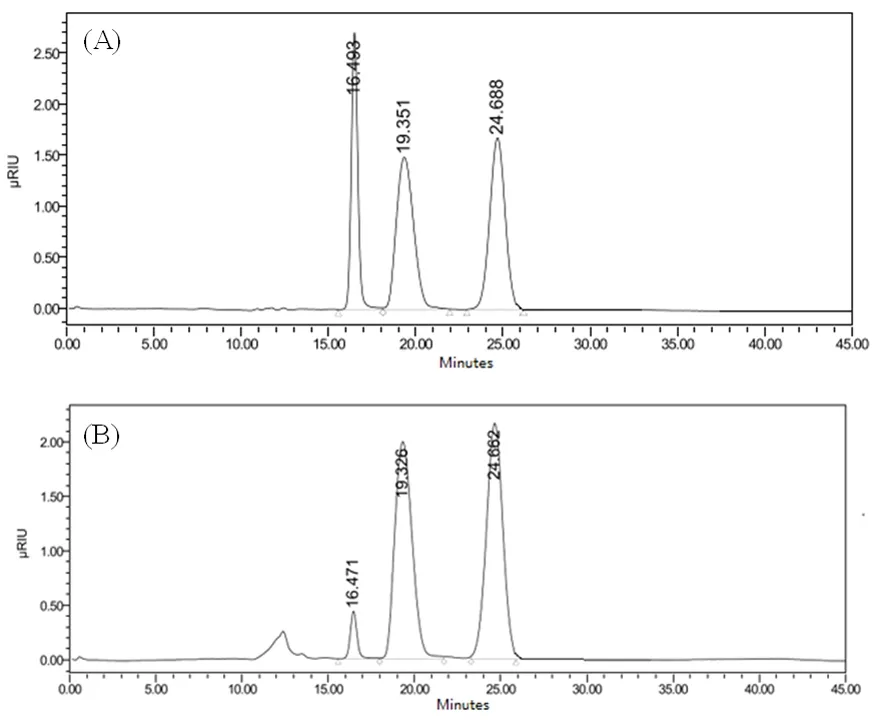
图1 HPLC色谱图-标准品(A)和样品(B)

表2 HPLC法测定葡萄中糖的验证参数
2.2 SO2对木纳格葡萄中蔗糖、葡萄糖和果糖含量的影响
研究表明,贮藏第0 d,葡萄果实中蔗糖、葡萄糖和果糖含量分别为(8.97±0.07)mg/g、(130.97±0.69)mg/g、(98.20±1.05)mg/g。葡萄果实蔗糖含量总体呈下降趋势。在前30 d,SO2处理组蔗糖含量缓慢下降,30~60 d下降速度加快,贮藏第60 d,SO2处理组与CK组果实中蔗糖含量分别为(7.93±0.05)、(7.47±0.05)mg/g。SO2处理组葡萄糖含量呈先升高后降低趋势,第10 d达到最大值(134.37±0.81)mg/g;而CK组葡萄糖含量始终呈下降趋势;贮藏第60 d,SO2处理与CK果实中葡萄糖含量分别为(120.40±1.22)、(114.27±0.87)mg/g。在贮藏过程中,SO2处理组和CK组葡萄果实中果糖含量变化趋势是相同的,0~30 d呈下降趋势,30 d达到最低值,分别为(88.97±0.86)、(84.17±0.74)mg/g,30~60 d呈上升趋势;贮藏第60 d,SO2处理组与CK组果实中果糖含量分别为(99.90±0.77)、(93.50±0.88)mg/g。SO2处理对葡萄果实的蔗糖、葡萄糖和果糖含量有显著影响,其含量明显高于CK(P<0.01)。图2
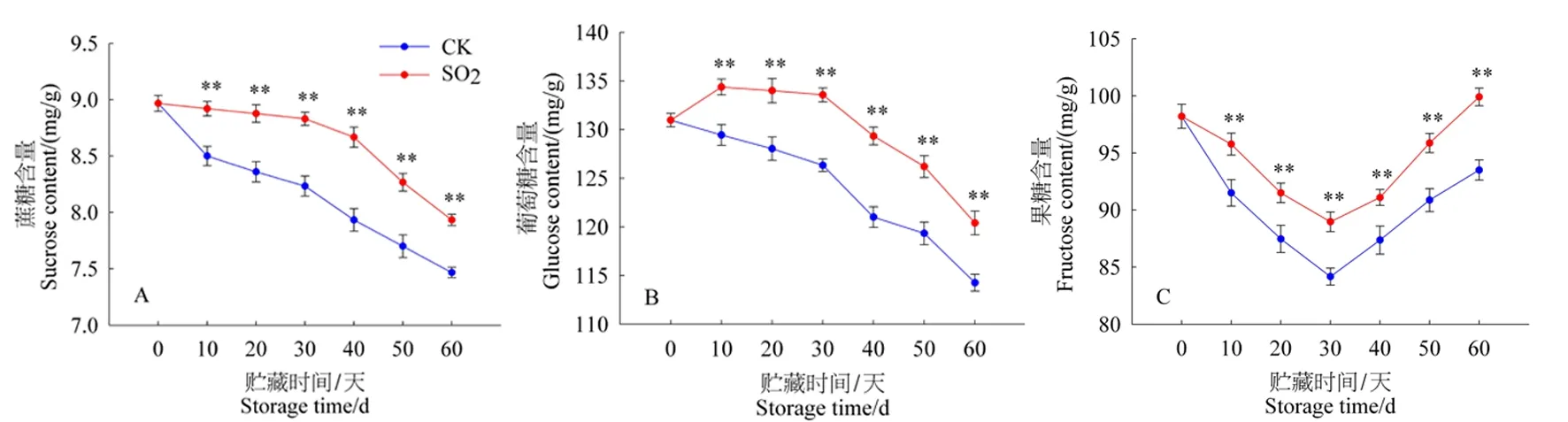
注:*、**分别表示P<0.05或P<0.01,下同
2.3 总RNA完整性
研究表明,18 s和28 s两条带,且28s条带亮度约为18s条带的2倍;A260:A280在1.82~1.96,A260:A230大于2.0,提取的总RNA没有被杂质污染且没有降解。图3
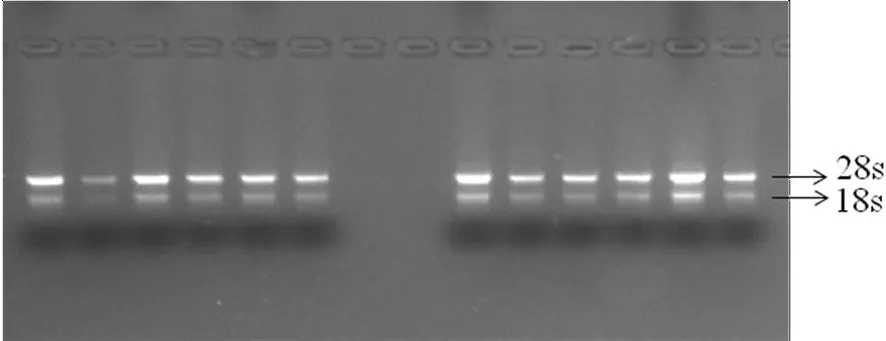
图3 木纳格葡萄总RNA琼脂糖凝胶电泳
2.4 木纳格葡萄糖代谢相关基因cDNA片段扩增
研究表明,葡萄的糖代谢相关基因cDNA扩增结果没有出现杂带和引物二聚体,条带清晰且都在100~300 bp,相似程度大于96%,扩增产物即为目的基因。图4
注(Note):泳道M:DNA标准分子量DL2 000;1:VvActin;2,3:VvCWINV;4:VvPGK;5:VvSuSy;6:VvHxK1;7:VvFRK2;8:VvFRK1;9:VvHxK2;10:VvHxK3;11:VvSPS3;12:VvCIN;13:VvSPP1;14:VvSPP2;15:VvSPS1;16:VvPGM;17:VvGPI;18:VvFBA;19:VvGAPDH;20:VvPGMM;21:Vvenolase;22:VvPK
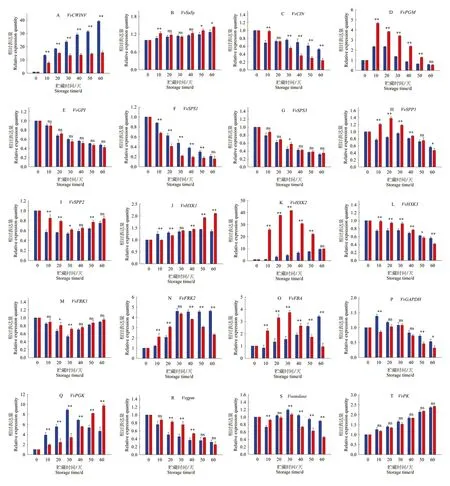
2.5 SO2对木纳格葡萄糖代谢相关基因的影响
研究表明,qRT-PCR分析的20个基因与RNA-Seq数据变化趋势一致。
与第0 d相比,VvCWINV、VvSuSy、VvHxK1、VvHxK2、VvFRK2、VvFBA、VvPGK和VvPK在葡萄中的表达在贮藏期间有所提高。CK组葡萄在贮藏期间VvCWINV的表达量增加,而SO2处理组的葡萄在0~20 d,VvCWINV的表达量持续增加,在20~60 d基本保持不变。与CK相比,SO2处理组VvCWINV的表达量较低(P<0.01)。SO2处理组葡萄的VvCWINV表达在60 d时比CK组低2.60倍,SO2处理组葡萄的VvSuSy表达在10 d时显著高于CK组(P<0.01),50 d时显著高于CK组(P<0.05),60 d时显著高于CK组(P<0.05)。在0~20 d,SO2处理组VvHxK1的相对表达量明显低于CK组(P<0.01),30 d时无显著性差异(P>0.05)。40~60 d,处理组的VvHxK1表达明显高于CK组(P<0.01)。SO2处理组VvHxK2的相对表达量明显高于CK组(P<0.01),表达量在30 d时达到峰值,是CK组的9.38倍,第60 d时表达水平高于CK组,但无显著性差异。在0~20 d,SO2处理组和CK组的VvFRK2相对表达量有相似的上升趋势,SO2处理组的样品的表达水平明显高于CK组(P<0.01)。在20~60 d,SO2处理组VvFRK2表达水平明显下调(P<0.01),呈下降趋势。
0~40 d,SO2处理组VvFBA相对表达量明显高于CK(P<0.01),30 d时达到最大值,是CK组的2.42倍。CK组中VvFBA表达水平呈上升趋势,60 d时相对表达量是SO2处理组的3.60倍。CK组VvPGK表达水平先升高后降低,在第30 d达到最高。SO2处理组VvPGK表达水平呈上升趋势。30 d时的相对表达量比CK组低2.61倍,60 d时的表达比CK组高2.09倍。CK组和SO2处理组的VvPK表达水平均呈上升趋势,差异不显著(P>0.05)。
与第0 d相比,VvGPI、VvSPS1、VvSPS3和VvHxK3在贮藏期间的表达水平呈持续下降趋势。VvGPI与VvSPS3的表达趋势相似,在第30 dVvSPS3的表达显著高于对照组(P<0.05),在其余贮藏时间VvGPI与VvSPS3的表达水平无显著性差异(P>0.05)。0~40 d,SO2处理组VvHxK3的表达水平显著高于CK组,40~60 d显著低于CK组(P<0.01)。
SO2处理组与CK组VvSPP2和VvFRK1的表达趋势相似,在0~30 d时持续下降至最低,30~60 d时表达量有所提高,但始终低于第0 d时的表达水平。在SO2处理组中,VvSPP2在第10、20、30和50 d的相对表达量,及VvFRK1在第20 d和第30 d的相对表达量均显著高于CK(P<0.05)。
SO2处理组VvSPP1的相对表达量显著高于CK组。SO2处理组第20 d和CK组第10 d,VvSPP1表达水平开始降低。0~40 d,VvSPP1表达水平显著高于CK(P<0.01),第60 d时显著低于CK(P<0.05)。
VvCIN表达水平总体呈下降趋势。在贮藏早期,SO2处理组VvCIN的表达水平的表达下降缓慢,在20 d时无显著性差异。30~60 d时,SO2处理组VvCIN相对表达量显著低于CK(P<0.01)。
VvPGM表达水平呈先升高后降低趋势。SO2处理组VvPGM相对表达量在第10 d达到最大值,而CK组在第30 d达到最大值。SO2处理组在10~50 d时VvPGM表达水平显著高于CK(P<0.01),在60 d时无显著性差异(P>0.05)。
在10、50和60 d SO2处理组VvGAPDH表达水平显著低于CK(P<0.05)。20~40 d时,SO2处理组VvPGMM表达显著高于CK(P<0.01)。SO2处理组和CK组的VvPK表达水平均呈上升趋势,但无明显差异(P>0.05)。图5
3 讨 论
3.1葡萄果实含糖量高,糖分积累在果肉(中果皮)细胞的液泡中,占成熟果实鲜重的65%~91%[10]。在葡萄中,葡萄糖和果糖占大多数,其他糖如蔗糖、棉子糖、麦芽糖和半乳糖占其余部分[11]。SO2处理可以维持葡萄果实中较高的糖含量。可溶性糖(如葡萄糖、蔗糖和果糖)浓度的增加可以提高植物对干旱、盐碱和寒冷等非生物胁迫的耐受性[12]。
植物不能直接利用蔗糖,必须被分解以提供碳和能量。一部分在细胞外分解,一部分由蔗糖特异性载体运输进入细胞。采后离体组织的CWINV基因的表达水平会增高,CWINV可以通过己糖供应给韧皮部的伴生细胞提供能量[13-15]。高CWINV活性是汇组织的一个特征,通过蔗糖水解促使韧皮部卸载[16, 17]。SO2处理消除了通常由葡萄采后引起的VvCWINV表达的增加。SuSy和CIN也是植物细胞质中促进蔗糖裂解的两个主要酶。糖的反应机制通过向细胞和器官发送信号来调节蔗糖的代谢,以适应光合产物可用性的变化[18]。SO2处理在贮藏前期和后期显著提高VvSuSy基因的表达,加速水解蔗糖,而VvCIN基因表达水平在贮藏后期比CK低,在SO2处理组果实细胞质中,蔗糖的水解在贮藏前期是由2种酶共同控制的,而贮藏后期蔗糖水解主要是VvSuSy基因起作用。果实中高蔗糖含量主要是由于SO2处理组VvCWINV和VvCIN的相对表达量高于CK组。
在贮藏过程中,VvPGM表达先升高后降低。在贮藏中期,SO2处理组的VvPGM表达高于CK组,蔗糖含量与VvPGM表达一致。SO2处理对VvGPI表达水平无明显影响。
SPS活性与蔗糖的有效性有关[19]。SPS活性所反映的蔗糖合成能力决定了蔗糖的积累,而蔗糖积累是果实品质的重要组成部分[20]。贮藏期间,果实中VvSPS表达量和蔗糖含量呈下降趋势,随着果实成熟,VvSPS基因在果实蔗糖合成中的主要作用减弱。葡萄是非跃变型水果,随着贮藏时间的延长,其呼吸作用减弱,无法为合成蔗糖所需的底物UDP-葡萄糖提供足够的ATP。SPP在催化蔗糖生物合成的最后一步中起作用,SPS产生的6-磷酸蔗糖不可逆水解为蔗糖[21]。Salerno等[22]提出,SPS纯化过程中存在一种改变SPS催化活性的蛋白被鉴定为SPP,SPS可能与SPP相互作用,从而促进更有效的蔗糖合成。虽然SO2处理VvSPP1和VvSPP2表达水平高于CK组,整体上VvSPS相对表达量的降低减少了底物(6-磷酸蔗糖)的含量,导致蔗糖含量的降低。
注:*、**、ns分别表示P<0.05、P<0.01、P>0.05
3.2HxK是一种具有独特调节功能的双功能酶,是葡萄糖信号传感网络的组成部分。酵母菌中,糖信号传感器YHxK2的过表达在转基因植物中能够增加HxK的催化活性从而降低糖信号敏感性而导致负效应的产生,过表达酵母YHXK2虽然可以提高酶催化活性,但在转基因植物中并没有对糖信号有调控功能[23]。HxK是一种抑制光合相关基因的糖传感器[24]。HxK2是EMP途径第一步的限速酶,具有负调控作用。SO2处理组光合作用的增加与VvHxK2表达水平的提高密切相关,需要进一步分析。VvHxK2相对表达量的变化与葡萄糖含量的变化趋势一致。
葡萄果实中有两种不同的果糖激酶同工酶,分别是FRK1和FRK2。FRK2对果糖的亲和力远远高于FRK1。高浓度的果糖能抑制FRK2的活性,而不能抑制FRK1的活性[25]。研究中,VvFRK的表达水平与果糖含量变化之间也存在这种关系,并且在SO2处理组中表现得更为明显。
3.3SO2处理组在贮藏第10 d葡萄糖含量的升高主要与VvCIN和VvSuSy表达水平高有关,而贮藏期间的高葡萄糖含量也与VvSPS1表达低有关。SO2处理组贮藏期间的高果糖含量与VvCIN、VvSuSy的高表达、VvSPS1的低表达有关。
EMP是葡萄糖氧化的一个重要代谢途径。研究表明,在醛缩酶过表达的植物中,光合速率的增加导致生长和生物量的增加[26]。SO2处理使葡萄中VvFBA基因的表达水平高于CK组,这可能是其能够促进果实光合作用的原因之一。
研究发现,SO2处理组VvGAPDH的表达水平低于CK组。需要进一步的试验来阐明NADP-甘油醛-3-磷酸脱氢酶在光合作用中的失活机制[27]。
在植物中,PGKs不仅参与EMP途径和糖异生途径,还参与光合碳代谢。Pgk1.1基因低表达突变体表现出生长速度缓慢和光合能力下降[28]。经过SO2处理后,VvPGK的表达水平不断提高,激活EMP途径,从而增强葡萄收获后的光合活性。
PGK与PGMM在体外存在相互作用[29]。在CK组中,VvPGMM的表达在贮藏期间下降。贮藏中期,SO2处理组VvPGMM的相对表达量低于CK,导致EMP途径增强。enolase活性的降低会影响次级代谢,但不会抑制呼吸速率[30]。与CK相比,SO2处理组Vvenolase的表达水平在整个贮藏期间都很低,引起了一些次生代谢变化。
丙酮酸通过PK以磷酸烯醇丙酮酸为原料合成。特别是当用于输出和呼吸过程的可用光同化物较少时,PK在调节夜间呼吸方面起关键作用[31]。SO2处理对VvPK表达水平无明显影响。
4 结 论
SO2可以调节木纳格葡萄采后贮藏中的糖代谢相关途径。SO2可以维持葡萄果实中的蔗糖、葡萄糖和果糖含量,主要是0~10 d时葡萄糖含量显著提高。贮藏第60 d,SO2处理组果实蔗糖、葡萄糖和果糖含量分别比CK组高0.47、6.13、6.40 mg/g。经qPCR验证,糖代谢相关基因的相对表达量与转录组图谱对应基因的表达量变化趋势一致;SO2主要通过调控VvCWINV、VvCIN、VvSuSy和VvSPS1基因的表达水平来维持葡萄果实的高糖含量;通过调控VvHxK2、VvFBA、VvGAPDH和VvPGK基因的表达水平来激活葡萄果实采后贮藏过程中的光合活性。
