恩替卡韦联合聚乙二醇干扰素抗病毒治疗对慢性乙型肝炎患者HBV-RNA水平的影响
2023-06-19马超曾明辉黄玉贤张钰斌邱少霞范红顺
马超,曾明辉,黄玉贤,张钰斌,邱少霞,范红顺
粤北第二人民医院感染科,广东韶关 512028
慢性乙型病毒性肝炎(chronic hepatitis B,CHB)是由乙型肝炎病毒(hepatitis B virus,HBV)感染引起的肝脏慢性炎症性疾病。目前,我国约有7 000万例HBsAg携带者,其中CHB患者为2 000~3 000万例[1-2]。CHB患者肝组织内ccc-DNA的持续存在是CHB难以治愈且停药后易复发的主要原因[3]。1984年,Miller等首次观察到与DNA杂合的HBV-RNA;1996年,德国学者Köck证实了慢性HBV感染者的血清中存在多聚腺苷酰(polyA)化的HBV-RNA。2016年,证实血液中HBV-RNA的主要来源为未经逆转录的HBV pgRNA。HBV-RNA作为新的病毒学指标近年得到更多关注,2019年以来我国、欧洲及美国肝病学会均推荐其作为cccDNA存在和转录活性的指标[4-6]。肝组织ccc-DNA的检测需要肝活体组织检查,因为是有创检查,推广受限,而血清HBV-RNA水平可反映肝组织内ccc-DNA的活性,并与患者病毒学应答和预后有关[7-8]。
目前,PEG-IFN-α治疗下血清HBV-RNA可否准确反映cccDNA的水平及其转录活性,仍需进一步明确。基于此,本研究以2021年1月—2022年6月粤北第二人民医院收治的恩替卡韦口服1年以上HBV-RNA阴性的39例慢乙肝患者为研究对象,加用聚乙二醇干扰素α-2b联合原有的恩替卡韦治疗24周后,测定CHB患者的血清HBV-RNA水平,分析其与各临床指标的相关性,旨在为将HBVRNA作为CHB治疗评估的新型病毒学指标提供参考。现报道如下。
1 资料与方法
1.1 一般资料
本研究纳入本院收治的39例慢性乙型肝炎患者,平均年龄(49.1±10.7)岁;男29例,女10例;HBeAg阳性3例,HBeAg阴性36例。本研究得到医院医学伦理委员会的批准,患者均在充分了解研究计划后签署了知情同意书。
1.2 纳入与排除标准
纳入标准:①符合2019年版慢性乙型肝炎相关诊断标准;②患者已连续服用恩替卡韦(国药准字20100129)0.5 mg ,1次/d 1年以上,间隔3个月以上两次经罗氏Cobas试剂检测,均证实高敏HBV-DNA<20 IU/mL;③知情同意加用聚乙二醇干扰素α-2b 180 µg或135 µg,皮下注射,1次/周,联合原有的恩替卡韦口服,抗病毒治疗24周。
排除标准:①重叠甲型肝炎病毒(hepatitis A vi⁃rus,HAV)、丙型肝炎病毒(hepatitis C virus,HCV)、丁型肝炎病毒(hepatitis D virus,HDV)、戊型肝炎病毒(hepatitis E virus,HEV)等其他嗜肝病毒感染;②合并有人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染;③合并有药物性肝病、自身免疫性肝炎、原发性硬化性胆管炎等其他肝损害病因;④肝恶性肿瘤。
1.3 方法
依据HBV-RNA阴性或阳性分组。所有患者均进行血常规、肝功能、HBV血清标志物、HBV-RNA、肝脏彩超等检测。高敏HBV-RNA检测采用罗氏诊断COBAS试剂,检测下限20 IU/mL。乙肝五项血清标志物(hepatitis B virus serum markers,HBV-M),采用乙型肝炎诊断试剂盒,以化学发光法进行检测,其中乙肝表面抗原定量(quantification of hepatitis B sur⁃face antigen,qHBsAg),参考值范围为0~0.05 IU/mL,有效检测范围0.05~250.00 U/mL,乙肝病毒e抗原(hepa⁃titis B e antigen,HBeAg)参考值范围为0~0.1 IU/mL。肝功能指标的检测,采用贝克曼680全自动生化分析仪。以血清丙氨酸氨基转移酶(alanine amino⁃transferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)作为观察指标。
HBV-RNA检测采用实时荧光核酸恒温扩增检测技术(simultaneous amplification and testing,SAT)配套仪器为AutoSAT全自动核酸检测分析系统,原理为HBV特异性RNA寡核苷酸磁珠微粒提取靶标RNA,MMLV酶逆转录靶标RNA为cDNA,T7 RNA聚合酶转录cDNA,合成大量可检测的RNA负链,用含荧光和淬灭基团的RNA分子信标进行检测。检测过程无需DNA酶处理、并采用内标定量,样本的提取、洗涤、扩增、检测及定量结果均由配套仪器完成。通过HBV-RNA阴性、弱阳性、强阳性人血清稀释样本建立检测线性范围和标准曲线,得到每个样本HBV-RNA的浓度。检测下限50 copies/mL,线性范围2~8 log copies/mL。
1.4 统计方法
采用SPSSAU在线统计学软件进行数据处理。将HBsAg定量及HBV-RNA检测结果进行对数转换。符合正态分布的计量资料以()表示,比较采用t检验。计数资料以例数和百分数(%)表示,比较采用χ2检验。HBV-RNA与HBeAg及qHBsAg水平之间的相关性采用Pearson相关系数(r)分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较
据患者血清HBV-RNA是否可检出分为两组,RNA阴性患者18例为A组,占比46.2%,其中HBeAg阴性18例,HBeAg阳性0例;男4例,女14例。RNA阳性患者21例为B组,占比53.8%,其中HBeAg阴性18例,HBeAg阳性3例(HBV-RNA均为阳性);男6例,女15例。两组临床资料比较,差异无统计学意义(P>0.05),见表1。
表1 两组患者临床资料比较()

表1 两组患者临床资料比较()
项目ALT(U/L)AST(U/L)PLT(×109/L)年龄(岁)A组(n=18)32.56±14.13 29.11±10.13 170.17±48.91 52.50±12.09 B组(n=21)38.67±35.56 33.57±22.52 163.29±69.28 46.29±8.72 t值-0.724-0.775 0.362 1.859 P值0.476 0.443 0.720 0.071
2.2 两组HBsAg定量水平比较
A组的HBsAg定量水平低于B组,差异有统计学意义(P<0.05),见表2、图1。
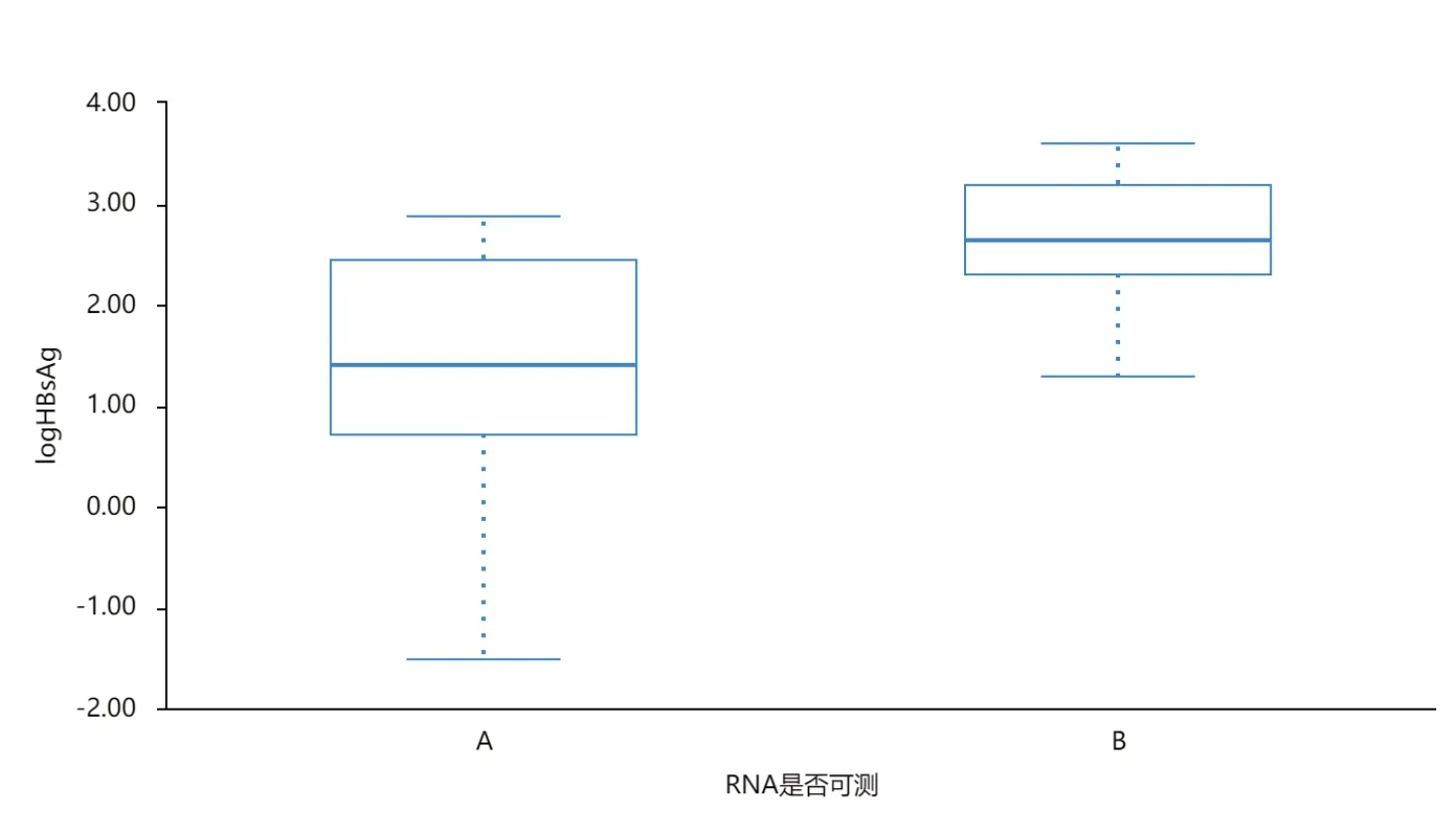
图1 HBsAg在HBV-RNA分组中的分布箱线图
表2 HBV-RNA阴性和阳性组HBsAg的比较[(),IU/mL]

表2 HBV-RNA阴性和阳性组HBsAg的比较[(),IU/mL]
项目log10(HBsAg)A组(n=18)1.29±1.30 B组(n=21)2.66±0.65 t值-4.053 P值<0.001
2.3 HBV-RNA与临床特征相关性分析
CHB患者血清HBV-RNA可测与qHBsAg(r=0.485,P=0.002)、HBeAg(r=0.387,P=0.015)呈中等程度正相关。与ALT、AST、PLT、年龄、性别等变量无相关关系,见表3。

表3 HBV-RNA与临床特征相关性分析
2.4 CHB患者血清HBV-RNA水平的影响因素分析
分别以年龄(赋值:连续性变量)、性别(赋值:男=1,女=2)、ALT(赋值:连续性变量)、AST(赋值:连续性变量)、qHBsAg(赋值:对检测结果进行对数转换)、HBeAg定量为自变量,以血清HBV-RNA为因变量[赋值:对检测结果进行对数转换,即log(HBV-RNA),连续性变量],进行多因素线性回归分析。结果显示,qHBsAg是CHB患者血清HBVRNA水平的影响因素(P<0.05),见表4。

表4 CHB 患者血清HBV-RNA水平的影响因素线性回归分析结果(n=39)
3 讨论
既往研究显示:核苷酸类似物(NAs)抗病毒治疗前,HBV-RNA与HBV-DNA、HBsAg、HBcrAg(乙型肝炎病毒核心抗原相关抗原)均呈正相关,HBeAg阳性患者则更明显[9-10]。NAs抗病毒治疗后与HBV-DNA和HBsAg相关性会逐渐下降甚至消失,但与HBcrAg之间始终保持较好的相关性。接受长效干扰素治疗的患者,HBV-RNA与DNA、HB⁃crAg在治疗前后均具有良好的相关性,但治疗后与HBsAg的相关性明显减弱,甚至失去相关性。
那么,同时接受NAs和长效干扰素治疗的患者,HBV-RNA的特点及能否用来预测抗病毒治疗效果或指导NAs停药,这方面的资料较少,通常,选择NAs可强效抑制病毒复制,促进HBV-DNA转阴,而NAs+peg-IFN联合治疗后,可促进HBsAg下降,治疗前HBsAg低水平(<1 500 IU/mL)及治疗中HB⁃sAg快速下降(12周或24周时HBsAg<200 IU/mL或下降>1 lg IU/mL)的患者,联合治疗后HBsAg阴转的发生率较高[11]。
本研究纳入经过NAs抗病毒治疗后,HBV DNA已转阴,且愿意继续加用长效干扰素的患者为研究对象,入组人群中绝大多数已实现HBeAg血清学转换。通过测定HBV-RNA水平,并考察HBV-RNA与其他临床指标的相关性。本研究提示,经过序贯联合治疗后,HBV-RNA与qHBsAg、HBeAg仍具有中等程度相关性(r=0.485、0.387,P<0.05)。本研究发现,经过口服核苷(酸)类似物恩替卡韦治疗后,HBV-DNA和HBeAg双转阴的患者占比达92.3%(36/39),HBV-DNA和HBeAg双阴性患者中却仍有61.1%(22/36)的患者HBV-RNA仍可检出,且3例HBeAg阳性患者HBV-RNA均为阳性。箱线图提示HBV-RNA与HBsAg水平密切相关,表面抗原滴度低于10 IU/mL者(HBsAg<1log),HBV-RNA检测值均为阴性;而HBV-RNA转阴的患者,HBsAg整体水平较低,多在2.5log以下(见图1)。
李小鹏等[12]选取70例高敏HBV-DNA检测均为阴性的CHB患者,发现58例患者血清HBV-RNA仍为阳性,达到(2.7±1.1)log copies/mL,血清HBVRNA水平与HBeAg 水平呈显著正相关(r=0.467,P=0.01),但与qHBsAg水平无显著相关(r=0.146,P=0.275)。本研究发现,qHBsAg及HBeAg均是CHB患者血清HBV-RNA水平的影响因素,CHB患者血清HBV-RNA可测与HBsAg(r=0.485,P=0.002)、HBeAg(r=0.387,P=0.015)中等程度相关,进一步的线性回归分析仅显示qHBsAg为影响因素,可能与入组患者中HBeAg阳性例数较少有关,二者相关性尚待进一步更大样本量的研究证实。
NAs停药后临床复发的预测一直是关注的热点。基于目前国内外指南推荐的停药标准[1,13-14],联合HBV-RNA指标可进一步降低停药后复发风险。然而,研究表明即使血清HBV-RNA转阴,也仍有部分患者存在复发风险,可见仍未真正达到“安全”停药之目标。2020年南方医科大学的研究团队发现,联合血清HBV-RNA及其他指标可以进一步降低停药后临床复发率[15]。基于既往停药标准(HBV-DNA和HBeAg转阴),NAs停药后4年累积临床复发率高达30.8%,通过联合HBV-RNA,NAs停药后4年累积临床复发率降至15.3%;而进一步联合HB⁃crAg,4年累积临床复发率则为0%。这项研究提示将HBV-RNA、HBcrAg两个指标联合用于预测NAs停药后的临床复发大有可为。2021年香港大学袁孟峰教授团队发表在GUT杂志上的一项研究,发现停药时HBV-RNA阴性+HBsAg<10 IU/mL的患者,NA停药后1年累积病毒学复发率为9.1%,显著低于单独使用HBV-RNA或HBsAg水平指导停药的患者(分别为36%~52%和36.7%)[16]。本研究证实,HBsAg低于10 IU/mL的患者,HBV-RNA一般呈阴性,故也可指导没有条件行HBV-RNA检测的地区或患者,若有强烈停药意愿,也可通过对HBsAg定量检测的充分评估,尝试停药。而HBV-RNA阳性组同时也伴有高水平的HBsAg(平均值2.5log),与我国专家共识一致[9]:对于符合现行停药标准的接受巩固治疗的患者,若血清HBV-RNA检测阳性,停药后疾病复发风险较大,不建议停药。
综上所述,经过NAs及peg-IFN-α序贯治疗后,HBV-DNA阴性的CHB患者血清HBV-RNA水平存在较大差异,HBeAg、qHBsAg与血清HBV-RNA水平具有相关性,且qHBsAg是CHB患者HBV-RNA低于检测下限的影响因素。研究显示,低水平HB⁃sAg(<10 IU/mL)多提示HBV-RNA阴性,CHB患者血清HBV-RNA水平在一定程度上可反映cccDNA转录活性,今后有望指导NAs停药。本研究仍有着局限。没有联合干扰素前的HBsAg定量及HBVRNA资料,难以比较其动态变化。样本量较少,HBeAg阳性的患者较少。之后将在下一步的工作中,通过更完善的研究设计,加以改进,以进一步探索HBV-RNA的预测效能。
