ICU重症患者脓毒症发生风险预测模型的构建与验证
2023-06-19王丹丹张丽中李筱妍
王丹丹,张丽中,李筱妍
(1山西医科大学公共卫生学院环境卫生学教研室,太原 030001;2山西医科大学第三医院,山西白求恩医院,同济山西医院检验科;3山西医科大学第三医院,山西白求恩医院,同济山西医院呼吸与危重症医学科;*通讯作者,E-mail:2415960869@qq.com)
近几年,随着新型冠状病毒感染(COVID-19)大流行,人们对脓毒症的关注日益增加,重症COVID-19并发脓毒症,明显增加了患者的病死率[1],从而更加突显了脓毒症高病死率和缺乏有效早期识别的标志物的问题。据最新研究显示,亚洲国家重症监护室的脓毒症总患病率为22.4%[2],且每年导致全球近1 100万人死亡,约占所有死亡原因的五分之一[3]。因此,世界卫生组织(WHO)将脓毒症视为健康优先事项[4]。在脓毒症患者的管理中,最重要的是脓毒症是一种医疗紧急情况,与多发性创伤、急性心肌梗死和中风一样,在脓毒症发生后的最初几个小时内及早发现并立即进行适当的治疗可改善预后[5]。但脓毒症是一种异质性较高的综合征,不同感染病原体,不同感染部位以及不同的器官功能障碍,且经常与非感染性炎症条件重叠,目前尚缺乏快速可靠的检测手段,因此积极探索脓毒症早期识别的预测模型具有重要意义。列线图(nomograph),又称诺莫图,目前被广泛用于疾病诊断及预后预测[6]。其将复杂且难以计算的回归方程转换成便于理解和使用的线条图形,既可以整合多个预测指标,又可以将统计预测模型简化为时间概率的单一数字估计[7]。本研究的目的是构建和验证一个基于临床易获得的指标预测脓毒症发生的模型,便于临床医生早期识别脓毒症并及早干预,以改善患者的预后。
1 材料与方法
1.1 研究对象
选取山西白求恩医院2021年5月至2022年10月期间重症监护病房(ICU)收治的脓毒症患者85例作为病例组,非脓毒症重症患者86例作为对照组。根据脓毒症Sepsis 3.0诊断[8]标准:对于ICU的感染或可疑感染患者,当脓毒症序贯器官衰竭评分(sepsis-related organ failure assessment,SOFA)变化量≥2分时,则可诊断。纳入标准:①病例组:符合上述脓毒症诊断标准;年龄≥18岁;知情同意。②对照组:不符合上述脓毒症诊断标准,但病情危重需入住ICU;年龄≥18岁;知情同意。排除标准:①年龄<18岁者;②入院即死亡、转院的临床资料不完善的患者;③慢性、恶性疾病终末期患者;④手术后因观察病情暂时入住ICU的患者;⑤既往有精神病史或认知功能障碍者;⑥拒绝参与研究或拒绝签署知情同意书者。本研究经医院临床伦理委员会批准(SBQLL-2020-009),患者家属自愿签署知情同意书。
1.2 观察指标
收集患者临床病例资料,包括年龄、性别(sex)、白细胞计数(WBC)、中性粒细胞计数(NEUT)、淋巴细胞(LY)、中性粒细胞计数和淋巴细胞计数比值(NLR)、降钙素原(PCT)、C反应蛋白(CRP)、SOFA评分、急性生理学和慢性健康状况评分系统Ⅱ(APACHE Ⅱ评分)、肌酐(Scr)、血小板(PLT)。各指标单位为目前国际通用单位。
1.3 统计分析
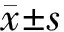
2 结果
2.1 患者基线资料比较及分组情况
本研究共收集269例患者资料,其中数据缺失剔除68例,异常值剔除30例,最终共171名患者纳入最终分析,其中85例符合脓毒症诊断标准,86例不符合。按照8∶2的比例随机分为训练集139例,验证集32例。在训练和验证队列中,分别有69例和16例患者被最终诊断为脓毒症,具体信息见表1。
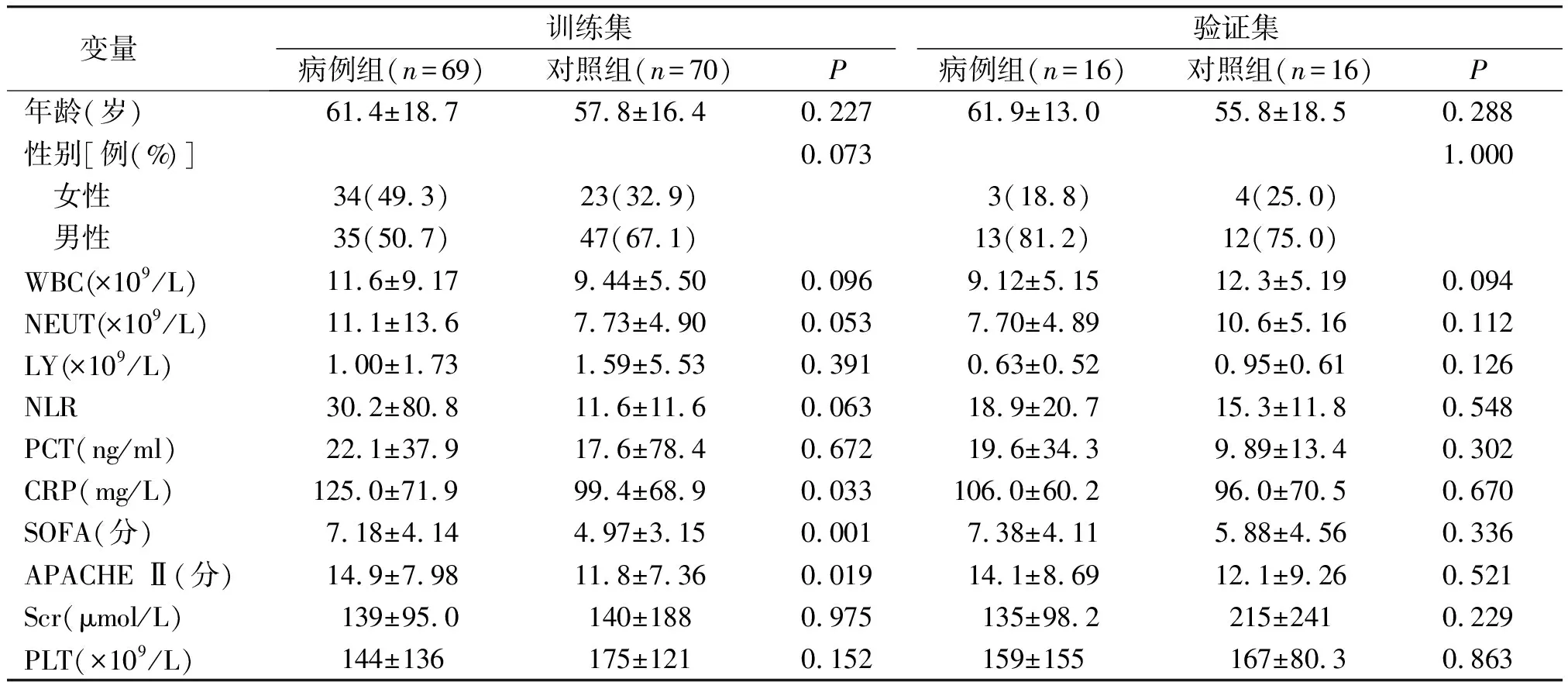
表1 训练集和验证集患者临床资料的比较
2.2 ICU重症患者发生脓毒症的单因素分析结果
为避免有意义的指标被剔除,以P<0.2为检验水准筛选脓毒症危险因素,单因素分析结果显示8个指标有意义:性别、WBC、NEUT、NLR、CRP、PLT、SOFA评分和APACHE Ⅱ评分(P<0.2,见表2)。
表2 训练集患者发生脓毒症的危险因素的单因素分析结果
2.3 ICU重症患者发生脓毒症列线图预测模型的构建
采用逐步回归法建模,以AIC值为准则筛选模型,为了比较所含解释变量个数不同的多元回归模型的拟合优度,AIC值是常用的标准之一。当所增加的解释变量能够减少AIC值时才能在原模型中增加该解释变量。笔者将上述得出的8个变量进行排列组合,得到共255种组合形式,分别求得各模型的AIC值。预测模型的AIC值越小,则拟合效果越好,较小的前8个模型的AIC值见表3。根据分析结果,研究者构建出一个基于性别、NLR、SOFA的列线图模型(见图1),模型中变量的参数见表4。
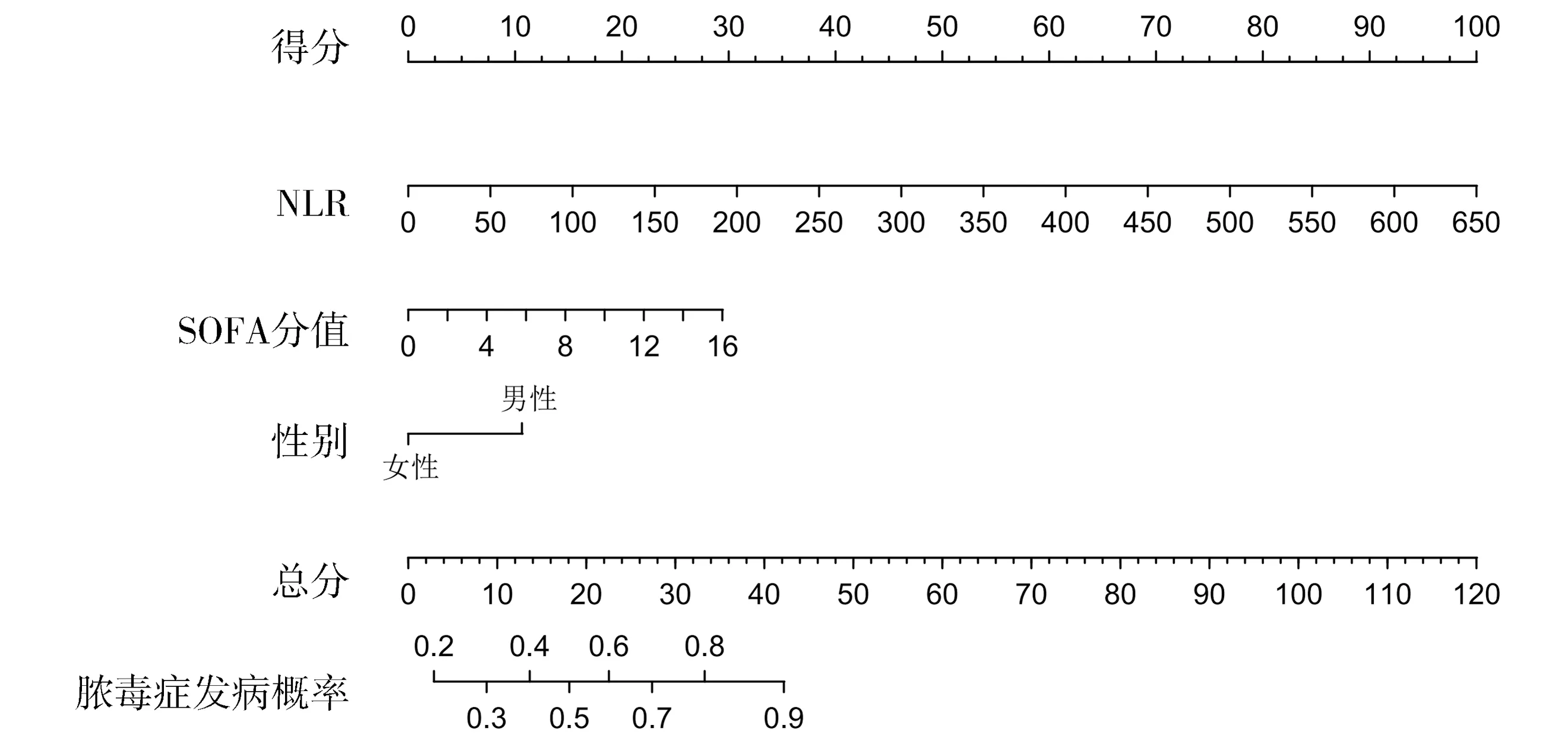
图1 ICU重症患者发生脓毒症的列线图预测模型

表3 各模型的AIC值
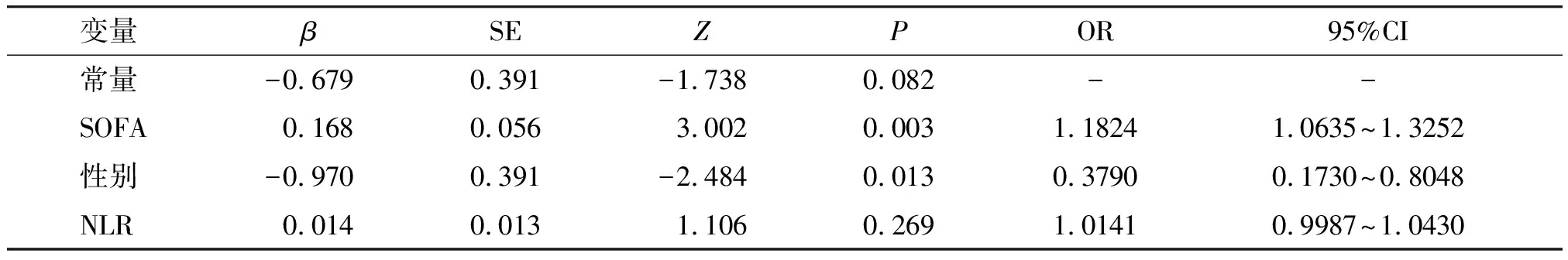
表4 预测模型中变量的参数
2.4 ICU重症患者发生脓毒症的列线图预测模型的评价
基于筛选出的模型,研究者采用AUC值评价模型的区分度,训练集的AUC为0.722(95%CI 0.637~0.807),表明列线图的预测能力具有可靠性(见图2)。从校准曲线可以看出,列线图的校准曲线和标准曲线在训练集中高度一致(见图3)。靠近对角线虚线的校准曲线表明预测概率和实际概率之间的良好一致性。绘制模型在训练集中的临床决策曲线(见图4),其中横轴是用于定义高风险的风险阈值,纵轴是在给定阈值时的净收益。DCA曲线表明,当高风险阈值为0.26~0.83时,净收益率大于0,具有临床意义,且高风险阈值越小,净收益率越大,临床效用越好。Hosmer-Lemeshow拟合优度检验结果显示χ2=5.335,P=0.804>0.05,提示在可接受的水平上模型的估计拟合了数据,表明预测模型工作效果良好。因此,该列线图在预测脓毒症发生方面具有良好的临床价值。
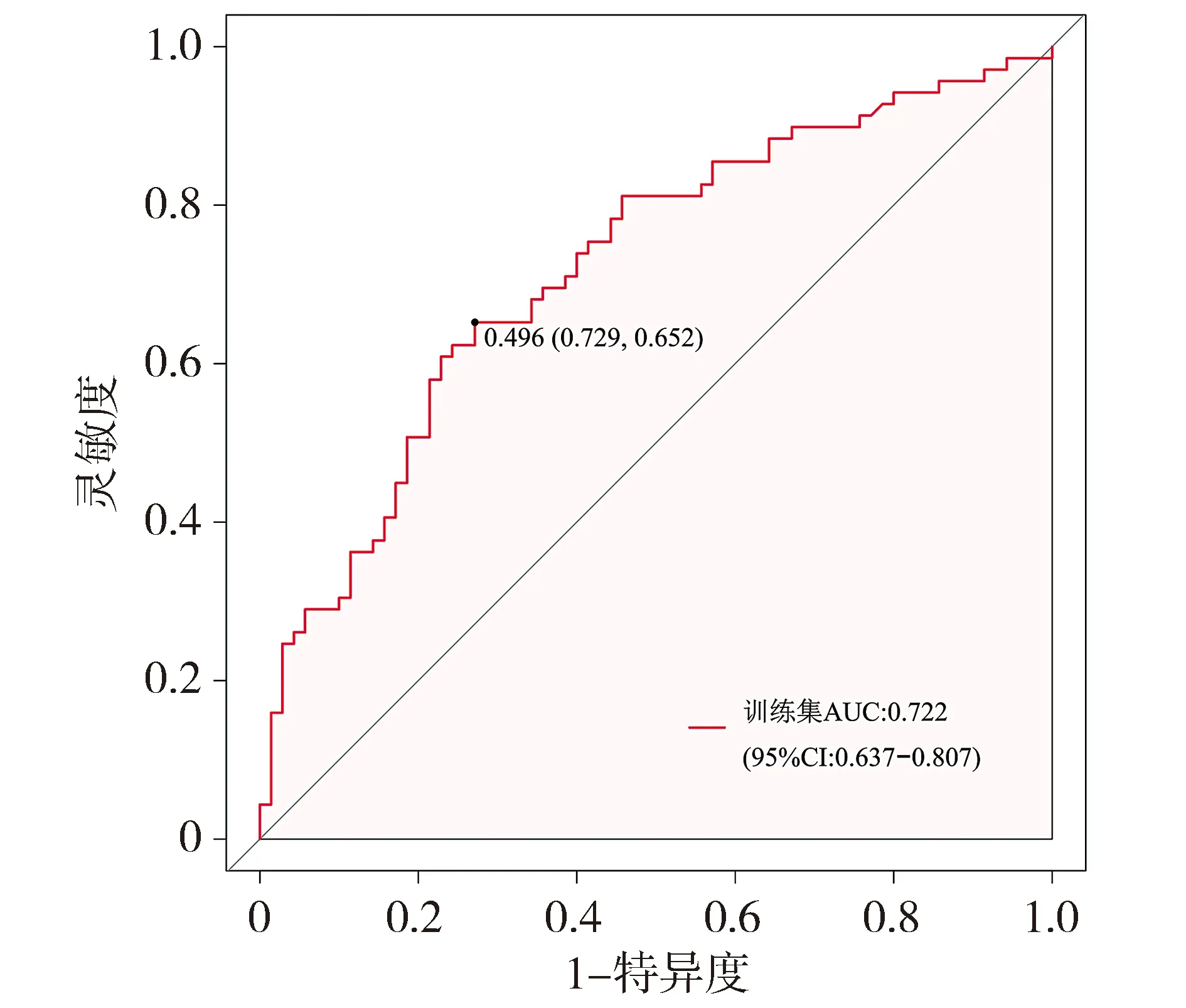
图2 列线图在训练集的ROC曲线
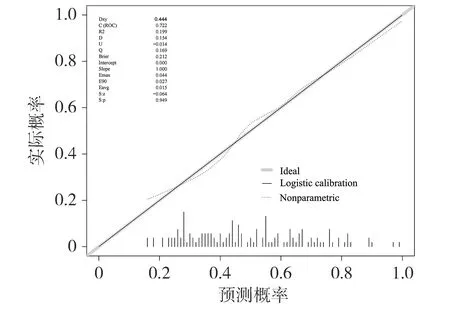
图3 列线图在训练集的校准曲线图
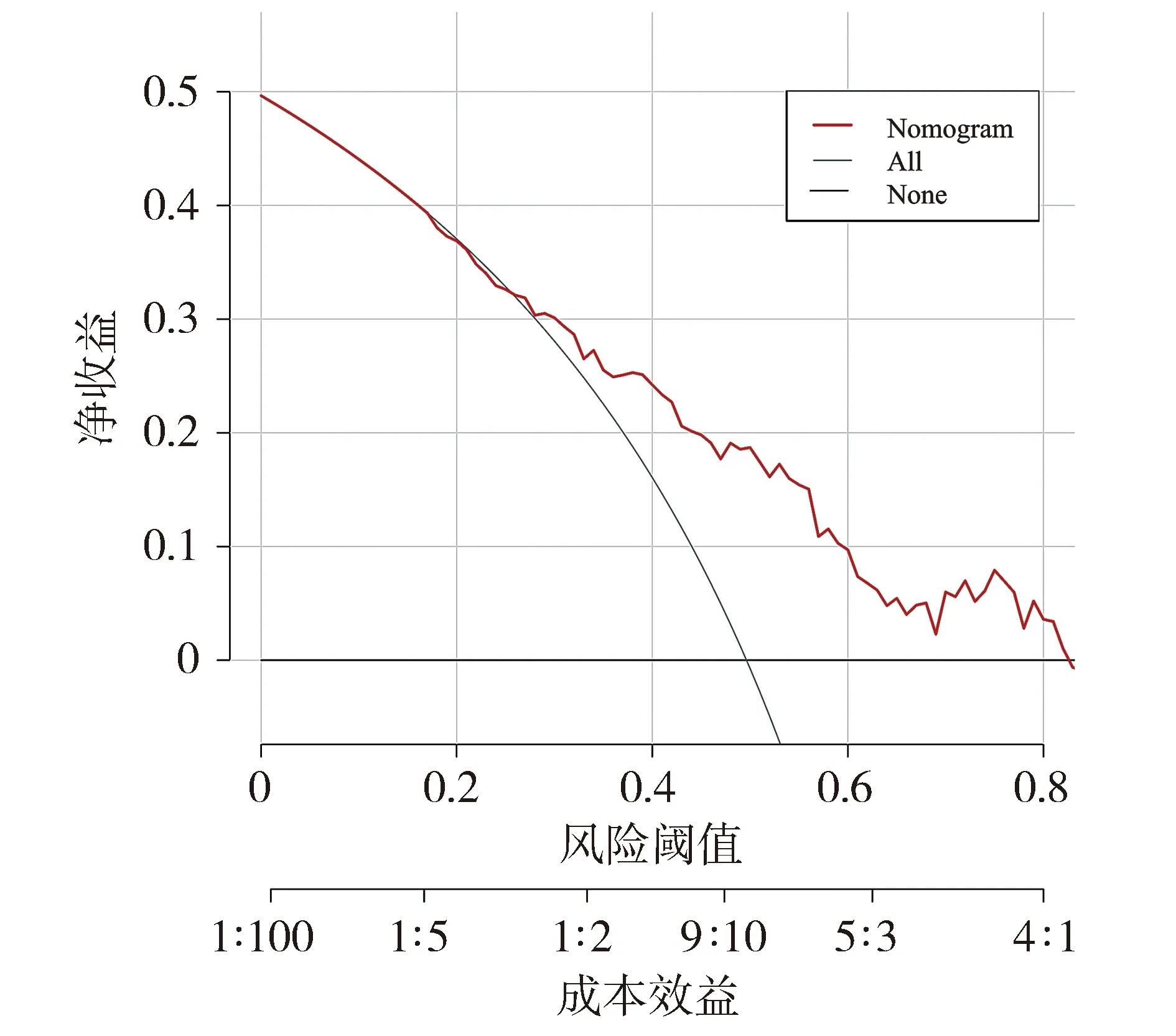
图4 列线图在训练集的临床决策曲线
将验证集中患者数据代入已构建的列线图,其对脓毒症的预测AUC值为0.602(见图5)。该模型在验证集中的校准曲线和临床决策曲线见图6和图7。Hosmer-Lemeshow拟合优度检验结果显示χ2=16.795,P=0.050 2。
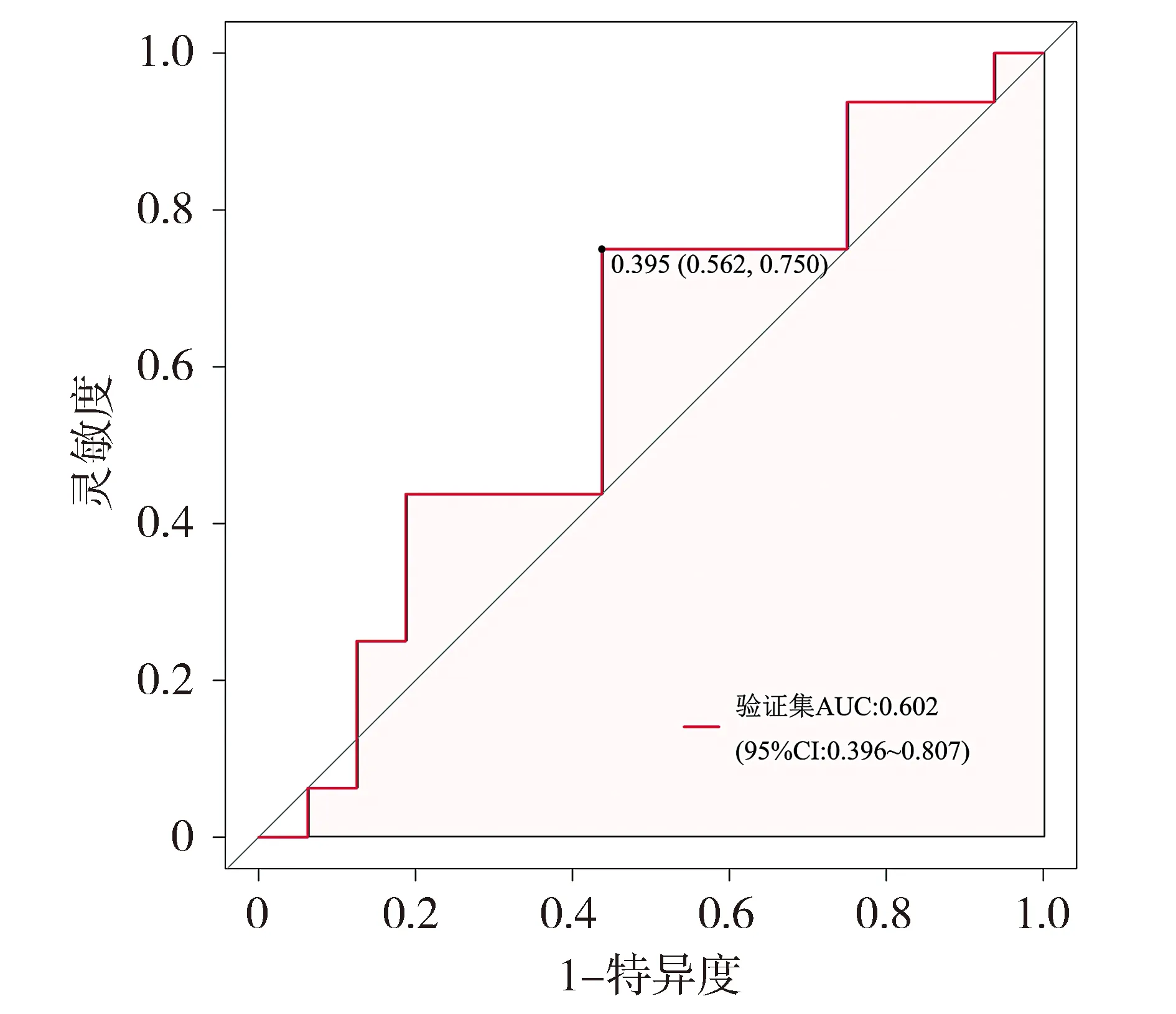
图5 列线图在验证集的ROC曲线
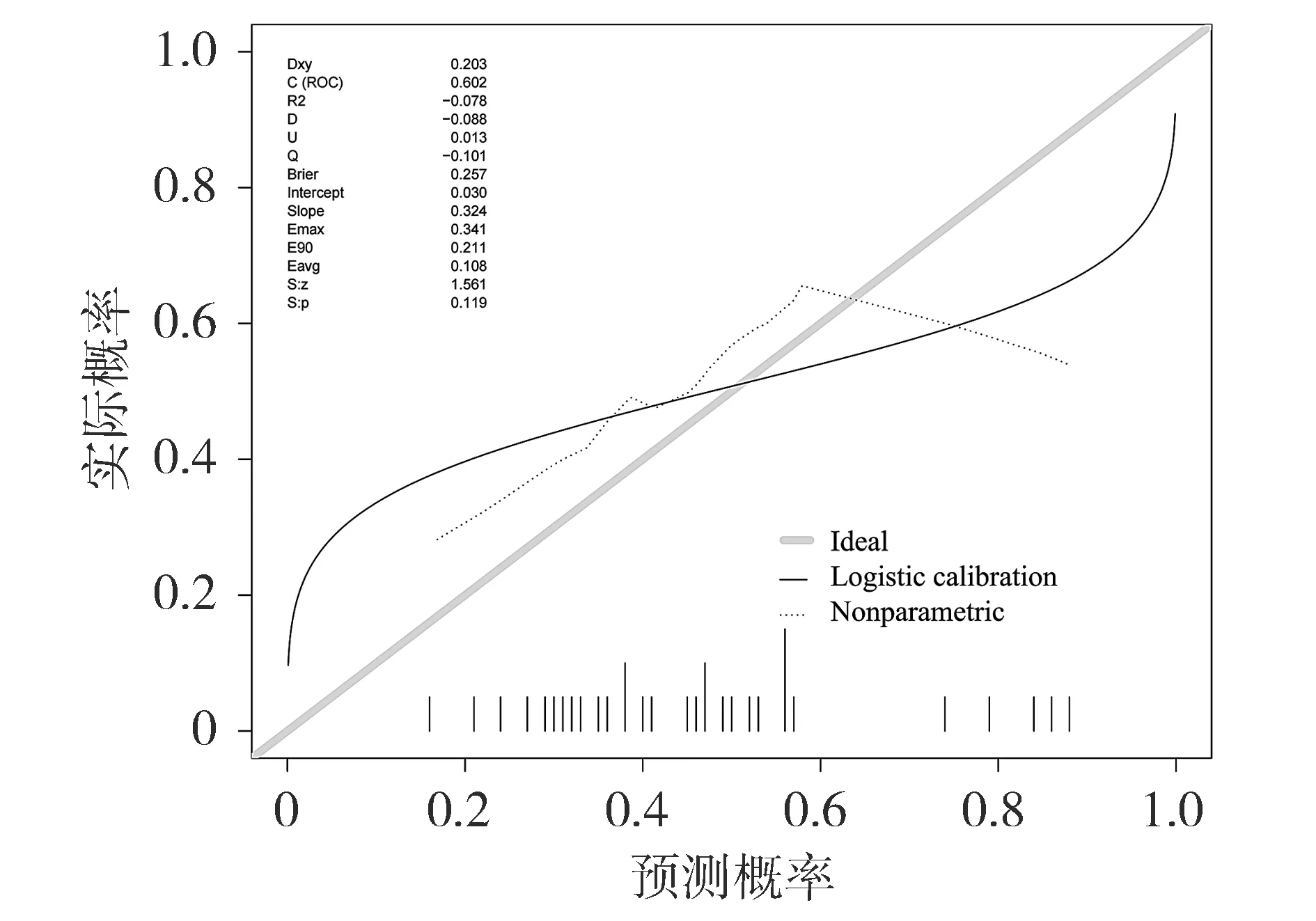
图6 列线图在验证集的校准曲线
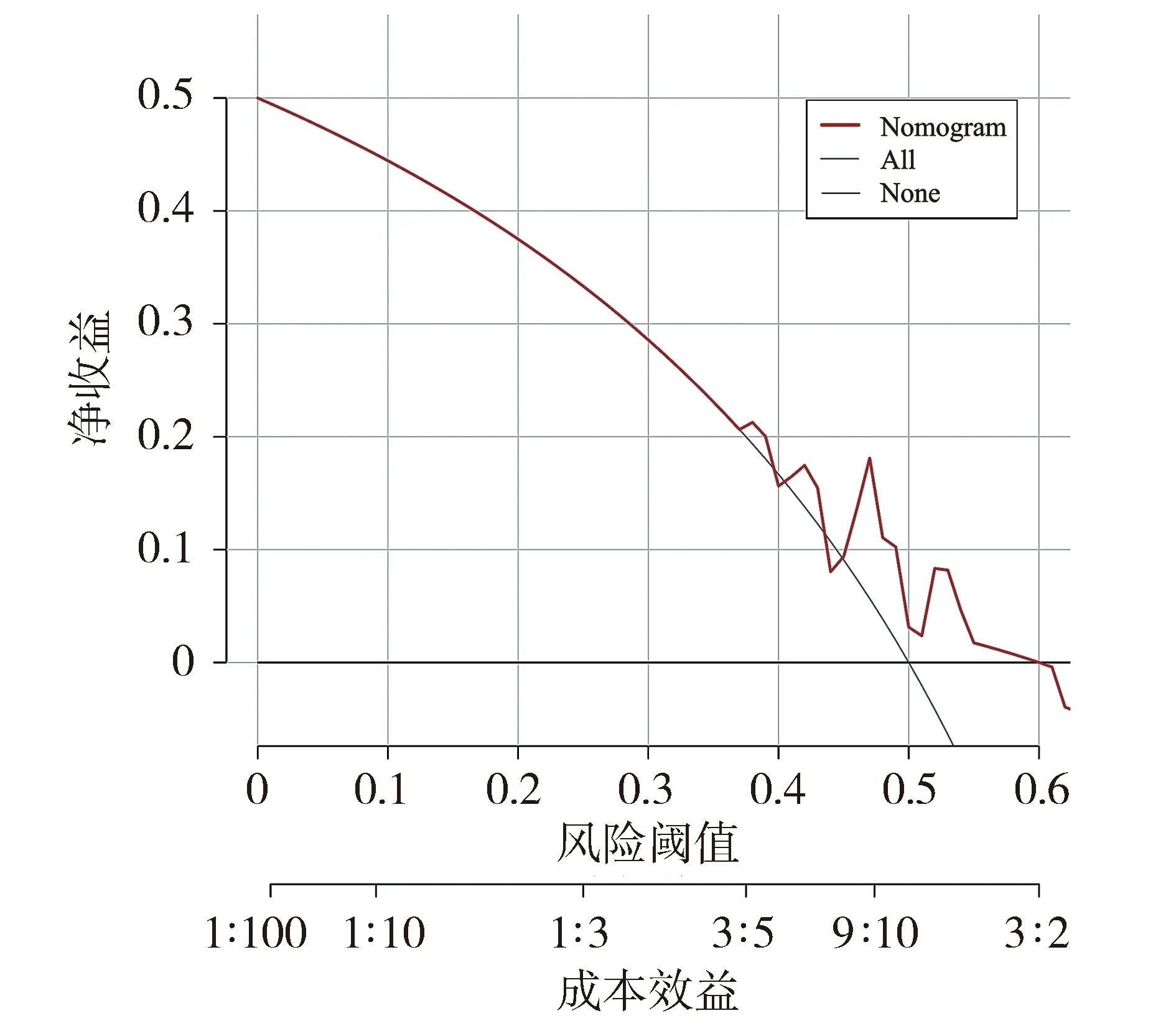
图7 列线图在验证集的临床决策曲线
2.5 预测模型的比较
本研究对各个列线图模型的效能进行比较:通过单个指标NLR、SOFA、性别早期识别脓毒症的AUC比3个指标联合预测脓毒症的AUC低(见图8)。笔者还对PCT、CRP进行比较,结果显示,仍是该模型的AUC最大(见图9),提示该模型具有一定的临床指导意义。
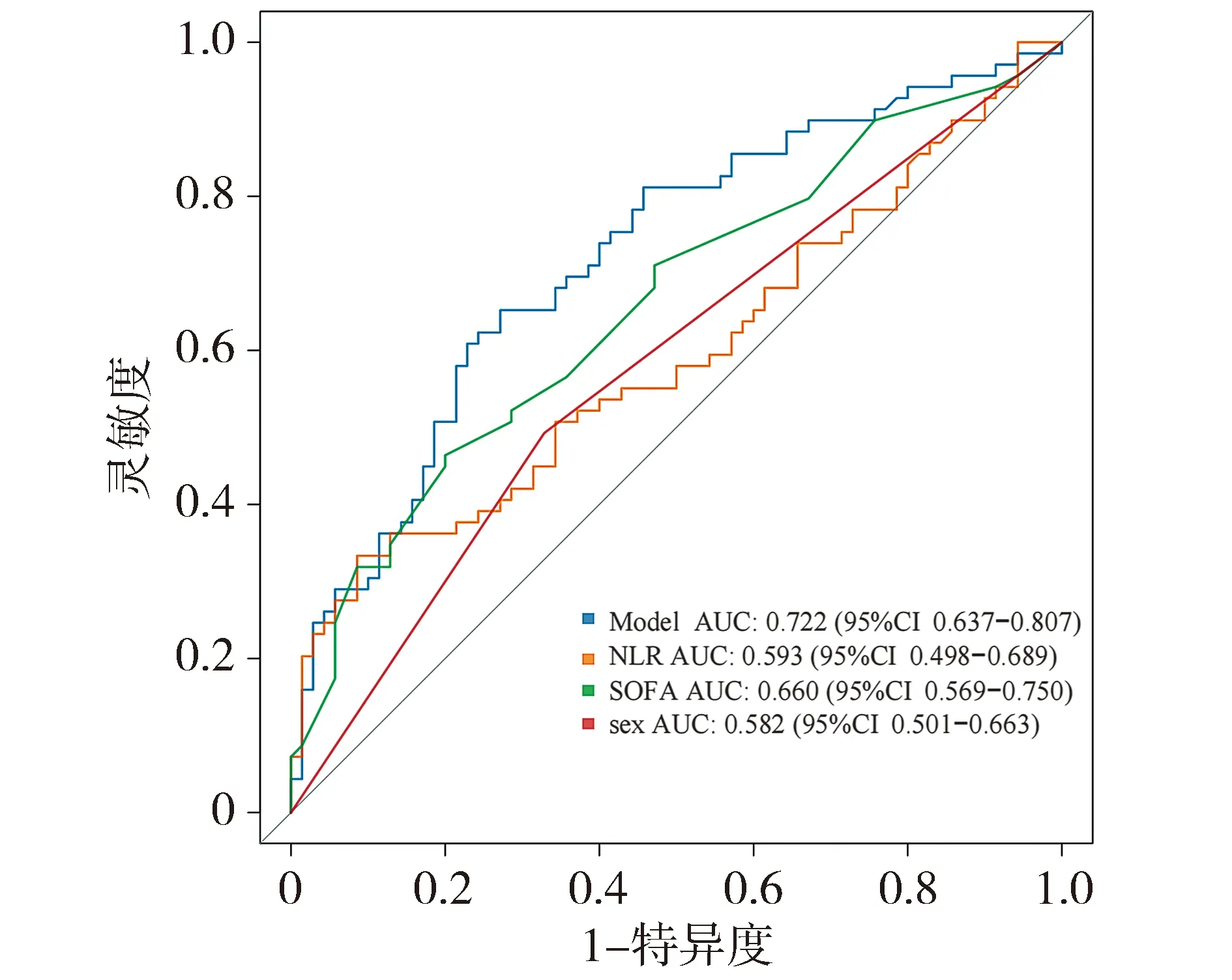
图8 列线图与性别、NLR、SOFA的ROC曲线
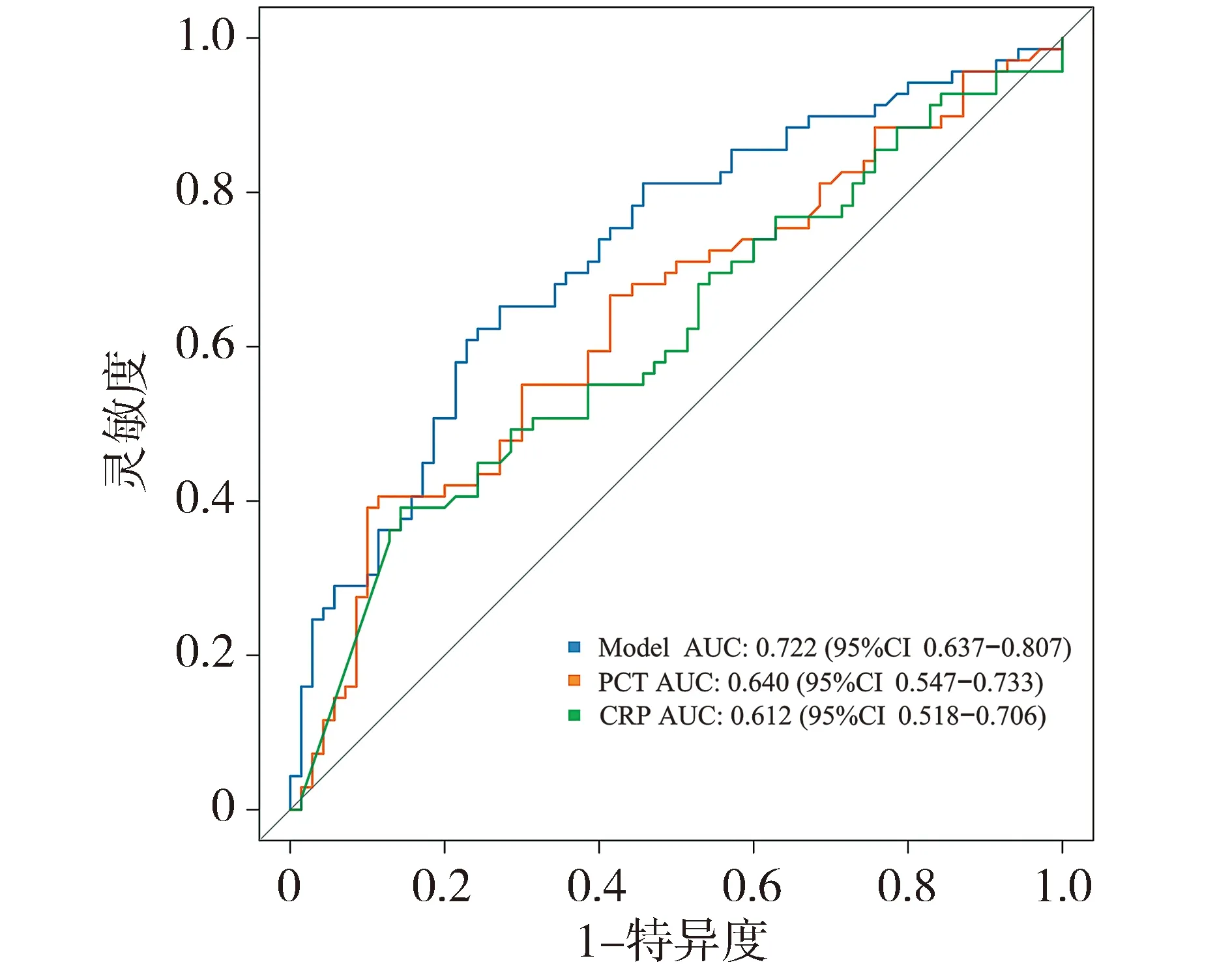
图9 列线图与PCT、CRP的ROC曲线
3 讨论
脓毒症是一种潜在的危及生命的器官功能障碍,在ICU的危重症患者中广泛存在[9]。由于临床症状有时表现不充分或延迟出现,经常错过最佳的治疗时间,然而早期识别可尽快对患者进行药物干预,从而提高生存率。本研究旨在构建一个临床简单便捷的列线图,利用简单而敏感的临床变量早期识别脓毒症的发生是非常重要的。
由于脓毒症的发病机制复杂,对于脓毒症生物标志物的研究领域不断地出现新的变量。PCT虽然可以指导临床抗菌药物的使用,但其不能作为脓毒症诊断的特异性生物标志物。CRP在各种急性炎症、组织损伤、心肌梗死、手术创伤、放射性损伤等疾病发作后数小时迅速升高[10],但是其并不能将感染性炎症与非感染性炎症区分开,不能作为独立生物标志物预测脓毒症的发生。OSM、AIM/CD5L、IL-26、IL-17等炎症调节因子在脓毒症血清中水平明显升高[11],但是检测方法较复杂,在临床应用中难以获得,在准确性、敏感性方面存在着不同程度的缺陷。截止到目前,尚没有发现很好的生物标志物具有足够的敏感性和特异性来帮助早期识别脓毒症。列线图是一种新的研究方法,通过将各项指标分数化来定量地判断患者发生疾病的概率,可以为临床医生提供一些诊断工具。本研究发现,SOFA、NLR、性别是脓毒症发生的独立危险因素。SOFA评分是脓毒症3.0定义的重要组成部分,在评估危重患者病情严重程度方面具有令人满意的可靠性[12]。该工具采用了反映器官系统功能(呼吸系统、心血管系统、肾脏系统、神经系统、肝脏和血液系统)的6个标准,有研究表明,SOFA评分(AUC=0.89)具有明显的高预测脓毒症的能力[13]。但仅仅凭借SOFA评分不能诊断脓毒症。原因在于,脓毒症最新定义为宿主对感染反应失调引起的危及生命的器官功能障碍,其中器官功能障碍定义为感染引起的SOFA≥2的急性变化,即脓毒症=感染+SOFA≥2。因此还需要进行血液培养以确定致病菌来确诊脓毒症[8]。而实际临床工作中,得到血液培养结果速度较缓慢,造成脓毒症诊断的延迟。本研究纳入预测模型的是单独的SOFA评分、NLR和性别。NLR是基于血常规指标计算的系统性炎症指标,具有简单方便、比较客观、检测成本低廉等优势[14]。最近关于NLR在脓毒症中的作用研究越来越多,与既往的研究结果一致[15,16],猜测其对脓毒症的早期识别具有重要意义。本研究使用R软件,根据AIC原则,筛选出的最优预测模型中提示男性较女性患脓毒症的风险更大,首次将性别纳入到脓毒症早期识别列线图模型中。既往有研究认为,男性比女性更容易出现和发展脓毒症[17,18],器官功能障碍的发生率明显更高。美国国家创伤数据库对373 370名患者进行的多变量分析发现,男性与创伤后发生脓毒症的风险增加相关[19]。这些差异可能是由生理因素造成的,男性通常有较高的心血管并发症发生率,这些并发症与脓毒症的不良结局独立相关[20],也可能与周围环境、社会经济地位及生理因素有关。有研究表明,雌激素可以抑制高度炎症状态,降低IL-6和TNF-α等关键促炎生物标志物的循环水平,以及肺部的肺气肿和炎症变化[21]。由于有大量研究证实,PCT和CRP常被认为是脓毒症发病的重要危险因素[22-24],因此笔者将此列线图与二者在脓毒症诊断效能方面进行对比,结果显示,仍是该模型的AUC最大,提示该模型具有一定的临床指导意义。
单一变量早期识别脓毒症具有一定的局限性。因此,整合多个简单而敏感的变量来生成联合预测因子以早期识别脓毒症的诊断已成为当前研究的热点。根据Logistic回归方程建立的列线图统计量化和可视化了每个变量的贡献,其可以消除单个变量之间可能的混杂因素,使诊断及预后预测判断更加客观和全面[25]。诺模图用于评估重症患者发生脓毒症的概率。每个变量对应于诺模图的相应变量轴上的对应点,并且通过该点绘制变量轴的垂直线。在顶部的点轴上获得相应的点,通过将所有变量的点相加获得总点。概率轴上与总点数相对应的点是患病的预测值[26]。
本研究有一定的局限性。首先,这是一项回顾性研究,可能存在选择偏倚,建模的总体样本量相对较小。其次,未纳入一些炎症指标,如:IL-6、CRP、PCT等,与已有的研究[27]存在一定的差异,可能是收集对象存在基础疾病差异,李晓明等[27]的研究是外科术后患者居多,而本研究是内科重症患者为主。在此基础上,未来的研究尚需要找到更多的变量并扩大样本量,以便为重症患者预测脓毒症发生建立一个更早、更准确的诺莫图。
综上所述,本研究利用临床常用指标,构建了早期识别ICU重症患者发生脓毒症的列线图,其性能优于单一指标如PCT和CRP等。该模型避免了临床医生反复计算SOFA评分以诊断脓毒症,可以帮助临床医生早期识别潜在的脓毒症患者,以采取及时有效的治疗措施,从而降低脓毒症的发病率及死亡率。
