石菖蒲单体ɑ-细辛醚对耐药性癫痫大鼠的作用机制研究
2023-06-16吴树宏韦小凤唐秋燕杨慧中杨旭红
冯 茜,董 波,吴树宏,韦小凤,唐秋燕,杨慧中,杨旭红
(1.成都中医药大学,四川 成都 610075;2.成都市第七中学,四川 成都 610021;3.成都中医药大学附属医院,四川 成都 610072)
癫痫(Epilepsy ,EP)是一种多种病因引起的慢性脑部疾病,主要特点是大脑神经元反复、过度地同步化放电并导致发作性、突然性、短暂性的脑功能紊乱,表现为临床各型EP发作,伴有脑电图痫性波及相关实验室指标异常改变[1]。其致残率高、病程长,因此成为当前世界范围的医疗难题及社会公共卫生问题。据世界卫生组织报告,全世界约有7 000万EP患者[2]。目前我国EP总患病率为7‰,且每年以40万人次的速度增加[3]。尽管目前的抗癫痫药物(Anti epileptic drugs,AEDs)如苯巴比妥(Pentobarbital,PB)、卡马西平(Carbamazepine ,CBZ)、左乙拉西坦(Levetiracetam, LEV)等具有较好的抗痫作用,但长期服用可产生中枢神经系统及肝肾功能损害、血小板降低等副作用[4]。此外,仍有约30%的患者对AEDs反映不佳,被归类为耐药性癫痫(Drug-resistant epilepsy, DRE)[5]。DRE的主要特征是EP患者对AEDs产生不同程度的耐药性[6]。因此,仍需更多研究进一步探索副作用小、疗效更加稳定的抗癫痫药物。
中医药治疗EP疗效显著、毒副作用小,在临床中广泛使用[7]。中医中虽无与DRE相对应的病名,但从病机分析可将其归于“痫病”范畴,《医学纲目·癫痫》曰:“癫痫者,痰邪逆上也”,《丹溪心法·痫》云:“无非痰涎壅塞,迷闷孔窍”。本病主要病机是元神失控,清窍蒙蔽,因此,DRE的治疗以醒脑开窍,豁痰定痫[8]为主。石菖蒲性温,主归心经和胃经,具有开窍豁痰、醒神益智的功效。现代药理研究发现,石菖蒲提取液、醇提物、挥发油、除去挥发油的水提取液可减少惊厥次数,缩短持续时间,降低死亡率,总挥发油为其镇静、催眠、抗惊厥的主要部位[8]。α-细辛醚作为石菖蒲的主要活性成分之一,是石菖蒲发挥醒脑开窍和镇静、抗惊厥作用的主要活性成分[9],具有穿透血脑屏障的能力,对谷氨酸能神经传递有负性调节作用[10]。能抑制 NF-κB 信号通路,减轻小胶质细胞介导的神经炎症,降低促炎介质TNF-α、IL-1β的产生[11-14],能明显下调模型大鼠海马与皮层中P-gp与Mdr1a1mRNA的表达,扭转P-gp介导的癫痫耐药性[15],而且在临床上得到了广泛应用[16]。这表明ɑ-细辛醚对于治疗DRE具有明显潜力。
然而,ɑ-细辛醚对于DRE的抗痫作用机制尚缺乏相关研究,本课题组在前期研究中发现石菖蒲能通过下调PTZ癫痫模型大鼠海马炎症因子的表达修复血脑屏障,从而减轻癫痫发作[17]。在预实验中发现ɑ-细辛醚能延长DRE大鼠发作潜伏期,降低发作级别,缩短发作持续时间。因此,为进一步明确ɑ-细辛醚对DRE的抗痫效果及可能存在的机制,实验采用SD大鼠腹腔注射PTZ后灌胃CBZ建立DRE模型,拟通过观察ɑ-细辛醚对DRE大鼠海马内炎性因子的表达情况,对血脑屏障(Blood Brain Barrier,BBB)调控作用及多药耐药基因的调控,揭示ɑ-细辛醚治疗DRE的部分作用机制,以期为ɑ-细辛醚在临床上治疗耐药性癫痫提供理论依据和进一步研究提供支持。
1 材料
1.1 动物及饲养
60只SD大鼠,SPF级,雄性,6~8周,体质量(200±20)g,购自成都恩斯维尔生物科技有限公司(批号:SCXK川2019-028),实验动物使用许可证(SYXK川2020-225),实验动物常规饲养,自由饮食,室温20~22℃,相对湿度40%~45%,明暗交替12h,符合中华人民共和国国家科学技术委员会颁布的《动物管理条例》。
1.2 药物及试剂
卡马西平片(上海复旦复华药业有限公司,批号:200911)、戊巴比妥钠(北京化学试剂厂,批号:20111123)、戊四氮(上海一基实业有限公司,批号:P312752);ɑ-细辛醚(上海源叶生物科技有限公司,批号:Z30M9N57243,纯度:99.9%);蛋白酶和磷酸化酶抑制剂混合物(碧云天生物技术有限公司,货号:P1050)、BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司,货号:P0010)、RIPA裂解液(碧云天生物技术有限公司,货号:P0013B)、PMSF(碧云天生物技术有限公司,货号:ST506)、转移生长因子-β1(Transforming growth factor-beta1,TGF-β1)抗体(英国abcam,货号:ab179695)、磷酸化细胞信号转导分子2(phospho-Smad2,P-smad2)抗体(英国abcam,货号:ab188334)、白细胞介素-1β(Interleukin-1beta,IL-1β)试剂盒(上海酶联,货号ml037361-J)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)试剂盒(上海酶联,货号ml037361-J)、多药转运蛋白-P糖蛋白(P-glycoprptein, P-gp)试剂盒(上海酶联,货号ml654884-J)、812环氧树脂包埋套装(北京中镜科仪技术有限公司,货号 GP18010)、醋酸双氧铀(北京中镜科仪技术有限公司,货号GS02624);柠檬酸铅染液(北京中镜科仪技术有限公司,货号 GZ02616,);四氧化锇(德国徕卡,货号 GP18456)。
1.3 仪器
DW-2000脑立体定位仪(成都泰盟科技有限公司)、RM6240C型多道生物信号采集处理系统(成都仪器厂)、JEM-1400FLASH透射电子显微镜(日本电子JEOL)、EMTP徕卡组织处理机(德国徕卡)、EM KMR3玻璃制刀机(德国徕卡)、EM UC7超薄切片机(德国徕卡)、G50组织研磨器(卡尤迪生物科技宜兴有限公司)、SCIENTZ-ⅡD超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、H1850R冷冻离心机(长沙湘仪离心机仪器有限公司)、K30干式恒温器(杭州奥盛仪器有限公司)、MULTISKAN GO全波长酶标仪(Thermo Scientific,美国)、MINI-P4/MT-BLOT MOD/PP BAS垂直电泳转印系统(BIO-RAD,美国)、Champ Chemi 610全自动化学发光凝胶成像系统(北京赛智创业科技有限公司)。
2 方法
2.1 造模方法
60只SD大鼠适应性饲养7d后,按照随机数表法选取50只大鼠隔日1次腹腔注射亚剂量PTZ 40mg·kg-1[18-19],按照Racine[20]标准对大鼠进行分级:Ⅰ级,湿狗样颤动,面部肌肉痉挛及抽动(包括眨眼、动须、节律性咀嚼等);Ⅱ级,Ⅰ级基础上加颈部肌肉痉挛(如节律性点头);Ⅲ级,Ⅱ级基础上加前肢痉挛; Ⅳ级,站立并伴有双侧前肢痉挛; Ⅴ级,Ⅳ级基础上加身体向后倒下、失去平衡、四肢抽动、持续站立、倾倒。其中,大鼠若出现持续Ⅴ级EP发作,给予2%戊巴比妥钠0.5mL缓解发作,连续3次或3次以上到V级发作即被认定为达到EP点燃标准,腹腔注射PTZ 15次,共造模30d。耐药性筛选参考国外报道[21]并结合本课题研究需要进行改良,对一种抗癫痫药无效的患者可能即是DRE,即对PB 耐药的患者对苯妥英钠(Phentoin,PHT)及 CBZ 也耐药,PB、PHT 或 CBZ 是作用机制完全不同的一线抗癫痫药,提示耐药性可延伸到其他不同作用机制的药物[22],故本实验采CBZ对PTZ点燃模型进行耐药性筛选。采用CBZ 0.125g·kg-1灌胃,灌胃后1h腹腔注射PTZ进行耐药性筛选,连续出现3次V级发作被认定为DRE大鼠模型,耐药性筛选试验持续7d。造模过程中有19只大鼠因惊厥过度死亡,有3只大鼠未达到点燃标准,弃用。
2.2 分组及干预
造模成功后,SD大鼠按照随机数表法分为3组:模型组(10只)、ɑ-细辛醚(50mg/kg)高剂量组(9只)、ɑ-细辛醚(25mg/kg)低剂量组(9只),另取10只SD大鼠为正常组。为统计数据一致,正常组、模型组各弃用一只大鼠。实验中模型动物对AEDs耐受,故受试药物不采用西药对照组。空白组和模型组给予等体积生理盐水灌胃,ɑ-细辛醚高剂量和ɑ-细辛醚低剂量组给予ɑ-细辛醚溶液灌胃,每日1次,连续给药3周。在给受试药期间每7d给予PTZ维持点燃。3周后处死大鼠。
2.3 检测指标及方法
2.3.1 各组大鼠脑电图测量[23]造模后7d,每组随机选取4只大鼠进行脑电图测量,以2%戊巴比妥45mg·kg-1麻醉后,固定于脑立体定位仪上,备皮,消毒头皮,按《大鼠脑立体定位图谱》定位。植入电极:记录电极(海马CA1区):后囟门(3.3~3.7mm),旁侧(2.5mm),硬膜下(3.0~3.5mm);参考电极:前囟门4.0mm,旁侧2.0mm;颈部肌肉作为接地电极,缝合固定。将记录电极、参考电极和接地线连接到小型三针插头上,牙科水及牙科水泥固定。腹腔注射PTZ后,使用鳄鱼夹将电极连接到RM6240C多通道生物信号采集和处理系统,记录皮层脑电图,走纸速度为30mm/s,滤波器为35Hz,增益为10μV/mm,时间常数为0.1s,使用每组脑电图的描记,每只大鼠脑电记录时间为30min。
2.3.2 样本采集 实验结束后,以2%戊巴比妥45mg·kg-1麻醉后解剖,通过下腔静脉快速灌注生理盐水,待灌洗液清澈后,开颅取出大脑,取大鼠双侧海马组织,置于-80℃冷冻管中保存备用。
2.3.3透视电镜观察各组大鼠海马组织BBB改变[24]大鼠海马用3%戊二醛预固定,1%四氧化锇再固定,丙酮逐级脱水,Ep812包埋超薄切片,乙酸铀和柠檬酸铅染色,JEM-1400FLASH透射电子显微镜观察。
2.3.4 Elisa检测各组大鼠海马组织中TNF-α、IL-1β、P-gp蛋白表达情况[25]取出保存在-80℃的海马组织样品,在4℃的冰箱中解冻。严格按照TNF-α、IL-1β、P-gp Elisa试剂盒的说明进行操作。
2.3.5 WB检测各组大鼠海马组织中TGF-β1、P-samd2蛋白表达情况[26]取100mg大鼠海马组织,加入含蛋白酶和磷酸化酶抑制剂的RIPA混合裂解液,冰上匀浆,4℃裂解1h后离心(12 000r/min,5min),收集上清液;BCA法测定总蛋白浓度;每孔以20μg蛋白上样,100V电泳,100V湿转;5%脱脂牛奶封闭2h,加入TGF-β1、P-samd2一抗(1∶1 000)在4℃下孵育过夜;加入辣根过氧化物酶标记的二抗(1∶10 000)室温孵育1h;ECL显影,用自动化学发光凝胶成像系统捕捉图像。
2.4 统计学方法
3 结果
3.1 各组大鼠脑电图检测及癫痫发作情况
正常组脑电图无尖峰波和棘波出现,与正常组相比,模型组大鼠脑电图出现典型癫痫波,以尖峰波和棘波为主,波幅明显上升,且EP发作潜伏期短(P<0.05);与模型组相比,ɑ-细辛醚配伍高剂量组与ɑ-细辛醚低剂量组脑电图波幅明显降低,潜伏期明显延长(P<0.05);ɑ-细辛醚配伍高剂量组与ɑ-细辛醚低剂量组之间差异无统计学意义。详见图1,图2,表1。
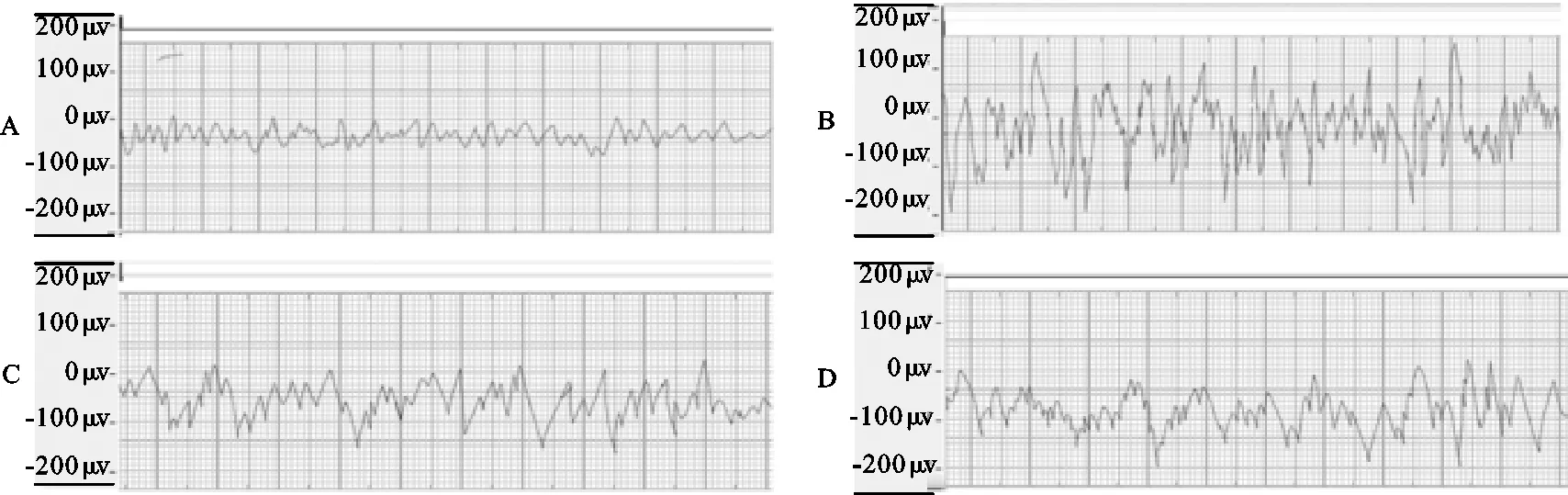
注:A:正常组;B:模型组;C:ɑ-细辛醚高剂量组;D:ɑ-细辛醚低剂量组。
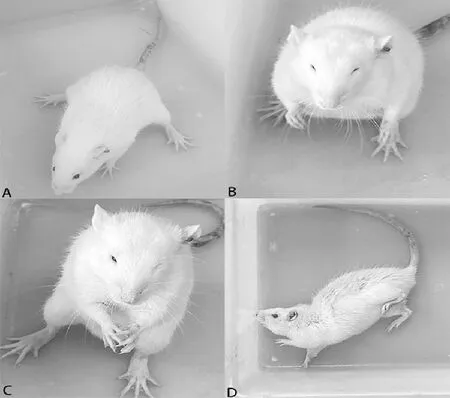
注:A:Ⅱ级:面阵挛伴节律性点头;B级:Ⅲ级:面阵挛伴前肢阵挛;C:Ⅳ级:前肢阵挛、后肢站立;D:Ⅴ级:全身紧张伴跌倒发作。
表1 各组大鼠癫痫发作总时间和发作等级比较
3.2 透视电镜观察各组大鼠海马组织BBB变化
正常组大鼠BBB结构完整清晰,可见神经细胞,神经元细胞核大而圆,核仁、细胞膜清楚,BBB微血管内皮细胞层、基底层结构正常;与正常组相比,模型组大鼠BBB微血管内皮细胞中线粒体肿胀,其嵴有断裂、溶解;血管腔内有红血球堵塞,血管周隙增宽,细胞核蛋白和胞浆蛋白成分松散、丢失,粗面内质网及核糖体肿胀,部分溶解;与模型组相比,ɑ-细辛醚高剂量组与ɑ-细辛醚低剂量组BBB微血管内皮细胞中各细胞器形态结构较正常,仅见少量线粒体有轻度肿胀,血管内皮细胞间见完整的紧密连接结构,血管周隙轻度增宽。详见图3。
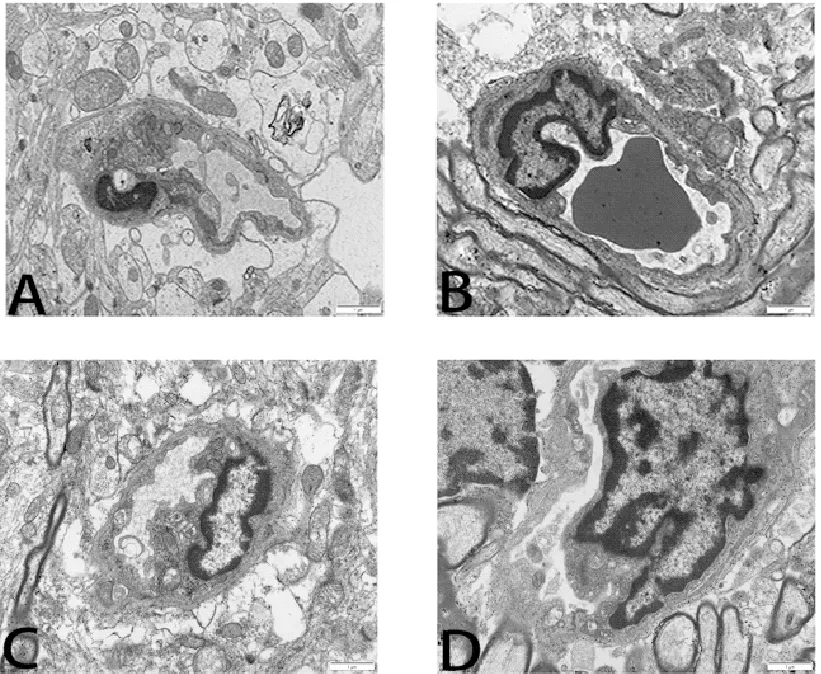
注:A:正常组;B:模型组;C:ɑ-细辛醚高剂量组;D:ɑ-细辛醚低剂量组。
3.3 Elisa检测各组大鼠海马组织TNF-α、IL-1β蛋白表达比较
与正常组相比,模型组TNF-α、IL-1β蛋白标示量显著升高(P<0.05);与模型组相比,ɑ-细辛醚高剂量组、ɑ-细辛醚低剂量组TNF-α、IL-1β表达显著降低(P<0.05),ɑ-细辛醚高剂量组较ɑ-细辛醚低剂量组TNF-α、IL-1β表达稍有下降(P>0.05),差异无统计学意义(*P<0.05,nsP>0.05)。详见图4。

注:模型组与正常组相比,P<0.05;ɑ-细辛醚高剂量组、ɑ-细辛醚低剂量组与模型组相比P<0.05;ɑ-细辛醚高剂量组与ɑ-细辛醚低剂量组相比,P>0.05。
细胞核(Nucleus,N);线粒体(Mitochondria,Mi);粗面内质网(Rough Endoplasmic Reticulum,RER)。
3.4 WB检测各组大鼠海马组织TGF-β1、P-smad2蛋白表达比较
与正常组相比,模型组TGF-β1、P-smad2蛋白标示量显著升高(P<0.05);与模型组相比,ɑ-细辛醚高剂量组、ɑ-细辛醚低剂量组TGF-β1、P-smad2表达显著降低(P<0.05),ɑ-细辛醚高剂量组较ɑ-细辛醚低剂量组TGF-β1、P-smad2表达稍有下降(P>0.05),差异无统计学意义。详见图5、表2。
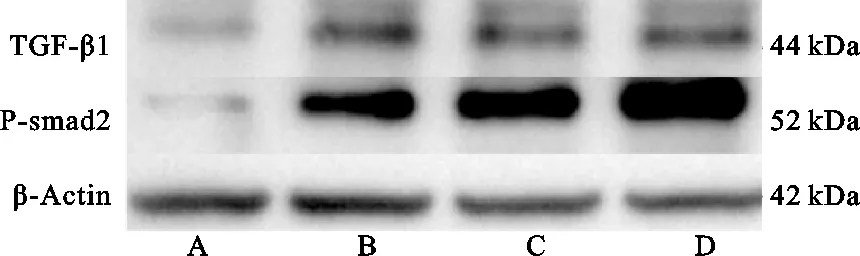
图5 WB检测各组大鼠海马组织TGF-β1、P-smad2蛋白表达水平
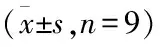
表2 WB检测各组大鼠海马组织TGF-β1、P-smad2蛋白表达比较
3.5 Elisa检测各组大鼠海马组织P-gp蛋白表达结果
与正常组相比,模型组P-gp蛋白表达量显著升高(P<0.05);与模型组相比,ɑ-细辛醚高剂量组、ɑ-细辛醚低剂量组P-gp表达显著降低(P<0.05),ɑ-细辛醚高剂量组较ɑ-细辛醚低剂量组P-gp表达稍有下降(P>0.05),差异无统计学意义。见表3。
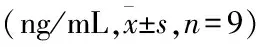
表3 Elisa检测各组大鼠海马组织P-gp蛋白表达比较
4 讨论
目前二线AEDs仅可使40%左右DRE患者癫痫发作减少50%,使10%~15%DRE患者停止发作,仍有大量DRE患者不能得到有效控制[27-28]。中医药治疗DRE历史悠久,疗效确切。DRE属中医“痫症”范畴,风、火、痰、瘀是疾病发作的直接病理因素。《三因极一病证方论·癫痫叙论》曰:“夫癫痫病,皆由惊动,使脏气不平,郁而生痰,闭塞诸经”;《幼科释谜·痫痉》曰:“然诸痫证,莫不有痰”;《寿世保元·痫证》曰:“风痰上涌而痫作矣”。本病主要病机是脏气不平,阴阳偏胜,神机受累,元神失控,清窍蒙蔽,气机失常,津液凝结成痰,痰气胶着,上蒙清窍,反复出现意识昏蒙、抽搐等症状。中药石菖蒲清香馨远,芳香禀冽,入心透脑,是归经入脑的重要药物。《本草纲目》曰:“治中恶卒死,客忤癫痫”,其辛香行气,苦温通络,化痰行瘀,集开窍豁痰、理气活血、散风祛湿于一体。ɑ-细辛醚具有广谱抗癫痫作用,能改善小鼠电惊厥、戊四氮引起的惊厥大发作和氯化锂-匹罗卡品引起的癫痫持续状态,对大鼠癫痫持续状态后γ-氨基丁酸转氨酶(GABA-T)活性增高,谷氨酸脱羧酶 67(GAD67)及 GABAA 受体的表达降低的过程有抑制作用,可明显降低海马CA1、CA3 区神经元 N-甲基-D-天冬氨酸受体l(NMDARl)的表达水平、细胞表面 NMDAR密度,从而抑制 NMDARl的活性及NMDA引起的兴奋性神经毒性介导的癫痫过程。ɑ-细辛醚同时也具有神经保护作用,用于预防和治疗包括TLE在内的小胶质细胞介导的神经炎症疾病[29]。
ɑ-细辛醚作为抗癫痫药物在我国临床上也得到了广泛应用[30],但目前关于其对DRE治疗的药理学研究及相关机制研究相对缺乏,原因与目前对DRE动物模型制备报道较少有关,制备与人类疾病相似的动物模型对研究DRE发病机制及开发治疗药物具有重要意义。PTZ是中枢神经系统兴奋剂,通过阻断γ-氨基丁酸(γ-aminobutyric acid,GABA)传递致痫[31],可使致痫动物产生和人类极相似的行为及神经病理学改变。PTZ无神经毒性,致痫过程不伴有神经元坏死, 若致痫动物出现神经元损伤,可明确判断是EP发作本身所致[32]。EP发作后脑内,活化的小胶质细胞释放的促炎因子可导致神经元死亡[33]。因此通过PTZ腹腔注射建立的化学点燃EP动物模型,可使致痫动物出现痫性发作诱导和上调炎症介质表达,进而提高脑部兴奋性和发生神经元变性。PTZ腹腔注射是一种建立EP化学点燃模型的较理想方式。有实验报道对EP点燃大鼠采用CBZ进行筛选后再用丙戊酸钠(Sodium Valproate, SV)筛选,建立DRE模型[34]。本研究根据DRE临床特征[35],患者对AEDs耐药性可延伸到其他不同作用机制的药物,即对一种抗癫痫药无效的患者即是DRE,本实验采用经典抗癫痫药物CBZ进行耐药性筛选,结果显示EP点燃大鼠发作情况能反应 DRE特点,可应用于DRE的深入研究。
DRE发病机制复杂, 研究证明DRE与炎症密切相关,炎症过程参与DRE发作与复发[36]。DRE发作时可诱发一系列炎症反应,包括激活小胶质细胞[37]和星形胶质细胞[38-41]产生促炎细胞因子。IL-1β 是先天免疫反应的关键介质,在中枢神经系统中,IL-1β 可由小胶质细胞、星形胶质细胞、内皮细胞和神经元产生。IL-1β 与白细胞介素1受体I型(Interleukin-1 receptor type 1, IL-1R1)结合可刺激免疫细胞活化,改变 GABA 能和谷氨酸能神经传递,增加神经元兴奋性并诱导神经毒性分子的产生[42]。TNF-α 是全身炎症后EP易感性的重要介质[43]。在大脑中,TNF-α 由活化的小胶质细胞和星形胶质细胞释放,通过上调α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionicacid receptor, AMPA),触发Ca2+依赖的谷氨酸释放,增强海马兴奋性突触活动并维持其兴奋性。DRE发作之后,IL-1β、TNF-α及黏附分子等均呈现不同程度高表达,炎症因子不断蓄积引起内皮细胞与星形胶质细胞相互作用从而破坏BBB完整性, 导致BBB维持中枢神经系统的稳态功能受损[44]。BBB破坏使脑组织暴露于免疫系统中,血清白蛋白外渗进入脑组织,白蛋白在BBB损坏时进入中枢神经系统环境后,与TGF-β1受体结合,诱导P-smad2蛋白激活,TGF-β1/P-smad2通过影响星形胶质细胞的功能,改变星形胶质细胞钾离子空间缓冲和重新摄取谷氨酸的能力,引起 N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)的GluN 2B亚基和上调突触后细胞上的NMDA受体,放大大脑兴奋性损伤反应,导致癫痫逐级发生至最高峰[45]。BBB作为血-脑间重要屏障系统,严格限制血液与脑组织物质交换,一方面允许脑组织所需营养物质进入屏障,另一方面限制有损脑组织物质进入屏障,以维持神经元微环境稳定。BBB内皮细胞中存在大量ABC外排转运蛋白可有效阻止外源性毒素入侵,排出内源性有毒物质,维持中枢神经系统稳态[46]。其中P-gp是最主要的多药耐药蛋白,当炎症等因素导致BBB损伤时,BBB及脑组织中P-gp异常升高,对AEDs跨膜转运,主动将AEDs逆浓度梯度外排出脑组织,降低脑组织中药物浓度,从而产生耐药,这也是DRE多药耐药的重要分子生物学机制[47]。由此可见,DRE与脑内炎症因子水平升高后BBB破坏,中枢神经稳态失衡,脑组织内多药耐药蛋白高表达致AEDs外排密切相关。
DRE发生后脑内炎症因子如TNF-α、IL-1β、TGF-β1、P-smad2等呈现不同程度高表达[45],脑组织内P-gp也呈现过度表达[48]。本实验研究发现,与正常组相比,模型组大鼠海马组织中TNF-α、IL-1β、TGF-β1、P-smad2表达水平显著升高,证实了炎性因子参与DRE发作过程。DRE急性发作时,BBB破坏,线粒体损伤,血管周隙增宽,白蛋白及白细胞进入大脑,提示DRE与BBB受损有关。本实验BBB透视电镜显示,模型组线粒体损伤,血管周隙增宽,BBB开放,这进一步说明BBB的破坏参与DRE发生。与正常组相比,模型组大鼠海马组织中P-gp表达水平显著升高,证实了DRE大鼠模型对AEDs的外排。本课题组认为,ɑ-细辛醚能促进BBB 通透性增加,减少 BBB 紧密连接结构,具有下调炎性表达,保护BBB,促进BBB生理性开放,增加通透性,阻断TGF-β信号传导途径,同时具有抑制脑内P-gp 表达的作用,通过对 P-gp 表达抑制使治疗药物进入脑组织。使进入BBB 的药物被排除概率减小,使良药透过BBB进入脑组织,实现脑部靶向治疗。在本实验研究中,与模型组相比,ɑ-细辛醚高剂量组、ɑ-细辛醚低剂量组大鼠发作潜伏期明显延长、发作级别降低,持续时间明显缩短。研究证实ɑ-细辛醚对DRE有确切治疗效果。
综上所述,ɑ-细辛醚能有效控制DRE,实现脑部靶向治疗。这意味着在临床上可以通过这种方式使因长期痫性发作或长期服药导致BBB异常患者得到更有效治疗,且在保证疗效同时减少全身用药量,降低药物毒副作用。ɑ-细辛醚可打开BBB,且不破坏BBB功能,仅选择性让药达病所,增加病灶局部血药浓度;同时调节多药耐药蛋白及炎性反应,产生治疗DRE的作用。值得注意的是,本次实验中,ɑ-细辛醚高剂量组与ɑ-细辛醚低剂量组在改善DRE大鼠癫痫发作情况、保护BBB受损及相关炎性因子及多药耐药蛋白调控上无明显差异, 其可能原因与药物在大鼠体内的代谢过程以及药物在脑组织内的含量水平有关,本次实验未进行进一步探讨,且由于作用机制相对复杂,ɑ-细辛醚抗DRE的靶点及通路尚不详细,还待进一步研究。
