AP4在人脑胶质瘤组织中的表达及其对胶质瘤细胞增殖、迁移和侵袭的影响
2023-06-15王忠海李铁柱周金鑫杨培培
王忠海,李铁柱,周金鑫,杨培培
神经胶质瘤是中枢神经系统常见、致死率较高的一种原发恶性肿瘤,约占该系统恶性肿瘤的47.1%[1]。因其生长速度快,无限增殖,肿瘤细胞与正常脑组织分界不清,具有高度侵袭性[2],胶质瘤的预后并不理想,中位生存时间仅为12~15个月[3]。研究[4]发现,许多基因的异常表达与胶质瘤发生、发展密切相关,为胶质瘤预后以及治疗提供了新的研究方向。激活增强子结合蛋白4(activating enhancer binding protein 4,AP4)是一种c-MYC调节的转录因子,参与细胞增殖与分化、细胞周期等[5],尤其在肿瘤细胞增殖和转移过程中发挥重要作用[6]。AP4诱导细胞增殖主要通过作用c-MYC促进DNA复制,显著上调CDK2等蛋白表达,下调p21和p16蛋白表达,影响细胞周期过程中的G2/M期和S期[6]。在胃癌中发现miR-144能够靶向结合在AP4的3′UTR区域,从而抑制AP4表达,抑制胃癌细胞增殖、迁移和侵袭[8]。但目前尚少见关于AP4在胶质瘤中的作用研究。本研究检测AP4在胶质瘤组织中的表达情况,同时在体外检测AP4对胶质瘤细胞增殖、迁移和侵袭能力的影响,以期为神经胶质瘤预后评估提供实验支持。现作报道。
1 资料与方法
1.1 一般资料 收集2018年8月至2019年8月我院手术切除胶质瘤标本29例和对应的癌旁组织29例。其中男18例,女11例;年龄53~88岁;体质量45~77 kg;胶质瘤Ⅰ、Ⅱ级15例,Ⅲ、Ⅳ级14例。病人均为初发脑胶质瘤。将标本置于0.9%氯化钠溶液中,去除血污后,置于液氮保存待用。本研究经本院伦理委员会审核批准,参与研究者均知情同意并签署知情同意书。
1.2 方法
1.2.1 免疫组织化学法检测AP4蛋白表达 将胶质瘤组织和癌旁组织各29例切片后,于60 ℃烘箱中烘烤20 min,随后二甲苯脱蜡两次,每次5 min,梯度乙醇进行脱水处理。3%双氧水甲醇处理切片,抑制内源性过氧化物酶活性。羊血清封闭组织切片2 h。抗AP4的抗体1:500处理切片,4 ℃过夜。第2天PBS洗3次,加入二抗,随后二氨基联苯胺显色。
1.2.2 RT-qPCR技术检测AP4 mRNA表达 将胶质瘤组织和癌旁组织各29例组织样本剪碎后取25 mg置于EP管中,按照100 μL氯仿/1 mL Trizol加入氯仿,振荡混匀15 min,离心后吸取上层水相,至另一RNase-free离心管中,加入异丙醇混匀,静置10 min后离心,RNA沉于管底部。采用反转录试剂盒进行反转录,获得cDNA。采用SYBR试剂盒进行RT-PCR,PCR反应体系进行40个循环。引物序列见表1。

表1 引物序列
1.2.3 Western blotting检测AP4蛋白表达 将胶质瘤组织和癌旁组织各29例组织样本按照细胞全蛋白提取试剂盒说明书进行蛋白提取,并以Bradford法测定蛋白浓度后-70 ℃保存备用。用15% SDS-PAGE分离40 μg总蛋白,电转至NC膜,用TBST配置5%的脱脂奶粉封闭1 h。加入1∶1 000稀释的抗体AP4,4 ℃孵育过夜,然后取出NC膜,TBST室温洗3次,每次5 min。加入二抗室温孵育1 h,洗膜3次,每次5 min。在暗室按照1∶1比例混合发光底物A、B液。取出膜放入Bio-Rad显像仪。
1.2.4 细胞培养、分组和细胞转染 人胶质瘤细胞系U251和U87细胞购自ATCC公司,培养于含10%FBS DMEM培养基,37 ℃、5%CO2培养箱中培养,待细胞进入对数生长期进行实验。将U251和U87细胞各分为2组:阴性对照组,即NC-siRNA组(转染无义序列NC)和AP4-siRNA组(转染si-AP4),由上海生工生物工程股分有限公司合成,参照Lipofectamine 2000说明书进行转染,放置37 ℃、5% CO2培养箱中培养6 h后,更换完全培养基,培养48 h后待用。
1.2.5 细胞增殖实验 将消化后的细胞制成2×104/mL细胞悬液,按每孔100 μL接种于96孔板,按照转染试剂的说明书进行细胞转染。分别在转染后24、48、72、96 h进行检测,检测前4 h在每个孔内加入5 μL CCK-8溶液,检测前弃培养液,在酶标仪测定波长450 nm处吸光度值。每组3个复孔。
1.2.6 细胞划痕实验 培养转染后U251(NC-siRNA组)、U251(AP4-siRNA组)、U87(NC-siRNA组)、U87(AP4-siRNA组)细胞48 h,待细胞达到95%汇合后,每层细胞用无菌10 μL吸管尖划伤刺激,用PBS冲洗3次,去除细胞碎片,继续无血清培养基孵育。分别在0、24、48 h用数码相机(Canon,日本)拍摄照片。细胞迁移率=各时间点细胞致伤区距离/原始细胞致伤区距离。
1.2.7 Transwell实验 以上4组细胞取1×106/mL接种于8 μm的含有基质凝胶的transwell小室中(Corning,美国),小室内加入无血清DMEM,下室加入含10%FBS DMEM,孵育48 h后,将细胞膜上表面擦掉,并用0.1%结晶紫(Sigma,美国)染色。通过穿过人工基底膜数细胞数量观察细胞侵袭能力。
1.3 统计学方法 采用t检验、方差分析、q检验和χ2检验。
2 结果
2.1 AP4在胶质瘤和癌旁组织中的表达 免疫组织化学结果显示,胶质瘤组织中AP4蛋白表达阳性率为72.41%(21/29),明显高于癌旁组织的31.03%(9/29)(χ2=9.94,P<0.01);且AP4蛋白在Ⅲ+Ⅳ级胶质瘤组织中阳性表达率为85.71%(12/14),明显高于Ⅰ+Ⅱ级的60.00%(9/15)(Fisher′s确切概率法,P<0.01)。
RT-qPCR和Western blotting结果显示,Ⅰ+Ⅱ级、Ⅲ+Ⅳ级胶质瘤组织中AP4 mRNA和蛋白表达水平均明显高于相应癌旁组织(P<0.01),且Ⅲ+Ⅳ级神经胶质瘤组织中AP4 mRNA和蛋白表达水平均高于Ⅰ+Ⅱ级(P<0.05)(见表2)。

表2 AP4在早期和晚期胶质瘤组织、癌旁组织标本中表达情况
2.2 AP4敲除后对胶质瘤细胞增殖的影响 Western blotting结果显示,转染AP4-siRNA后,U251和U87细胞中AP4表达均明显降低(P<0.01)(见表3)。CCK-8实验结果显示,U251和U87细胞转染AP4-siRNA后,在48、72、96 h时,细胞增殖均较NC-siRNA组明显下降(P<0.01)(见表4)。

表3 U251和U87细胞中AP4敲除效果检测
2.3 AP4敲除后U251和U87细胞迁移和侵袭能力变化 划痕实验和Twanswell实验结果显示,48 h时,U251、U87细胞AP4-siRNA组细胞迁移率和穿过人工基底膜细胞数均明显小于NC-siRNA组(P<0.01)(见表5)。
3 讨论
神经胶质瘤是常见的恶性肿瘤,发病率为十万分之六,根据组织病理学将胶质瘤分为Ⅰ~Ⅳ级,目前治疗方法主要是手术切除和术后放化疗相结合[8],但是术后复发及转移情况严重限制了其临床效果,病人总体中位生存期较短。利用更多的生物标志物来评估胶质瘤的预后,有助于提高神经胶质瘤患者生存率[9]。
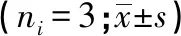
表4 U251和U87细胞不同时点细胞增殖情况比较
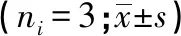
表5 各细胞不同时点迁移和侵袭能力比较
研究[10]发现,胶质瘤的发生、发展与复杂的基因相互作用和分子调控网络密切相关。LIU等[11]在多形性胶质母细胞瘤中发现MALT1异常表达,其通过参与EGFR诱导活化NF-κB的过程,调控GBM细胞的增殖、存活、迁移和侵袭过程,且能够通过抑制多个细胞周期相关蛋白的表达阻滞细胞周期G1期。贾国萍等[12]研究发现,Glypican-1在人脑胶质瘤组织中高表达,且分布于细胞膜表面的表达水平与肿瘤分级有关,表达水平越高,病人的总生存期越短。
转录因子AP4蛋白分子结构中有5个结构域,分别是1个碱性区域、1个螺旋-环-螺旋结构、2个亮氨酸模体、1个TIV区域,活化的AP4易形成同源二聚体,穿过核膜进入细胞核内,特异性结合下游靶基因启动子区域E-box模式元件CAGCTG序列,从而导致激活或抑制下游靶基因的转录和表达[13-14]。
AP4在胶质瘤组织中呈现高水平表达,相关文献[6-7]报道,AP4在多种肿瘤发生、发展中发挥重要作用,尤其是在肿瘤细胞增殖、迁移和侵袭的过程中。YANG等[15]在大肠癌组织中发现AP4蛋白异常表达,且AP4高表达病人的总生存时间明显低于AP4低表达者,AP4异常表达与大肠癌细胞的增殖、迁移和侵袭相关,可作为大肠癌患者预后不良的评价指标。刘兴华[16]研究发现,胃癌肿瘤组织中AP4阳性表达率明显高于癌旁正常组织,且其表达水平与T、N、M分期和pTNM分期呈正相关关系,与病人不良预后相关。另有研究[17]显示,非小细胞肺癌组织中AP4 mRNA和蛋白表达亦均较癌旁正常组织明显升高,miR-145通过靶向作用调控AP4能够显著抑制A549细胞的迁移与侵袭能力。
本研究结果显示,与癌旁正常组织相比,AP4蛋白在胶质瘤组织中的阳性率明显升高,且其表达水平与病人的病理分级相关,推测AP4蛋白高表达可能在神经胶质瘤的发生、发展进程中发挥重要作用。同时,本研究通过采用AP4-siRNA降低AP4在胶质瘤细胞中的表达,从而检测AP4对肿瘤细胞生物学功能的影响,体外实验结果显示,AP4蛋白表达与神经胶质瘤细胞的增殖、迁移和侵袭密切相关。
综上,AP4与胶质瘤的级别和临床预后相关,可能可成为潜在的临床不良预后的标记物,且其能够调控胶质瘤细胞的增殖、迁移和侵袭,在胶质瘤的恶性进程中具有关键作用。接下来本课题组将会针对AP4参与胶质瘤增殖、迁移和侵袭的作用机制进行研究,为胶质瘤的发生发展机制及药物治疗靶点选择提供实验数据。
