嵌入式3D 打印多孔硅胶义眼台及其表面修饰
2023-06-14王艺霖汪艳芳宫海环殷俊飞扬崔晓军张剑凯黄文华
赵 宏,王艺霖,汪艳芳,宫海环,殷俊飞扬,崔晓军,张剑凯,黄文华
1广东医科大学基础医学院人体解剖学教研室,东莞市干细胞与再生组织工程重点实验室,广东 东莞 523808;2南方医科大学基础医学院人体解剖学国家重点学科,广东省数字医学与生物力学重点实验室,广东省医学3D打印应用转化工程技术研究中心,广东 广州 510515;3南方医科大学附属广东省人民医院广东省医学科学院,广东 广州510080
眼部的重度创伤、严重感染、重度眼球萎缩、恶性肿瘤晚期等均可能造成眼球不可逆损伤,常需要将病变眼球摘除[1]。眼球摘除后不仅导致患者病变侧视力缺失,还会影响面容美观,给患者造成巨大的心理负担[2]。义眼台可代替眼窝体积、改善面部容貌,成为眼球缺失后整形修复的首选[3]。羟基磷灰石和高密度聚乙烯是义眼台的常用材料,但二者造价昂贵且力学强度明显高于眼周组织,植入术后常引发出血、感染、眼周组织坏死等并发症[3,4]。硅胶是一种生物相容性良好且价格低廉的弹性材料,更接近人体眼周组织的力学强度(0.72~1.28 Mpa),用于义眼台制备不仅降低了制造成本且可有效避免上述并发症[5-7]。但硅胶的疏水特性不利于植入后的细胞组织黏附,无孔硅胶义眼台植入术后常伴随极高的脱出风险[3]。明胶颗粒浸出、盐颗粒浸出等方法制备多孔硅胶义眼台的效率低下、孔径大小不一、孔隙率不均匀[6,8,9]。因此,如何提高硅胶义眼台的安全性及制备方法仍有待进一步研究。
近年来,3D打印技术已广泛应用于多领域多孔仿生支架的制备[10,11],但是传统的3D打印技术难以克服流体墨水受重力因素干扰的技术瓶颈,致使复杂三维结构的成型受限[12]。而嵌入式3D打印技术(EMB-3DP)能够使流体打印墨水克服重力因素干扰,实现复杂三维结构的高精度个性化定制,为更多水凝胶、硅橡胶等低粘度墨水的打印成型提供了可能[13,14]。因此,本研究基于EMB-3DP技术成功制备了孔径均一、孔隙率可控的多孔硅胶义眼台。为进一步改善细胞、组织对硅胶义眼台的黏附,本研究还对义眼台进行了表面修饰以促进细胞及组织生长,为多孔弹性义眼台的制备提供了新的方案。
1 材料和方法
1.1 主要材料及设备
本实验主要材料包括:SE 1700硅胶(深圳市研放科技有限公司)、Sylgard 184硅胶(深圳市研放科技有限公司)、气相二氧化硅(北京天童华艺景观科技有限公司)、硅油稀释剂(北京天童华艺景观科技有限公司)、盐酸多巴胺(上海阿拉丁生化科技股份有限公司)、三羟甲基氨基甲烷(Tris-HCL)(上海麦克林生化科技有限公司)、0.01 mmol 盐酸溶液(广州一骏生物制品有限公司);鼠尾I型胶原蛋白(COL)溶液(广州新代生物科技有限公司)、Live/Dead染色试剂盒(北京瑞茂宏达科技有限公司)、Alamar Blue染色试剂盒(亚太恒信生物科技(北京)有限公司)、细胞培养用液等。本实验主要设备包括:流变学分析仪(赛默飞世尔科技有限公司)、生物3D打印机(Envision TEC)、水接触角检测仪(科诺工业有限公司)、扫描电子显微镜(日立公司)、能谱分析仪(AMETEK公司)、万能测试仪(英斯特朗)、倒置显微镜(奥林巴斯株式会社)、真空泵(上海德英真空照明设备有限公司)、电热鼓风干燥箱(上海一恒科学仪器有限公司)等。
1.2 打印墨水与支撑介质的制备
室温下,将SE 1700硅胶和Sylgard 184硅胶分别与各自固化剂按质量比10∶1混合,充分搅拌,得到两种硅胶的预聚物。将上述两种硅胶预聚物按质量比7∶3均匀混合(SE 1700∶Sylgard 184),得到本研究中的打印墨水(PDMS)。分别称量气相二氧化硅和硅油稀释剂,制备成3 wt%、4 wt%、5 wt%的均匀混合物,得到本研究中的支撑介质。最后通过真空负压法去除上述打印墨水和支撑介质中的气泡。
1.3 支撑介质的性能检测
1.3.1 透明度检测 称取等量的3 wt%、4 wt%、5 wt%的支撑介质,分别装入透明培养皿中,依次放置在印有字母的纸上,俯视培养皿,透过支撑介质观察字母的清晰程度,比较3种支撑介质的透明度差异。
1.3.2 流动性测试 分别取10 mL 的3 wt%、4 wt%、5 wt%的支撑介质装入样品瓶中,将所有样品瓶倾斜相同角度,观察液面的倾斜角度以判断3种支撑介质的流动性强弱。
1.3.3 流变学性能检测 使用转子直径为20 mm的平行板流变学分析仪检测支撑介质的流变学性能。检测时平行板和转子间距离恒定为1 mm。设定振幅模式检测,频率恒定1 Hz,应变范围:1%~100%,检测温度为25 ℃,测定支撑介质的储存模量(Storage Modulus,G')和损耗模量(Loss Modulus,G''),确定三种支撑介质的线性粘弾区。旋转测试获得支撑介质的粘度曲线,设定应变在支撑介质的线性粘弾区范围内,剪切速率设定为0.01 s-1~1000 s-1,检测温度为25 ℃。旋转模式完成3ITT阶梯测试:设定第1阶段与第3阶段的剪切速率为0.1 s-1,第2阶段的剪切速率为100 S-1,检测温度为25 ℃。设定应变在支撑介质线性粘弾区范围内,分析2种支撑介质的温度依赖性,温度范围为20 ℃~100 ℃,升温速度为1 ℃/min。
1.3.4 PDMS 在支撑介质内的时间稳定性测试Autodesk Fusion 360软件设计尺寸为(1×1×1)cm的正方体,以“stl.”格式导入计算机。Perfactory软件对模型进行分层,切片厚度为600 μm,将模型以“bpl.”格式另存并通过Visual machines软件打开模型。设定生物3D打印机参数:恒定打印丝间距为1.3 cm,打印压力为1.0 bar,打印速度为1.0 mm/s。本研究中所有打印喷嘴规格均为长3.81 cm、内径18 G,打印温度均为25 ℃。在3种支撑介质内完成正方体结构的打印后,保持样品在支撑介质中分别静置0、0.5、6、12、24 h后,放入80 ℃的电热鼓风干燥箱中热固化2 h。移除支撑介质,分别测算样品体积。
1.4 最佳打印参数的测定
将PDMS装入打印机的墨水仓中,设定打印参数:打印丝间距为2.0 mm,打印压力为1.0、1.5、2.0 bar,分别以1、2、3…10 mm/s的打印速度依次在支撑介质中打印单层片状结构。打印完成后按1.3.4的方法固化PDMS后去除支撑介质。光学显微镜下观测所有打印样品。打印丝均匀且直径最接近喷嘴内径时对应的打印参数即为PDMS在3种支撑介质中成型的最适打印参数。
1.5 多孔硅胶义眼台的制备
按1.3.4中的方法完成直径为2 cm的义眼台结构建模与切片。设定生物3D打印机参数:打印丝间距为1.5 cm,使用1.4中获得的最佳参数分别在三种支撑介质中打印内部结构为横纵交错的义眼台。打印完成后按1.3.4的方法固化义眼台结构并去除支撑介质。分析三种支撑介质对义眼台成型精度的影响以获得最佳配比的支撑介质。
1.6 PDMS的表面修饰
1.6.1 聚多巴胺(PDA)修饰PDMS 去离子水制备PH为8.5、浓度为10 mM/L的Tris-HCL溶液。将盐酸多巴胺粉末加入Tris-HCL溶液中得到浓度为2 mg/mL的PDA溶液。将制备所得的PDMS样品浸入PDA溶液,室温下避光磁力搅拌12~16 h后取出支架。去离子水清洗2次以去除未聚合的多巴胺,最后将样品放入37 ℃电热鼓风干燥箱中烘干,得到PDA修饰的PDMS样品,即PDMS-PDA。
1.6.2 鼠尾I型胶原修饰PDMS 用0.01 mmol/L的盐酸溶液将COL 溶液稀释至20 μg/mL,将制备所得的PDMS样品浸入COL溶液中,放入37 ℃电热鼓风干燥箱中12 h后取出样品,得到胶原修饰后的PDMS样品,即PDMS-COL。
1.6.3 PDA和COL共同修饰PDMS 按照1.6.2的方法在PDMS-PDA样品上进行COL的表面修饰,即得到PDMS-PDA-COL。按照1.6.1的方法在PDMS-COL样品上进行PDA的表面修饰,即得到PDMS-COL-PDA。
1.7 PDMS支架修饰前后的表征检测
表征检测的样品制备:制备厚度为2 mm的无孔PDMS薄片,按照1.6中的方法对薄片分别进行表面修饰。通过扫描电子显微镜(SEM)和能谱分析(EDS)获得各组样品的微观形貌与主要组成元素。水接触角采用静态水接触角检测法,样品表面均光滑水平,置于水平检测台上。通过阿莎算法对单次滴定液体后的水接触角进行计算。
1.8 多孔硅胶修饰前后的力学性能检测
压缩试件的制备:按1.3.4 中的方法完成直径为1.0 cm、高为1.0 cm的压缩试件建模与切片。设定生物3D打印机参数:打印丝间距为1.5 cm,使用1.4中获得的最佳参数在最佳配比的支撑介质中打印内部结构为横纵交错的压缩试件。并按照1.6中的方法对压缩试件进行表面修饰。
力学性能检测:设置应变至50%时停止压缩,压缩速度为20 mm/min,使用万能试验机对四组试件进行检测,得到应力-应变曲线并分别计算其杨氏模量和50%应变时的压力。
1.9 修饰前后PDMS支架的体外生物相容性检测
按照1.4的最适打印参数和方法制备PDMS支架,并按照1.6中的方法分别进行表面修饰。将修饰前后的支架放在紫外台中照射消毒,备用。
1.9.1 细胞培养与接种 采用猪主动脉内皮细胞(PAOEC)来检测支架的体外生物相容性。细胞用DMEM+10%胎牛血清+1%青霉素/链霉素的完全培养基进行培养。每2~3 d更换培养基。细胞密度约为80%~90%时进行细胞传代。取培养瓶中密度为90%的PAOEC经胰酶消化、离心后,以50%的密度将PAOEC接种到修饰前后的各组支架表面,培养4 h。吸弃支架表面培养基,转移支架至无菌24孔板中,加入完全培养基继续培养。
1.9.2 细胞毒性检测 采用Live/Dead染色法检测修饰前后多孔硅胶的细胞毒性。按试剂盒说明书A液:B液:DPBS=1.5∶2∶4000,避光配制染色液。分别于接种细胞后的第1、3、5天染色观察。染色时去除培养基并用DPBS清洗支架,滴加染色液覆盖支架,37 ℃避光孵育15~20 min后在荧光显微镜下观察,绿色荧光为活细胞,红色荧光为死细胞。
1.9.3 细胞增殖检测 采用Alamar Blue 染色法评估PDMS支架表面PAOEC细胞的增殖能力。避光环境下,按照Alamar Blue:完全培养基=1∶10配制染色液。分别于接种细胞后的第1、3、5天进行染色。染色时去除旧培养基,滴加染色液覆盖支架并转至培养箱孵育4 h。孵育结束后,分别吸取100µL染色液至96孔板,以560/590 nm波长用荧光酶标仪进行检测。
1.10 修饰前后PDMS支架的体内生物相容性检测
选用12只6周的雄性SD大鼠,购自南方医科大学实验动物中心,于25±2 ℃的室温下饲养,水和饲料供给充足。本课题所有实验过程均符合单位和国家有关实验动物管理和使用的规定。术前用速眠新按0.8 mL/kg腹腔注射,深度麻醉大鼠,无菌条件下,将PDMS支架和PDMS-COL-PDA支架分别植入大鼠脊柱两侧皮下。于术后2、4、6周各处死4只大鼠,用生理盐水和4%多聚甲醛的灌流固定,并收集大鼠心、肝、脾、肾及支架植入处的全层皮肤浸泡于10%的福尔马林溶液中1周后进行组织包埋与H&E染色。
1.11 统计学分析
本文中各项实验至少重复3次,实验结果以平均值±标准差表示,采用SPSS23.0软件分析处理,采用单因素方差分析(ANOVA)评估统计学差异,方差齐者采用Tukey多重比较,方差不齐者采用Dunnett's T3多重比较;P<0.05差异具有统计学意义。
2 结果
2.1 支撑介质的性能
2.1.1 透明度与流动性分析 装有3 wt%支撑介质培养皿下方的文字最清晰,透明度最佳,样品瓶倾斜时,其液面倾斜角度最大,流动性也最强;5 wt%培养皿下方的文字最模糊,透明度最差,样品瓶倾斜时,其液面倾斜角度最小,流动性也最弱;同时,样品瓶倾斜时,4 wt%和5 wt%的液面倾斜角度差异不明显(图1)。可见,3种不同配比的支撑介质,透明度与流动性均随气相二氧化硅添加剂量的增加而减弱,4 wt%和5 wt%的流动性差异不明显。

图1 支撑介质的透明度与流动性Fig. 1 Assessment of transparency and fluidity of the supporting medium.A:3 wt%.B:4 wt%.C:5 wt%.
2.1.2 流变学性能分析 振幅扫描结果显示3种支撑介质的线性粘弹区均在0.1%~1%的剪切应变范围内(图2A);在任一剪切速率下,3 wt%组的粘度始终低于其它两组,4 wt%组与5 wt%组之间的粘度差异不明显(图2B)。在3ITT阶梯测试中,当剪切速率从0.1 S-1骤增至100 S-1,3种支撑介质的粘度会迅速降低,剪切速率一旦恢复,3组支撑介质的粘度也迅速增加且与初始粘度基本一致,均展现了良好的触变性(图2C)。温度依赖性结果显示随温度增加,3种支撑介质的粘度随均有降低但并不显著(图2D),表明受温度的影响较小。

图2 支撑介质的流变学性能Fig. 2 Rheological property of the supporting medium. A: Measured G' and G'' from amplitude sweep. B: Measured viscosity.from rotational testing. C: 3ITT test from rotational testing. D: Temperature viscosity curve from rotational testing.
2.2 最适打印参数的探索
PDMS在3种支撑介质中打印,其结构不会随留置时间的延长发生明显改变(P>0.05,图3)。在3种支撑介质中以不同参数打印PDMS时,可以发现打印压力越大、打印速度越慢,在1.5 bar和2.0 bar的压力下即以10 mm/s的速度打印PDMS,打印丝的直径也远大于针头内径840 μm;当压力为1.0 bar时,在3 wt%、4 wt%、5 wt%支撑介质中打印,打印丝可分别在9、6、5 mm/s的速度下获得接近840 μm的直径;此外,在3种支撑介质中以相同的压力、速度挤出的PDMS,打印丝直径随支撑介质浓度的增加而减小(图4)。

图3 打印墨水在支撑介质中的稳定性测试Fig. 3 Stability test of the printing ink in the supporting medium.P>0.05.

图4 最适打印参数的探索Fig. 4 Determination of optimal printing parameters.A: 3wt%. B: 4wt%. C: 5 wt%. D: Filament width with different supporting medium under the same parameter setting.
2.3 多孔硅胶义眼台的制备效果
在3 wt%支撑介质中成型的义眼台结构底部出现了明显形变,而另外两组的义眼台结构精准度均较好(图5)。结合支撑介质的透明度,为便于观察打印过程,本研究设定4 wt%组为最适支撑介质。

图5 不同支撑介质下制备的多孔义眼台Fig. 5 Porous orbital implants prepared with different supporting medium.A:3 wt%.B:4wt%.C:5 wt%.
2.4 PDMS支架修饰前后的表征
2.4.1 PDMS支架修饰前后的表观形貌 PDMS支架呈半透明状,COL修饰后肉眼观无明显改变,但有PDA修饰的支架颜色会明显变黑(图6A)。表面修饰前后的各组多孔硅胶支架均可在光学显微镜下展现出光滑均匀的打印丝及孔径,且打印丝直径在840 μm左右,孔径在400~600 μm之间(图6B)。SEM扫描发现PDMS支架表面相对光滑,而修饰后的PDMS支架表面均更为粗糙;PDMS-COL支架表面呈现出条形胶原蛋白形态,PDMS-PDA支架表面则有不规则形态的聚多巴胺纳米颗粒;这两种修饰后的表面形态在PDMS-COL-PDA和PDMS-PDA-COL支架上均可见(图6C)。EDS结果显示表面修饰后的支架Si元素比例明显下降,C、O比例升高(表1)。综合结果表明,PDA与COL均能成功粘附于PDMS样品表面。

表1 EDS检测结果Tab.1 Results of energy dispersion spectrum analysis

图6 支架的表观形貌Fig. 6 Appearance and ultrastructural morphology of the scaffolds. A: Image of appearance. B: Optical microscope image.C:Image of SEM.
2.4.2 PDMS支架修饰前后的亲水性 PDMS组的水接触角为(118.30±2.25)°,经表面修饰后,水接触角均明显减小(P<0.01);PDMS-COL 组的水接触角为(97.94±0.89)°,PDMS-PDA 组的水接触角为(79.39±0.99)°,PDMS-PDA-COL 组的水接触角为(63.00±3.07)°,PDMS-COL-PDA组的水接触角为(41.60±0.86)°(图7)。
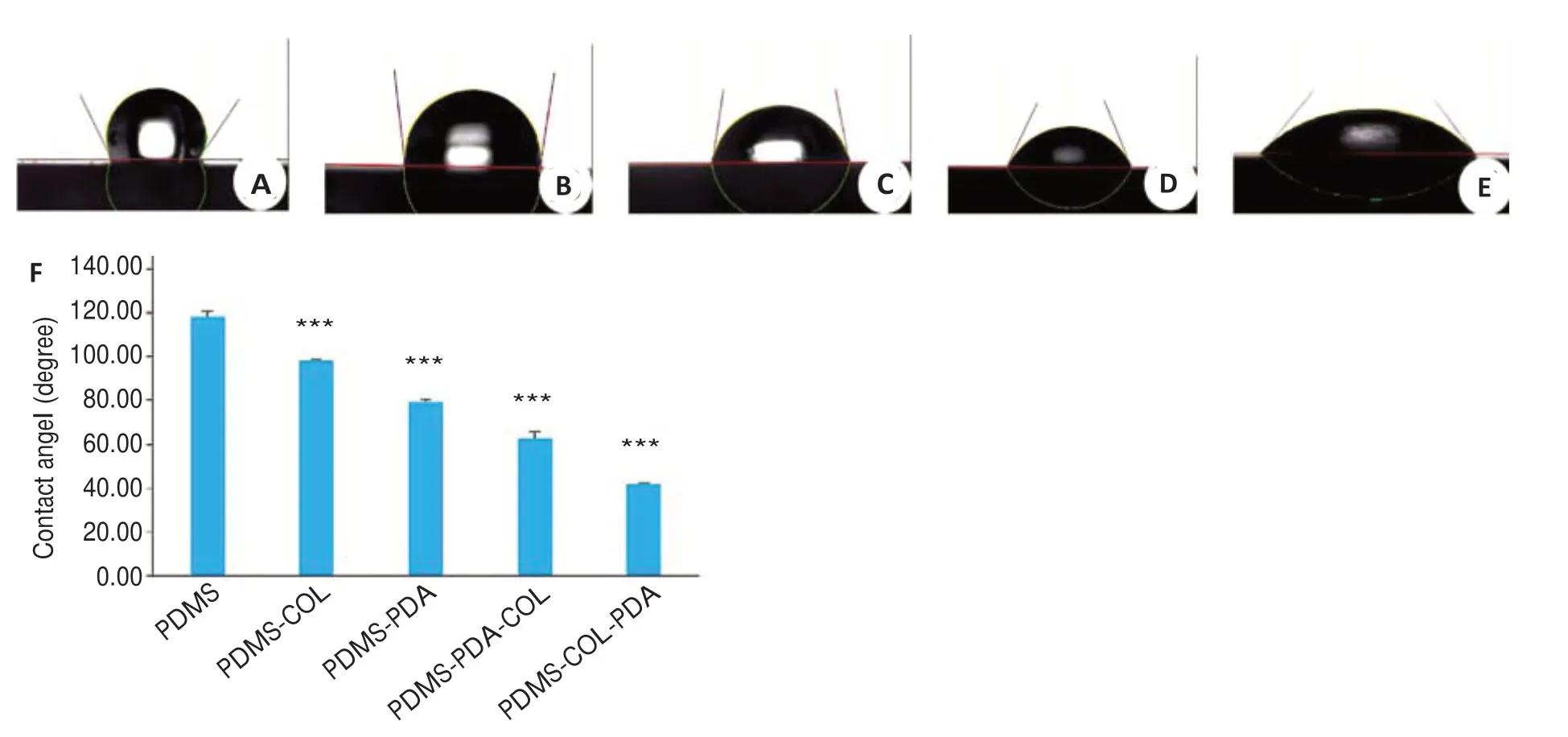
图7 支架的水接触角测量Fig. 7 Water contact angle measurement of the scaffold.A:Image of water droplets on PDMS. B: Image of water droplets on PDMS-COL. C: Image of water droplets on PDMS-PDA. D:Image of water droplets on PDMS-PDA-COL.E:Image of water droplets on PDMS-COL-PDA. F: Statistical analysis of water contact angle.***P<0.001 vs PDMS.
2.5 PDMS修饰前后的力学性能
表面修饰前后的压缩试件应力-应变曲线基本一致,无明显差异(图8A)。PDMS 组的杨氏模量为(1242.64±200.86)KPa,PDMS-COL 组的杨氏模量为(1154.31±271.27)KPa,PDMS-PDA 组的杨氏模量为(1237.88±87.27)KPa,PDMS-COL-PDA组的杨氏模量为(1029.96±89.66)KPa;各组杨氏模量均在1~1.5 MPa之间,且各组杨氏模量之间的差异均无统计学意义(P>0.05,图8B);各组试件在50%应变处承受的压力大小也无统计学差异(P>0.05,图8C)。

图8 支架的力学性能检测Fig. 8 Mechanical property testing of the scaffolds.A:Stress-strain curves of the scaffolds.B:Compressive modulus of the scaffolds.C:Compressive stress of the scaffolds.P>0.05.
2.6 DMS支架修饰前后的体外生物相容性
Live/Dead染色结果显示,PDMS组支架上细胞的黏附数量最少,PDMS-COL-PDA组细胞黏附的数量最多;PDMS-PDA 组的细胞黏附效果明显优于PDMSCOL组;随着培养时间的延长,各组支架上的细胞数量也逐渐增加,且均未见明显死细胞(图9)。说明各组支架均没有显著的细胞毒性。Alarm Blue染色结果显示,各组支架上的细胞均随着培养时间的延长稳定增长,其中,经过表面修饰的3 组细胞数量均高于PDMS 组,PDMS-COL-PDA组的细胞数量最高(图10)。

图10 支架的细胞增殖检测Fig. 10 Cell proliferation in the presence of the scaffolds.*P<0.05 vs PDMS.
2.7 PDMS支架修饰前后的体内生物相容性
支架植入术后2、4、6周的大鼠支架周围皮肤组织及心、肝、脾、肾的H&E染色结果可见:皮肤组织与各脏器均未发生明显炎症反应或器官损伤(图11)。进一步说明支架在体内无明显的毒副作用,具有较好的生物相容性。此外,与PDMS组相比,PDMS-COL-PDA组的皮肤组织在术后4周和6周时的纤维包膜更薄(图12)。

图11 支架植入后重要脏器及皮肤组织的H&E染色结果Fig. 11 HE staining of vital organs and skin tissues after scaffold implantation in rats(×100).A:Heart.B:Liver.C:Spleen.D:Kidney.E:Skin tissue at PDMS scaffold implantation site.F:Skin tissue at PDMS-COL-PDAscaffold implantation site.
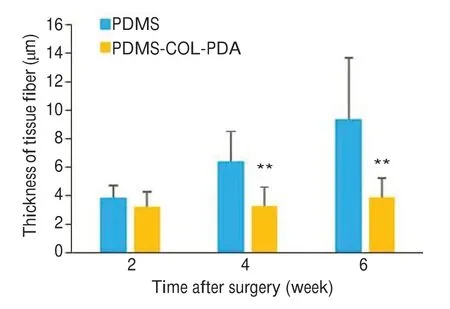
图12 支架植入处皮肤组织的纤维包膜厚度Fig. 12 Thickness of skin tissue fiber at the scaffold implantation site.**P<0.01 vs PDMS.
3 讨论
义眼台作为眼球摘除后填充眼窝体积的重要结构,应具备适宜的机械强度且不易降解、能够促进血管化及良好的生物相容性[15]。硅胶作为一种价格低廉且生物相容性极佳的非降解类弹性材料,无疑成为最适用于制备义眼台的材料之一。EMB-3DP技术是将墨水挤出在支撑介质中,并由支撑介质包裹墨水以维持打印结构的新型打印方式,已广泛用于多种流体低粘度墨水制备复杂三维结构[16-18]。大量研究表明,COL和PDA作为表面涂层修饰疏水性材料,可以有效改善细胞黏附力[19,20]。基于此,本研究以硅胶作为打印墨水,应用EMB-3DP技术制备孔径均一、孔隙率均匀的硅胶义眼台,利用PDA和COL对硅胶义眼台进行表面修饰以提高其细胞黏附能力。
基于前人研究[17],本研究配制了3种浓度的支撑介质,通过表征及性能检测,获得了本研究中最适宜墨水成型的支撑介质浓度。作为EMB-3DP的支撑介质,必备的特性是剪切变稀性和良好的触变性[21]。剪切变稀性保证了打印喷嘴移动的瞬间,支撑介质为打印墨水预留空间,触变性则保证了打印墨水挤出后支撑介质对其迅速包裹以维持预期形态[22]。但支撑介质流动性过强,一定程度上会限制打印结构的体积与质量,不利于复杂结构的维持[23]。此外,具有良好透明度的支撑介质也更利于实时观察打印过程[13]。本实验选用的是高温热固化成型的硅胶墨水,其打印及固化均需在支撑介质中完成。因此,支撑介质不宜受温度影响过大,以确保在打印结构不会在固化时因支撑介质特性的改变而影响打印结构的精度。本研究中成型稳定性测试证明:PDMS墨水可以在支撑介质中长时间保持稳定。但在此实验中,我们并未使用最佳的打印参数,因此部分样品的体积会略大于预期体积。
为提高打印精度,打印墨水需在支撑介质内形成表面光滑、粗细均匀的打印丝且直径与打印喷嘴内径一致[5],本研究将墨水以不同打印压力、速度在3种支撑介质中成型,通过观察打印丝形貌并测量其直径,分别获得了3种支撑介质下的最佳打印参数。并基于此完成了多孔义眼台的制备。为了使义眼台的孔径更适宜细胞生长,我们选择将义眼台孔径控制在600 μm 左右。结果显示,在3 wt%中打印的义眼台底部会有轻微变形。这可能是随着打印层数的堆积,义眼台的重量增加,在重力作用下发生了结构下沉。因此,粘度低、流动性强的3 wt%支撑介质难以支撑体积大、质量重的结构成型。4 wt%与5 wt%的支撑介质虽均能实现高精度义眼台的打印,但4 wt%的透明度更佳。因此,综合上述实验结果,本研究中最适的支撑介质浓度为4 wt%。
为改善硅胶的疏水性及生物惰性,促进义眼台植入后与眼周组织更好融合,使用COL、PDA对硅胶进行表面修饰。两种物质修饰后的支架结构不会发生改变。但PDA修饰后,支架明显发生了颜色改变,这可能由于PDA的氧化聚合过程与生物黑色素形成的机制相似,SEM电镜可以明显看到修饰后的支架表面更加粗糙,这更有利于细胞及组织在支架表面的黏附[24,25]。SEM观察下COL呈现出条状结构[26],PDA呈现类圆形团状结构[24],这与本实验结果是一致的。此外,本实验选择的打印墨水是由许多-Si-CH3基团构成的[27],而C、O元素则大量存在于COL和PDA的C=O和O-H基团中[20]。当样品被修饰后,样品表面被COL和PDA包裹,-Si-CH3基团被更多的C=O和O-H基团覆盖。Si元素被COL、PDA中大量的C、O元素覆盖。因此,支架表面Si元素含量明显下降而C、O元素含量相对增高证明表面修饰成功。
一般来说,静态水接触角小于90°材料为亲水性,且值越小材料越亲水、细胞黏附性越强[28]。硅胶支架经COL和/或PDA修饰后,水接触角明显减小且二者共同修饰组的水接触角也明显小于单一修饰组。此外,本研究发现二者共同对PDMS薄片进行表面修饰时,修饰顺序会影响水接触角大小,在PDMS薄片表面先用COL进行表面修饰再用PDA进行表面修饰的水接触角更小。这可能是由于PDA只有在碱性条件下才能表现足够的活性[29],而COL表面修饰的环境为弱酸性,因此当PDMS-PDA薄片浸入到COL溶液中时,会导致PDA失活进而影响修饰效果。通过对比修饰前后样品的力学特性发现,表面修饰几乎不会对样品原本力学特性产生影响,且修饰前后样品的弹性模量与人体眼周组织接近。这可以有效减少义眼台植入后对周围组织的磨损,有效减少出血、感染等不良反应[6]。
生物相容性检测结果可见修饰前后的多孔硅胶支架均未对PAOEC产生毒性,且细胞在支架上的黏附、增殖能力与支架的亲水性结果保持一致,即PDMS-COLPDA组表现出了最佳的细胞黏附效果。体内生物相容性实验也同样证明PDMS-COL-PDA修饰后的支架具有更好的组织相容性,皮下植入后纤维包膜的厚度更薄,这就意味着通过此方法表面修饰后的多孔硅胶义眼台在植入后更利于组织长入,有望降低并发症的发生率。但此实验中仍存在一定的局限,以内径为840 μm的打印喷嘴制备的硅胶支架,在倒置荧光显微镜下会出现焦距难以调准的问题。虽将原本双层的网格状支架改为单层支架进行细胞活死染色观察,但依旧难以清晰展现细胞形态。
综上所述,通过嵌入式3D打印技术能够以高精度制备个性化的多孔弹性义眼台。通过COL和PDA对硅胶义眼台进行表面修饰能够明显改善硅胶原有的生物惰性,明显促进了细胞黏附及组织生长。为个性化义眼台提供了一种合理、高效、的低成本制备方案,有望减少因材料力学特性不适、组织相容性差造成的眼周出血感染、义眼台术后脱出等问题的发生,具有巨大的临床转化潜力。但本实验仍存在一定的局限性:目前实验仍主要集中于体外实验验证,未构建眼球缺损的相关动物模型用以多孔义眼台的有效性验证。此外,未将本实验构建的弹性义眼台与市面在售的其他类型义眼台的植入效果进行比对。以上不足将在日后实验方案中进一步研究解决。
猜你喜欢
杂志排行
南方医科大学学报的其它文章
- FARSB stratifies prognosis and cold tumor microenvironment across different cancer types: an integrated single cell and bulk RNA sequencing analysis
- EHHADH是肝细胞癌脂肪酸代谢通路的关键基因:基于转录组分析
- 左归降糖解郁方促进糖尿病并发抑郁症大鼠的海马齿状回神经干细胞的自我更新并激活Shh信号通路
- 芦荟苷可抑制胃癌细胞的增殖和迁移:基于下调STAT3/HMGB1信号通路
- RITA 体外选择性抑制BAP1缺失的皮肤黑色素瘤细胞的生长
- 激活小鼠ZI区GABA 能神经元可促进七氟醚和丙泊酚的麻醉诱导而对麻醉维持及觉醒无影响
