一株耐酸性拮抗细菌的筛选、鉴定及对茄雷尔氏菌的抑制作用
2023-06-11耿铭言刘建阳林伟洪天龙闫鼎孔凡玉王静蔡宪杰
耿铭言 刘建阳 林伟 洪天龙 闫鼎 孔凡玉 王静 蔡宪杰

摘 要:為解决酸化烟田青枯病防控难的问题,本研究通过生防菌快速筛选法获得一株耐酸性的拮抗细菌CLP-6,采用扫描电镜观察其拮抗活性,利用HPLC-MS技术确定胞外抑菌物质种类和含量,荧光定量PCR法检测筛选菌株对青枯菌的抑制效果。结果表明,该菌株胞外抑菌物质可降解青枯菌杆状菌体并致其死亡,pH 5.5条件最适宜该菌株生长,且胞外抑菌蛋白和抗生素2,4-二乙酰基间苯三酚产量高。pH 5.5和pH 7.0土壤盆栽试验结果显示,在供试时间范围内,CLP-6能有效降低烟草根际土壤和茎基内青枯菌数量,且pH 5.5时抑菌效果更强,其中,接种192 h时,CLP-6处理烟草根际土壤青枯菌数量较CK处理分别减少98.12%和96.25%;接种144 h时,pH 5.5土壤条件下CLP-6处理烟草茎基内青枯菌数量最低,且显著低于CK处理。16S rRNA,rpoD和rpoB多基因序列联合鉴定CLP-6为防卫假单胞菌(Pseudomonas protegens)。新型耐酸性防卫假单胞菌CLP-6在减轻连作酸化土壤青枯菌侵染和提高烟草青枯病绿色防控效果具有重要开发前景。
关键词:烟草青枯病;pH;次生代谢产物;脂肽类抗生素
中图分类号:S435.72 文献标识码:A 文章编号:1007-5119(2023)02-0058-08
Abstract: In order to solve the problem of prevention and control of tobacco bacterial wilt in acidic soil, an acid-resistant antagonistic bacteria CLP-6 was obtained by rapid screening of biocontrol bacteria based on rapid screening of biocontrol bacteria. The antagonistic activities of CLP-6 were observed by scanning electron microscope, the types and contents of extracellular bacteriostatic substances were determined with HPLC-MS techniques. Moreover, the inhibitory effect of screened strains on R. solanacearum was detected by fluorescence quantitative PCR. The results showed that the R. solanacearum was destroyed and killed by extracellular antagonistic substances of this strain, and pH 5.5 conditions were suitable for the growth of the strain CLP-6, and the extracellular bacteriostatic protein and 2,4-DAPG were high. Strain CLP-6 could significantly reduce R. solanacearum gene copy numbers in rhizosphere soil and stem base of tobacco at pH 5.5 and pH 7.0, and the inhibitory effect was better under the pH 5.5 soil condition. When inoculated for 192 h, the gene copy numbers of R. solanacearum in tobacco rhizosphere soil treated with CLP-6 decreased by 98.12% and 96.25% respectively compared with CK treatment. When inoculated for 144 hours under pH 5.5 soil condition, the gene copy numbers of R. solanacearum in tobacco stem base was the lowest in the CLP-6 treatment and significantly lower than that in the CK treatment. Strain CLP-6 was identified as Pseudomonas protegens combined with 16S rRNA, rpoD and rpoB gene sequences analysis. The new acid-resistant CLP-6 strain has an important development potential in reducing the infection of R. solanacearum in continuous cropping acidic soil and improving the green control of tobacco bacterial wilt.
Keywords: tobacco bacterial wilt; pH; secondary metabolites; lipopeptide antibiotic
由茄雷尔氏菌(Ralstonia solanacearum,简称青枯菌)引起的烟草青枯病(Tobacco bacterial wilt),是严重威胁温带烟草产区的重要土传病害[1-2],常给烟草生产造成重大经济损失[3-4]。青枯菌具有嗜酸性,偏酸性条件有利于病原菌的生长[3,5]。已有研究表明,长期连作可导致土壤pH降低,形成酸性土壤[6],从而加重青枯病的发生程度[3,7]。随着烟草种植面积的不断减少和各地烟叶生产的需求变化,连作是烟草的常见种植模式。目前尚缺乏针对酸性植烟土壤中烟草青枯病的有效防治研究。
生物防治是利用微生物间的拮抗、竞争和寄生等关系或者其发育过程中产生的次生拮抗代谢物,通过直接或间接方式抑制或杀死病原菌,从而达到降低病害发生的目的[8],逐渐成为控制植物病原体以及环境保护的有效手段[9]。根际防病细菌存活于植物根际土壤中,是一类极为重要的生防微生物[10]。本研究在明确采样区连作酸化植烟田青枯病发病区病株和未发病区健株根际土壤pH基础上,拟从健株根际土样分离、筛选适宜于酸性土壤生长的拮抗细菌菌株,研究其耐酸性、抑菌活性和胞外活性成分,结合盆栽试验测定不同pH土壤条件下其对青枯病菌的抑制作用,为土壤酸化条件下烟草青枯病有效防控提供依据。
1 材料与方法
1.1 供试土壤、试剂和品种
2020年7月,在湖南张家界慈利县江垭镇细毛坪村(29°24′N,110°47′E)烟草青枯病连年发生的植烟田中进行土样采集。
供试青枯菌菌株HRs分离自湖南张家界慈利县细毛坪村发病田病株茎部,鉴定为1号小种,生物型Ⅲ。
NB和NA培养基购自青岛海博生物技术有限公司。蛋白酶检测培养基:脱脂奶粉20 g,加蒸馏水定容至500 mL,调pH至7.0,琼脂20 g,121 ℃灭菌15 min。
磷酸缓冲溶液(Phosphate buffer saline, PBS,pH7.2)和Tris-HCl缓冲液(1 mol/L,pH6.8,无菌)购自上海研生生化试剂有限公司,HCl和NaOH溶液浓度为2 mol/L。戊二醛固定液、叔丁醇溶液(电镜专用)购自青岛科源生物科技有限公司。2,4-二乙酰基间苯三酚(2,4-diacetylphloroglucinol, 2,4-DAPG)标准品购自武汉易泰科技有限公司上海分公司(纯度>98%)。
供试烤烟品种为K326,盆栽供试土壤为经121 ℃高压湿热灭菌的市售营养土(pH 7.0±0.5)。
1.2 根际土pH测定
采用对角线5点法和抖根法[11]分别收集未发病区健株和发病区病株根际土,每取样点采集3株根
际土样混合为一份土壤样品,每采样区各收集5份健株和病株根际土样,约为50.0±1.0 g,带回实验室检测。分别称取10.0 g健株和病株的根际土,置于50 mL三角瓶中,加25 mL蒸馏水,室温振荡5 min并静置1 h后,采用PHS-3E型pH仪测定pH,每样品3次重复。
1.3 耐酸性拮抗细菌筛选及其抑菌活性
参照青枯菌生防菌快速筛选方法[12]进行生防菌的筛选。基础培养基为pH 5.5的NA培养基,根际土样悬浮液不做热处理。按照初筛方法对峙培养2 d后,选取产生抑菌圈的拮抗细菌菌株进行复筛,选择拮抗活性最稳定的菌株CLP-6进行后续试验。
分别挑取CLP-6和青枯菌HRs单菌落接种于NB培养液,28 ℃、150 r/min条件摇瓶培养48 h后,采用无菌水梯度稀释法结合分光光度计将拮抗细菌和HRs菌液浓度分别调整为1×108 CFU/mL(OD600=0.1)。
CLP-6菌液经0.22 μm细菌过滤器除菌后获得无菌上清液。取9 mL上清液与1 mL HRs菌液混合,空白处理为等量NB与HRs菌液混合。各处理于28 ℃、150 r/min振荡培养48 h后,经8000 r/min、4 ℃低温离心8 min,收集菌体沉淀经PBS缓冲液冲洗3次,200 μL PBS缓冲液重悬后,加500 μL 2.5%戊二醛溶液固定24 h,8000 r/min离心,沉淀以叔丁醇梯度脱水15 min,真空干燥1 h,通过扫描电镜(SEM)观察CLP-6胞外代谢物对青枯菌生长和形态的影响。
1.4 CLP-6菌株耐酸性及其拮抗活性測定
1.4.1 培养基pH 对CLP-6菌株生长扩繁的影响 挑取CLP-6单菌落接种于NB培养基中,28 ℃、150 r/min振荡过夜培养,以2.5%接种量分别转接于装有100 mL pH 4.0~8.0(梯度为0.5)NB培养基的三角瓶内,28 ℃、120 r/min振荡培养,分别于24、48、72、96和120 h取样,分光光度计法测定各处理菌液浓度。
菌液经0.22 μm细菌过滤器除菌后获得无菌上清液,备用。
1.4.2 不同pH培养下CLP-6菌液及上清液拮抗活性的测定 采用喷菌法和琼脂对峙扩散法[13]进行。将HRs菌液均匀喷雾至NA平板表面,在距平板中央 2 cm处对称打取2个孔洞(直径7 mm),分别取70 μL 1.4.1中各处理CLP-6菌液和上清液加入孔内,对照为等量相应pH的NB培养基,28 ℃培养48 h后测量抑菌圈直径大小,每处理3次重复。
1.4.3 不同pH培养下CLP-6胞外蛋白含量及其拮抗活性测定 pH 5.0~ 8.0(梯度0.5)无菌上清液蛋白含量测定采用考马斯亮蓝染色法。采用硫酸铵沉淀法[14]制备上述各处理粗提蛋白,蛋白酶检测培养基平板测定其产水解蛋白能力,平板抑菌法测定其HRs拮抗活性[13],对照为等pH的NB处理。
1.4.4 脂肽类抗生素2,4-DAPG拮抗活性及培养基pH 对其产量的影响 采用喷菌法[13]测定2,4-DAPG标准品(0.001 g/mL)对HRs拮抗活性,对照为等量NB,28 ℃黑暗培养48 h后观察抑菌圈。每处理3次重复。
采用普通PCR法检测2,4-DAPG合成基因phlD,引物为Phl2a:5′-GAGGACGTCGAAGACCACCA- 3′;Phl2b:5′-ACCGCAGCATCGTGTATGAG-3′[15]。PCR产物测序后,提交GenBank与已知基因序列比对同源性,验证CLP-6产2,4-DAPG能力。
将pH 5.5和pH 7.0条件下培养的CLP-6菌液经乙酸乙酯萃取,0.45 μm滤器除去杂质,采用液质联用HPLC MS(ESI-MS:6410 Triple Quad LC/MS,安捷伦科技有限公司,USA)检测。色谱柱采用反相色谱柱ZORBAX Eclipse XDB-C18(50 mm×2.1 mm,1.8 μm)。流动相A为0.1%的乙酸溶液,B为100%乙腈,VA∶VB=60∶40,流速设置为0.4 mL/min,柱温40 ℃。质谱条件:毛细管电压4.5 kV,毛细管温度300 ℃,质谱扫描范围100~1500 m/z,扫描速率500 amu/s。数据获取采用正离子模式。以2,4-DAPG为内标制作标准曲线进行定量。
1.5 菌株CLP-6在不同酸碱度土壤中的抑菌效果
1.5.1 GCN(gene copy number)标准曲线建立 制备标准品,采用EasyPure? Bacteria Genomic DNA Kit试剂盒提取青枯菌基因组DNA,使用引物RSF/RSR[16]进行普通PCR扩增,构建标准阳性质粒[17]。筛选单克隆提取重组质粒送青岛派森诺基因科技有限公司测序。
进行荧光定量检测体系的优化,采用SYBR GreenⅠ技术[18],按20 μL反应体系(表1),进行PCR扩增:95 ℃预热10 min,(95 ℃ 15 s,60 ℃ 40 s)×45个循环,每处理5次重复。PCR反应后立即进行溶解曲线分析,95 ℃下15 s,60 ℃ 1 min,根据Tm值验证PCR产物扩增的特异性。
经10倍梯度稀释调整质粒浓度为1×101~1×108拷贝/μL,每梯度设定3个重复,根据基因拷贝数和达到阈值的循环数(Threshold cycle,Ct)建立GCN标准曲线。
1.5.2 CLP-6对烟草根际土壤和烟草茎内青枯菌数量的抑制效果测定 取适量HCl与供试无菌土(pH 7.0)充分混匀,称取(通过2 m筛孔)土样5.0 g置于50 mL烧杯中,加入12.5 mL ddH2O,搅拌5 min,静置30 min,PHS-3E型pH仪测定pH。反复调整至土壤pH 5.5±0.1。将浓度为1×108 CFU/mL HRs菌液分别混入pH 5.5和pH 7.0土壤,至土壤含菌终浓度均为1×108 CFU/g。
试验共设4个处理:T1,CLP-6菌液+青枯菌+pH 5.5土壤;T2,CLP-6菌液+青枯菌+pH 7.0土壤;CK1,青枯菌+pH 5.5土壤;CK2,青枯菌+pH 7.0土壤。将45 d苗龄烟苗分别经CLP-6菌液(1×108 cfu/mL)或无菌水浸根40 min后移栽至盛有上述4个处理土壤的花盆(净重150 g),每处理10盆烟苗,3次重复。供试烟苗置于昼夜温度为32/30 ℃、75%湿度的人工气候室内培养,分别于接种后48、72、96、144和192 h时收集根际土,每重复土样为(2.0±0.1)g;同时无菌切取茎基向上1.0 cm的茎组织,置于超低温冰箱。称取供试土样(1.0±0.05)g,用试剂盒(Soil Genomic DNA Extraction Kit,Solarbio公司)提取土壤基因组DNA;称取茎组织(100.0±1.0)mg,用EasyPure?Plant Genomic DNA Kit试剂盒提取茎内细菌基因组DNA,各处理、各取样时间的土壤和茎基样品参照1.5.1进行荧光定量PCR,根据自动生成的基因拷贝数(Gene copy number, GCN)制作消长动态曲线。
1.6 耐酸性拮抗细菌种类分子鉴定
利用EsayPure?Bacteria Genomic DNA Kit试剂盒(北京全式金生物技术有限公司)操作步骤提取CLP-6基因组DNA,测定16S rDNA(通用引物27 F/1492 R)及rpoB和rpoD基因进行PCR扩增[19]。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 90 s,35次循環;72 ℃ 7 min。PCR扩增产物由青岛派森诺基因科技有限公司测序,将序列递交GenBank并BLAST比对,MEGA 6.0软件系统发育分析。
1.7 数据分析
利用DPS 7.05软件,采用Duncan氏新复极差法进行分析,同一列数据后的不同字母代表在p<0.05水平下具有显著差异性,数据作图采用Excel(2019)软件。
2 结 果
2.1 烟草病株与健株根际土壤pH
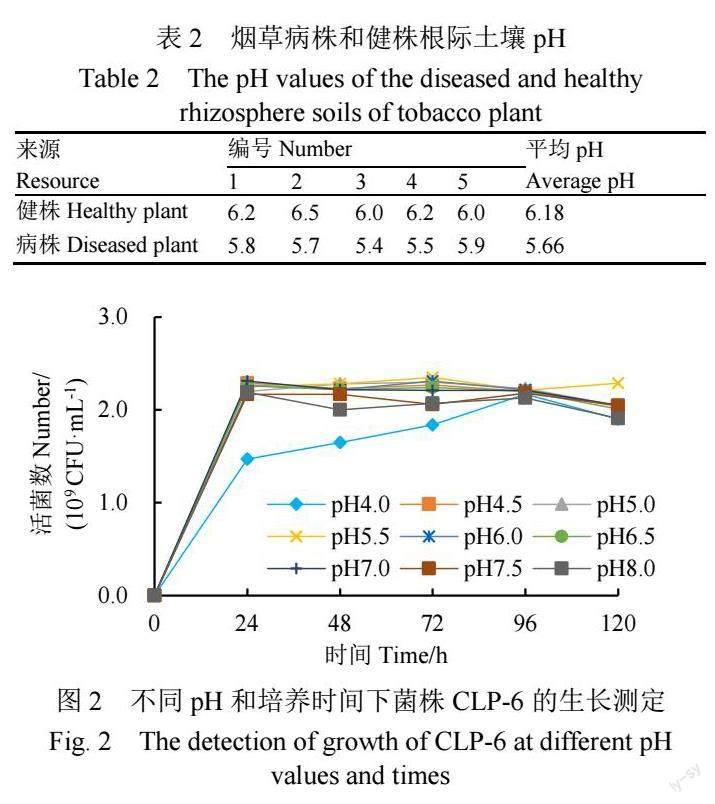
江垭镇细毛坪村青枯病侵染烟田未发病区健株和发病区病株各5份根际土样的pH平均值分别为6.18和5.66(表2),说明该连作青枯病烟田土壤酸化现象明显,且健康烟株根际土壤pH均高于病株根际土壤。
2.2 耐酸性拮抗细菌筛选及其抑菌活性
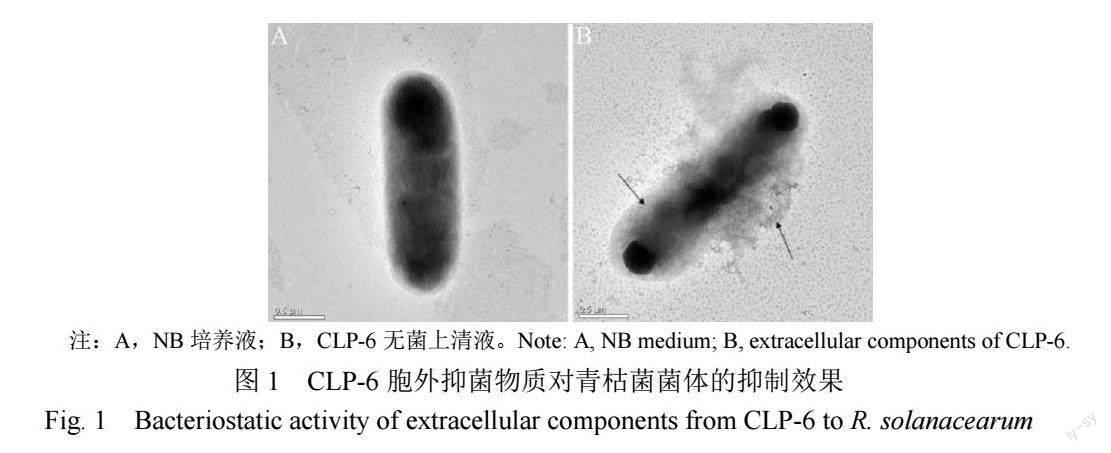
经酸性培养的初筛和拮抗活性复筛,获得耐酸性和拮抗活性均最强的拮抗细菌CLP-6,其发酵液和无菌上清液在pH 5.5时对HRs的抑菌性明显。扫描电镜观察显示:处理48 h后,对照的青枯菌杆状菌体外形规整、生长正常(图1A);无菌上清液致使青枯菌杆状菌体的内含物外泄,弥散包围在菌体周围,菌体中部变形(图1B,箭头处),最终菌体死亡。
2.3 pH对CLP-6菌株生长和拮抗活性的影响
如图2所示,CLP-6在不同pH下培养,pH<5.0时其生长明显受到抑制,pH为5.5~8.0,培养72 h时菌液浓度最高,其中pH 5.5处理菌液浓度最高(2.35×109 CFU/mL)。CLP-6菌株生长的最佳初始pH为5.5,最佳培养时间为72 h。
如图3所示,在不同pH条件下培养48 h,随pH增加,CLP-6发酵液和无菌上清液对青枯菌拮抗活性呈先上升后下降的趋势,在pH 5.5时,二者的抑菌活性最强。
2.4 pH对CLP-6胞外拮抗物质产量和活性的影响
2.4.1 胞外抑菌蛋白拮抗活性及含量 经CLP-6上清液处理的选择性培养基出现了水解透明圈(图4),说明CLP-6具有產水解蛋白的能力。进一步通过拮抗活性试验结果证明了CLP-6胞外抑菌蛋白能够拮抗青枯菌(图5)。
如图6所示,相同pH条件下,CLP-6上清液蛋白含量与培养时间基本呈正相关,且72 h、pH 6.5时的蛋白含量达到最高;相同培养时间条件下,菌株CLP-6发酵液中蛋白含量随pH增加呈先上升后下降趋势。培养时间为72~120 h时,pH 6.5和pH 7.0条件下菌液蛋白含量相对较高。上述结果表明,在偏酸-中性条件、培养时间为72 ~120 h时更适合菌株CLP6菌株蛋白分泌。
2.4.2 pH对CLP-6分泌2,4-DAPG及其拮抗活性的影响 CLP-6菌株phlD扩增序列为745 bp(图7A),与P. fluorescens PGNR1 (AY928629)的phlD基因序列同源性为99%,说明菌株CLP-6具有分泌2,4-DAPG的能力。拮抗活性试验验证了0.001 g/mL 2,4-DAPG标准品可以抑制青枯菌生长(图7B)。HPLC-MS检测pH 5.5和pH 7.0培养的粗提物组分显示,pH 5.5时,保留时间为3.37 min的出峰(图8),与2,4-DAPG标准品保留时间一致[20];结合标准曲线y=0.1039x+0.0126(R2=0.99),pH 5.5培养条件时检测2,4-DAPG浓度为30 mg/L,而pH 7.0时未检测到2,4-DAPG。上述结果说明,pH 5.5条件诱导CLP-6合成2,4-DAPG,有助于提高其拮抗活性。
2.5 pH 5.5和pH 7.0条件下菌株CLP-6对烟草根际土壤和茎内青枯菌的抑制作用
通过对青枯菌进行荧光定量PCR得到GCN标准曲线为Ct=?2.7911 lg C0+38.93(R2>0.99,其中Ct为达到荧光强度阈值的循环数,C0为基因拷贝数)。CLP-6菌接种于pH 5.5和pH 7.0土壤后,均能够抑制烟草根际青枯菌数量增长(图9)。在处理72 h内,所有处理的根际土壤青枯菌数量呈缓慢上升趋势。至96 h时,T1和T2根际土壤青枯菌GCN比72 h时略微下降,CK1和CK2土壤青枯菌GCN快速上升。CLP6处理pH 5.5和pH 7.0混菌土壤有效抑制了病菌的生长,青枯菌GCN比2个空白处理分别降低了90.48%和88.65%。随接种时间再增加,4个处理土壤青枯菌量总体趋势呈现下降趋势,但CLP-6处理的青枯菌数量降低幅度大,至192 h时,T1和T2烟草根际土壤青枯菌GCN分别较CK1和CK2降低了98.12%和96.25%。以上说明CLP-6菌株能够较好地抑制根际土壤青枯菌数量增长,且pH 5.5土壤条件下其抑制效果更强。
如图10所示,接种至96 h内,所有处理茎基组织内青枯菌量总体呈上升趋势,但CLP-6处理的青枯菌数量增加相对缓慢。至96 h时,CK2处理青枯菌菌量最多,为8.94×107 CFU/g,其次为CK1,而T1和T2茎基组织内青枯菌GCN仅为4.08×107和3.63×107 CFU/g,较对照减少38.46%和59.40%。随接种时间再延长,茎基组织内青枯菌数量呈先下降后上升趋势,但CLP-6处理的茎基组织内青枯菌数量始终处于较低水平。以上说明CLP-6能够较好地抑制烟草茎基组织内青枯菌数量增长,且在pH 5.5土壤条件下抑菌效果更强。
2.6 耐酸性拮抗细菌CLP-6属种鉴定
菌株CLP-6的16S rDNA、rpoB和rpoD基因序列登录号分别为KX644136、MT914470和MT914471,经NCBI数据库BLAST同源性比对,其同源性分别为100%、99.58%和99.58%。多基因联合系统发育树(图11)表明,CLP-6与护卫假单胞菌pf5属于同一分支,因此鉴定CLP-6为P. protegens。
3 讨 论
连作酸化植烟田中青枯病发生较重是亟待解决的问题。本研究从酸化的健株根际土中筛选到一株对青枯菌有较强拮抗活性的耐酸性护卫假单胞菌CLP-6,研究发现pH 5.5酸性条件最适宜该菌株生长,其分泌的胞外抑菌物质可降解青枯菌菌体,最终致菌体死亡,且胞外抑菌蛋白和抗生素2, 4-DAPG在酸性条件下产量高,说明酸性生长条件增强了CLP-6对青枯菌的拮抗活性。已有研究表明假单胞菌可以通过分泌蛋白酶,产生2, 4-DAPG、硝吡咯菌素、吩嗪类等抗生素抑制病原菌生长[21-22]。本研究获得的防卫假单胞菌CLP-6通过分泌抑菌蛋白和抗生素发挥协同抑菌功能,对青枯菌具有更强的拮抗能力,也进一步显示了CLP-6菌株具有在酸性土壤条件下提高青枯病防病效果的应用潜力。
本研究通过荧光定量PCR法检测CLP-6菌液处理混菌土壤和烟草茎内青枯菌拷贝数,发现CLP-6能够明显减少烟草酸性和中性根际土壤及茎基组织内青枯菌数量,且pH 5.5条件下的抑菌作用更强,说明CLP-6菌株可在酸性土壤条件下生长、繁殖并减轻青枯病的发生。目前尚未有嗜酸性生防细菌在不同pH土壤条件下防治烟草青枯病菌的报道,本研究在盆栽条件下对土壤和烟草茎内青枯菌数量进行定量检测跟踪,为了解嗜酸性防卫假单胞菌CLP-6的抑菌能力、动态变化和抑菌效果提供了直观的科学依据。
此外,本研究发现,pH 5.5和pH 7.0土壤条件下,CK处理的根际土壤青枯菌数量于72 h开始急剧上升,于96 h开始趋于平缓;与之相比,CLP-6处理的青枯菌数量于96 h时缓慢增加,且远低于CK处理的青枯菌数量,说明CLP-6能一定程度延缓青枯病发病时间和发病程度;处理120 h后根际土壤中青枯菌数量开始急剧下降,至192 h较CK1和CK2分别降低98.12%和96.25%。推测其原因是接种的CLP6菌株适应了酸性土壤环境后,在一定程度上与青枯菌进行生存竞争,抢夺营养与空间,后逐渐占据生态位,在根际土壤微生物菌群占有绝对优势,同时通过分泌大量胞外拮抗物质持续抑制青枯菌增殖,从而降低根际土壤青枯菌数量。而茎基组织内青枯菌数量变化趋势不同于根际土壤,尤其是在接种120~192 h时间内,CLP-6处理的烟草茎内青枯菌数量远低于CK处理,但呈下降后缓慢上升趋势,说明接种后期,CLP-6不能有效抑制侵入茎内的青枯菌数量,因此建议在有效间隔时间加强接种CLP-6菌株保护根际,以达到延迟发病时间,减轻发病程度和有效减轻病害损失的目的。
4 结 论
本研究经分离和筛选获得了一株具有耐酸性且对青枯菌具有较强拮抗活性的护卫假单胞菌CLP-6,该菌株生长的最佳初始pH为5.5,最佳培养时间为72 h。在偏酸性(pH 5.0~6.5)条件下,尤其是pH 5.5条件下CLP-6菌发酵液和无菌上清液抑菌活性最强,胞外抑菌蛋白和抗生素2,4-DAPG产量增多,拮抗活性增强。该菌株能有效抑制烟草根际土壤和茎基组织内青枯菌的生长,且酸性条件更有利于该菌株发挥抑菌作用,在提高连作酸化土壤条件下烟草青枯病或其他茄科作物细菌性青枯病的防病效果方面具有重要的应用潜力。
参考文献
[1]孔凡玉. 烟草青枯病的综合防治[J]. 烟草科技,2003,4(4):42-43,48.
KONG F Y. Comprehensive control of tobacco bacterial wilt[J]. Tobacco Technology, 2003, 4(4): 42-43, 48.
[2]ELPHINSTONE J G, ALLEN C, PRIOR P, et al. The current bacterial wilt situation: a global overview[J]. Bacterial wilt disease and the Ralstonia solanacearum species complex, 2005: 9-28.
[3]LI S, LIU Y, WANG J, et al. Soil acidification aggravates the occurrence of bacterial wilt in South China[J]. Frontiers in microbiology, 2017, 8: 703.
[4]陳瑞泰,朱贤朝,王智发,等. 全国16个主产烟省(区)烟草侵染性病害调研报告[J]. 中国烟草科学,1997(4):3-9.
CHEN R T, ZHU X C, WANG Z F, et al. Survey report on tobacco infectious diseases in 16 major tobacco producing provinces (districts)[J]. China Tobacco Science, 1997(4): 3-9.
[5]樊俊,向必坤,谭军,等. 雪茄烟田微生物群落和土壤理化性状与青枯病发生的关系[J]. 中国烟草科学,2022,43(5):94-100.
FAN J, XIANG B K, TAN J, et al. relationship between microbial community, soil physical and chemical properties and occurrence of bacterial wilt in cigar field[J]. Chinese Tobacco Science, 2022, 43(5): 94-100.
[6]ZHANG Y, HE X, LIANG H, et al. Long-term tobacco plantation induces soil acidification and soil base cation loss[J]. Environmental Science and Pollution Research, 2016, 23(6): 5442-5450.
[7]SHEN G, ZHANG S, LIU X, et al. Soil acidification amendments change the rhizosphere bacterial community of tobacco in a bacterial wilt affected field[J]. Applied microbiology and biotechnology, 2018, 102(22): 9781-9791.
[8]刘宪臣. 温湿度对烟草青枯病发生的影响及调控技术研究[D]. 重庆:西南大学,2014.
LIU X C. Influence of temperature and humidity on the occurrence of tobacco bacterial wilt and its control technology[D]. Chongqing: Southwest University, 2014.
[9]WU K, SU L, FANG Z, et al. Competitive use of root exudates by Bacillus amyloliquefaciens with Ralstonia solanacearum decreases the pathogenic population density and effectively controls tomato bacterial wilt[J]. Scientia Horticulturae, 2017, 218: 132-138.
[10]KATIYAR D, HEMANTARANJAN A, DWIVEDI P. Plant growth promoting rhizobacteria and their roles as fungal biocontrol agents: an overview[J]. The Journal of Plant Science Research, 2018, 34(2): 127-136.
[11]華菊玲,刘光荣,黄劲松. 连作对芝麻根际土壤微生物群落的影响[J]. 生态学报,2012,32(9):2936-2942.
HUA J L, LIU G G, HUANG J H. Effects of continuous cropping on soil microbial communities in the sesame rhizosphere[J]. Acta Ecologica Sinica, 2012, 32(9): 2936-2942.
[12]刘国红,刘波,林乃铨. 青枯雷尔氏菌生防芽胞杆菌的快速筛选及其鉴定[J]. 中国生物防治学报,2013,29(3):473-480.
LIU G H, LIU B, LIN N Q. Rapid screening and identification of Ralstonia solanacearum biocontrol bacillus[J]. Chinese Journal of Biological Control, 2013, 29 (3): 473-480.
[13]张立帆. 烟草青枯病拮抗放线菌的分离鉴定及其生防效果的研究[D]. 南京:南京农业大学,2017.
ZHANG L F. Isolation and biological feature study of an actinomyces strain and its biocontrol effect against tobacco bactetrial wilt[D]. Nanjing: Nanjing Agricultural University, 2017.
[14]黄娜. 枯草芽孢杆菌粗蛋白的提取纯化及抑菌作用[D]. 合肥:安徽农业大学,2015.
HUANG N. Extraction and purification of crude protein from Bacillus subtilis against pathogenic fungus[D]. Hefei: Anhui Agricultural University, 2015.
[15]FRAPOLLI M, DéFAGO G, MO?NNE‐LOCCOZ Y. Multilocus sequence analysis of biocontrol fluorescent Pseudomonas spp. producing the antifungal compound 2, 4-diacetylphloroglucinol[J]. Environmental Microbiology, 2007, 9(8): 1939-1955.
[16]CHEN Y, ZHANG W Z, LIU X, et al. A real-time PCR assay for the quantitative detection of Ralstonia solanacearum in horticultural soil and plant tissues[J]. Journal of Microbiology and Biotechnology, 2010, 20(1): 193-201.
[17]王瑜,马建忠,张伟杰,等. 腐皮镰刀菌SYBR Green实时荧光定量PCR快速检测方法的建立[J]. 微生物学免疫学进展,2018,46(2):34-39.
WANG Y, MA J Z, ZHANG W J, et al. Rapid identification of Fusarium solani by SYBR Green real time quantitative PCR[J]. Prog in Microbiol Immunol, 2018, 46(2): 34-39.
[18]徐匆,罗华建,李艳芳,等. 环介导等温扩增技术的应用及研究进展[J]. 广东农业科学,2019,46(4):116-123.
XU C, LUO H J, LI Y F, et al. Application and progress of loop-mediated isothermal amplification technology[J]. Guangdong Agricultural Sciences, 2019, 46(4): 116-123.
[19]WINTON L, STONE J, WATRUD L, et al. Simultaneous one-tube quantification of host and pathogen DNA with real-time polymerase chain reaction[J]. Phytopathology, 2002, 92(1): 112-116.
[20]BAI Y, WANG G, CHENG Y, et al. Soil acidification in continuously cropped tobacco alters bacterial community structure and diversity via the accumulation of phenolic acids[J]. Scientific Reports, 2019, 9(1): 1-18.
[21]TASHI‐OSHNOEI F, HARIGHI B, ABDOLLAHZADEH J. Isolation and identification of endophytic bacteria with plant growth promoting and biocontrol potential from oak trees[J]. Forest Pathology, 2017, 47(5): e12360.
[22]HAAS D, KEEL C. Regulation of antibiotic production in root-colonizing Pseudomonas spp. and relevance for biological control of plant disease[J]. Annual review of phytopathology, 2003, 41: 117.
