复合蛋白肽对高脂饮食诱导肥胖大鼠糖脂代谢的影响
2023-06-11赵慧文王淑娥张钊张学军张西平魏玮赵秀兰
赵慧文 王淑娥 张钊 张学军 张西平 魏玮 赵秀兰

摘 要:目的:探究复合蛋白肽对高脂饮食诱导肥胖大鼠糖脂代谢的改善作用。方法:将雄性SD大鼠随机分为肥胖模型组、空白对照组,肥胖模型组给予高脂饲料持续喂养4w,筛选肥胖敏感大鼠分为低(LPP)、中(MPP)、高(HPP)剂量组,饲料中复合蛋白肽的含量分别为25%、50%、100%,另设与低、中剂量组等热量饲喂的模型对照组1(MC1)和高剂量组等热量的模型对照组2(MC2)。给予复合蛋白肽干预4w后,检测各组大鼠体重与脂肪含量、肝脏脂肪蓄积以及棕色脂肪能量代谢相关蛋白情况。结果:复合蛋白肽能够显著降低肥胖大鼠的体重、脂肪含量及血脂水平,同时能够降低肝脏脂滴密度,增加线粒体氧化磷酸化复合物(OXPHOS)、解偶联蛋白1(UCP1)表达水平。结论:复合蛋白肽能降低肥胖大鼠体内脂肪含量和血脂水平,可能与增强棕色脂肪组织中OXPHOS和UCP1表达相关。
关键词:复合蛋白肽;高脂饮食;肥胖;糖脂代谢
人群研究证实,高蛋白摄入可以减重、改善体脂指数、改善脂代谢及肥胖引起的慢性炎症,还能够降低心血管疾病的发病风险[1-9]。动物研究显示,高蛋白饮食可以降低体重和体脂,以及降低肝脏甘油三酯含量并提高胰岛素敏感性[10-11]。本研究首先采用高脂饲料诱导大鼠肥胖,然后用添加不同比例的复合蛋白肽样品喂饲动物,并观察了对动物体重、糖代谢及脂肪代谢的影响。
1 材料与方法
1.1 主要试剂和仪器
复合蛋白肽,由中食都庆(山东)生物技术有限公司提供;抗解偶联蛋白1(UCP1)抗体、抗线粒体氧化磷酸化复合物(OXPHOS)抗体,美国Abcam公司;β-actin抗体,美国Sigma-Aldrich公司;HRP标记二抗,北京中山金桥生物技术有限公司;BCA蛋白浓度测定试剂盒,美国Pierce Biotechnology;发光试剂ECL,美国Millipore公司;油红O,美国Sigma-Aldrich公司。主要仪器:AU5800全自动生化分析仪,美国Beckman Coulter公司;低温高速离心机,德国Heraeus Biofuge Stratos公司;MICROMHM525冰冻切片机、天能5200 multi全自动化学发光图像处理系统,德国Thermo Scientific公司。
1.2 方法
1.2.1 实验动物分组及处理 健康SPF级SD雄性大鼠,济南朋悦实验动物繁育有限公司。实验动物生产许可证号为SCXK(鲁)20190003。实验动物使用许可证号为SYXK(鲁)20150015。饲养环境为SPF级环境温度(24±2)℃,相对湿度(50±10)%,明/暗循环为12 h/12 h。大鼠适应性喂养5 d后,随机分为喂饲高脂饲料的肥胖模型组和空白对照组,2组饲料脂肪供热比分别为45%和10%,持续喂养4 w至2组动物体重出现统计学差异(P<0.05)。筛选肥胖敏感大鼠分为低、中、高剂量组,其中低、中剂量组饲料在50%高脂饲料基础上分别添加25%、50%的复合蛋白肽,高剂量组饲料由100%的复合蛋白肽制成,另设与低、中剂量组等热量饲喂的模型对照组1和高剂量组等热量的模型对照组2。模型对照组1饲料由50%高热量饲料和50%维持饲料组成,模型对照组2喂饲维持饲料。原空白对照组喂饲维持饲料,饲料配方如表1所示、复合蛋白肽样品成分如表2所示。实验期间动物自由饮水,定期称重和记录饲料消耗。实验结束后,动物空腹16 h,称量空腹体重,然后用10%水合氯醛和20%乌拉坦混合麻醉剂(1∶1)(0.5 mL/100 g BW)麻醉大鼠。腹主动脉取血,解剖动物取脏器及脂肪称重。血液4 ℃、1 000 g离心20 min,取血清全自动生化分析仪检测血脂及生化指标。
1.2.2 肝脏油红O染色 取肝左叶相同部位制备10 μm冰冻切片,预冷10%福尔马林溶液固定,蒸馏水洗涤,丙二醇浸泡5 min除去多余水分,60 ℃油红O染色10 min,85%丙二醇溶液分化,蒸馏水漂洗,苏木素中浸染30 s,流水冲洗后甘油明胶封片,显微镜下观察、采集图片。
1.2.3 血脂及血生化指标检测 全自动生化分析仪检测小鼠血清甘油三酯(TG)、总胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.2.4 Western blot检测 采用RIPA裂解液和电动匀浆器制备棕色脂肪组织匀浆,冰上静置30 min,4 ℃、12 000 g离心15 min取上清液,BCA检测蛋白质含量。蛋白质变性,SDS-PAGE分离目的蛋白,转印至PVDF膜,3%脱脂奶粉TBST室温下封闭1 h,加入一抗4 ℃摇床过夜,洗膜后置于辣根过氧化物酶标记二抗中室温孵育1 h,采用天能5200 multi全自动化学发光图像处理系统显示目的条带,ImageJ软件分析条带。
1.3 数据处理
采用SPSS 24.0进行数据处理,数值变量资料以x±s表示。各组别采用ANOVA进行方差分析,两两比较,若方差齐选用LSD法,方差不齐选用Dunnett's T3法。处理结果中,P<0.05为差异有统计学意义。
2 结果与分析
2.1 各组大鼠体重及总热能摄入情况
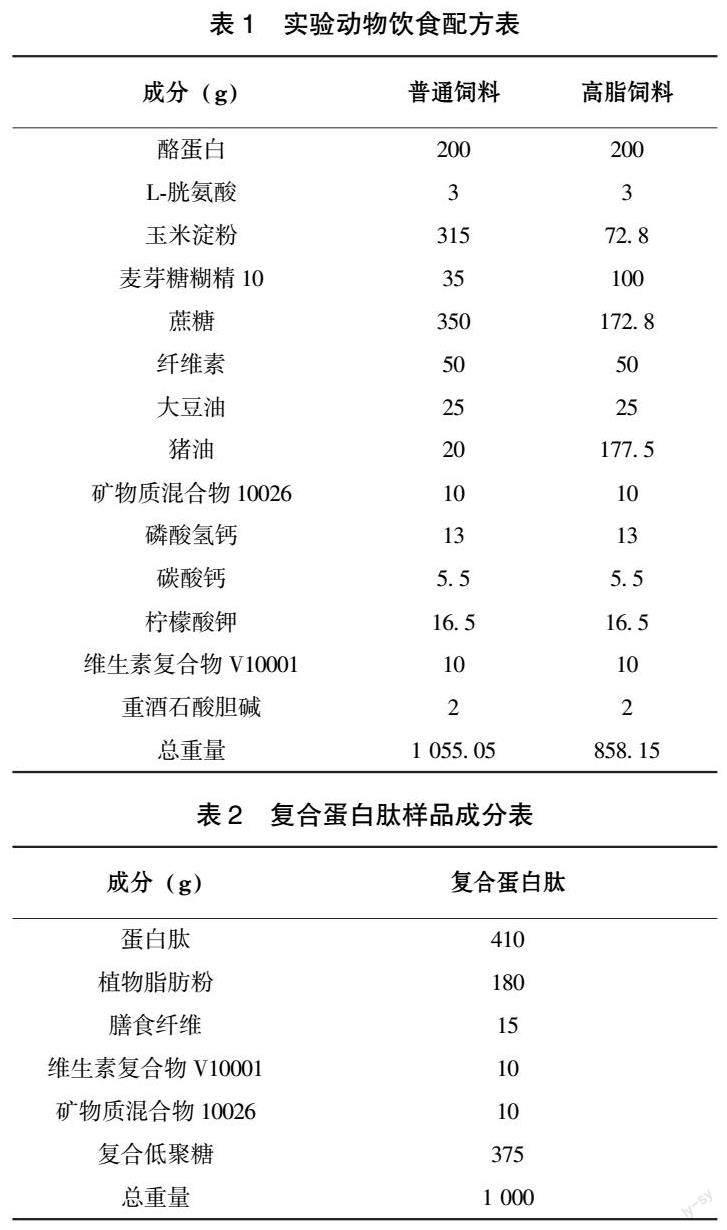
由表3可见,干预实验期间各组大鼠体重均呈增长趋势。除高剂量组外,各组动物各時点体重均明显高于空白对照组(P<0.05、P<0.01),中、高剂量组动物增重明显低于模型对照组1(P<0.01);高剂量组动物增重明显低于模型对照组2(P<0.01)。由表4可见,高剂量组和模型对照组2动物热能摄入量明显低于其他各组(P<0.01),高剂量组明显低于模型对照组2(P<0.01);其余各组总热量摄入无明显差别。结果显示,复合蛋白肽能够降低肥胖动物体重,且能够明显降低总热量摄入。
2.2 各组动物体内脂肪和肝脏脂肪含量变化
由表5可见,低、中剂量组动物内脏脂肪(肾周、附睾)重量低于模型对照组1,高剂量组动物内脏脂肪明显低于模型对照组2(P<0.01);低、中剂量组动物白色脂肪(肾周、附睾、皮下)低于模型对照组1,高剂量组动物白色脂肪低于模型对照组1(P<0.01)和模型对照组2(P<0.05)。结果显示,复合蛋白肽能够减低肥胖大鼠的内脏脂肪和白色脂肪。
图1大鼠肝脏冰冻切片油红O染色显示,空白对照组肝脏中脂滴较少,模型对照组2的脂滴数量和密度均明显增多,低、中剂量组的肝脏脂滴数量和密度较模型对照组1均有所下降,高剂量组的脂滴染色与模型对照组1和组2相比均明显减少。结果显示,复合蛋白肽可降低肥胖动物肝脏脂肪含量。
2.3 各组动物血脂及糖代谢指标变化
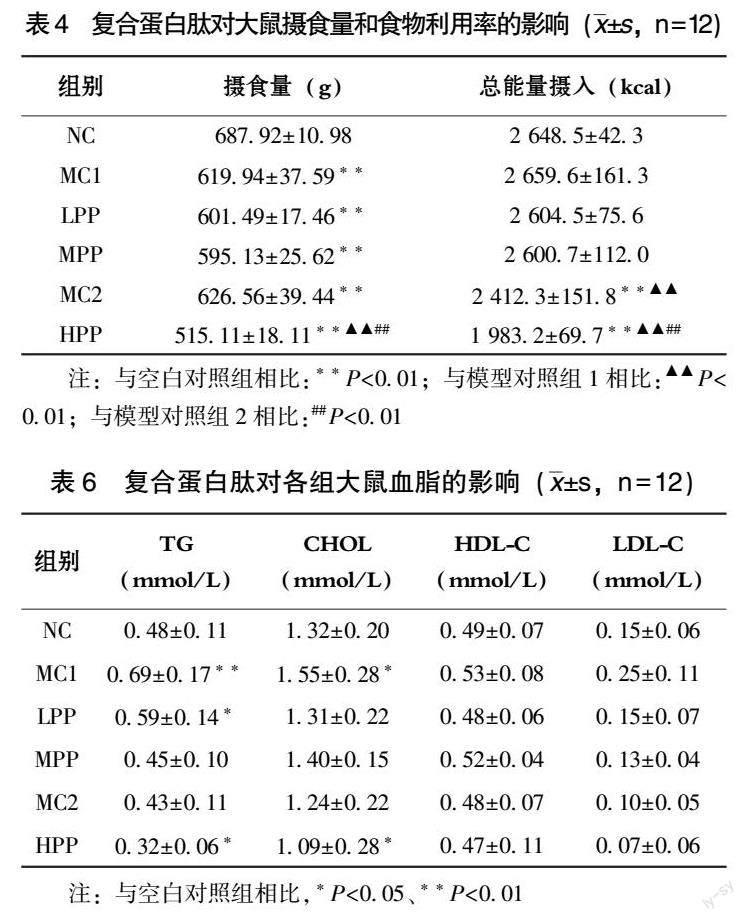
由表6看出,与模型对照组1相比,低、中、高剂量组动物血清TG、总胆固醇和LDL-C均呈现不同程度的降低,其中高剂量组TG和总胆固醇低于空白对照组(P<0.05)。各组间HDL-C变化不明显。由图2可见,各剂量组GTT各时间点葡萄糖水平和AUC与模型组相比,差异不大;由图3可见,各剂量组ITT各时间点血糖和AUC与模型对照组略有降低,但均无显著性差异(P>0.05)。结果显示,复合蛋白肽能在一定程度上降低血脂水平。
2.4 各组动物棕色脂肪组织线粒体能量代谢相关蛋白表达改变
由图4和图5看出,低、中、高剂量组大鼠棕色脂肪OXPHOS的整体表达高于模型对照组,中、高剂量组升高具有统计学意义(P<0.05)。与模型对照组1相比,低、中剂量组中复合物Ⅱ、Ⅲ、Ⅳ的表达水平升高有统计学差异(P<0.01、P<0.05);与模型对照组2相比,高剂量组的复合物Ⅰ、Ⅱ、Ⅲ的表达升高具有统计学意义(P<0.01)。低、中、高剂量组动物棕色脂肪中的UCP1表达也呈现出升高趋势。
3 讨论
对包括24项随机对照试验的荟萃分析显示,高蛋白饮食能够明显减低人体体重、脂肪含量和血甘油三酯水平,伴随去脂组织和静息能量消耗增加[12]。膳食脂肪供能同为30%的情况下,摄食蛋白质供能25%的高蛋白与摄食蛋白质供能12%的受试者相比,6个月后平均减重3.7 kg,其中平均减低脂肪重量3.3 kg[13]。研究显示,高蛋白饮食可以刺激胰高血糖素样肽-1、胆囊收缩素和酪酪肽分泌,这些多肽激素可以通过刺激迷走神经,增加饱腹感,从而减少食物摄入[14]。本研究观察到,添加25%和50%复合蛋白肽的实验动物摄食无明显降低,但全部摄食复合蛋白肽的实验动物饲料消耗量和能量摄入明显低于对照动物。
研究显示,高蛋白饮食降低体重的作用也与增加脂肪氧化和能量消耗相关[15-16]。脂肪组织分为白色脂肪组织和棕色脂肪组织,其中白色脂肪组织以甘油三酯的形式储存能量,而棕色脂肪组织含有大量的线粒体。动物研究显示,通过氧化磷酸化刺激线粒体的生物合成、产热及能量消耗可控制小鼠肥胖[17]。线粒体氧化磷酸化电子传递链系统包含位于线粒体内膜中的5个呼吸链酶复合物(CⅠ-NDUF88、CⅡ-SDHB、CⅣ-MTCO1、CⅢ-UQCRC2、CⅤ-ATP5A),以ATP的形式释放能量,是细胞能量供给的主要方式。动物和人群试验均显示,高脂饮食导致的肥胖和胰岛素抵抗可导致OXPHOS和线粒体合成的基因减少,反之,OXPHOS系统的功能障碍也可引起线粒体呼吸链复合物的形成和脂质代谢紊乱,从而导致肥胖和2型糖尿病的发生[18-19]。研究证实,棕色脂肪可通过非颤栗产热来控制体重,调节能量代谢,其中UCP1发挥关键作用,UCP1通过介导物质氧化磷酸化及ATP生成解偶联,将能量以热能形式耗散,增加产热和能量代谢率[20-21]。本研究观察到复合蛋白肽可以增加OXPHOS、UCP1的表达,其中高剂量组可以显著增加复合物Ⅰ、Ⅱ、Ⅲ的表达,低、中剂量组增加了Ⅱ、Ⅳ、Ⅲ的表达,且均具有统计学差异。因此,复合蛋白肽可以增强棕色脂肪线粒体氧化磷酸化。
人群研究显示,增加蛋白质的摄入不仅有助于减重,且对控制腹部脂肪的储存具有长效作用[22-24]。腹部肥胖是代谢综合征最典型的表现,也是脂肪组织功能失调的标志,可导致细胞炎性因子分泌的增加,与甘油三酯的过度蓄积与血糖血脂异常等密切相关[25-27]。同时,在该试验中观察到复合蛋白肽主要降低了脏器周围白色脂肪含量,油红O染色显示,给予复合蛋白肽组动物肝脏脂肪含量明显降低。
综上,通过对实验动物体重变化、血脂变化、肝脏脂肪蓄积及棕色脂肪组织能量代谢相关蛋白表达水平的探究可知,复合蛋白肽可以降低动物体重、脂肪含量和血脂水平,減少肝脏的脂肪蓄积,激活棕色脂肪组织中OXPHOS和UCP1的表达并刺激产热,从而控制高脂诱导大鼠肥胖。
参考文献
[1]Pan XF,Wang L,Pan A. Epidemiology and determinants of obesity in China[J]. Lancet Diabetes Endocrinol,2021,9(6):373-392.
[2]Engin A. The definition and prevalence of obesity and metabolic syndrome[J]. Adv Exp Med Biol,2017(960):1-17.
[3]Martin KA,Mani MV,Mani A. New targets to treat obesity and the metabolic syndrome[J]. Eur J Pharmacol,2015,763(Pt A):64-74.
[4]Maimaiti M,Zhao XY,Jia MH,et al. How we eat determines what we become: opportunities and challenges brought by food delivery industry in a changing world in China[J]. Eur J Clin Nutr,2018,72(9):1282-1286.
[5]Baer DJ,Stote KS,Paul DR,et al. Whey protein but not soy protein supplementation alters body weight and composition in free-living overweight and obese adults[J]. J Nutr,2011,141(8):1489-1494.
[6]Dong JY,Zhang ZL,Wang PY,et al. Effects of high-protein diets on body weight,glycaemic control,blood lipids and blood pressure in type 2 diabetes: meta-analysis of randomised controlled trials[J]. Br J Nutr,2013,110(5):781-789.
[7]Yu Z,Nan F,Wang LY,et al. Effects of high-protein diet on glycemic control,insulin resistance and blood pressure in type 2 diabetes: A systematic review and meta-analysis of randomized controlled trials[J]. Clin Nutr,2020,39(6):1724-1734.
[8]趙冬,时艺珊,赵飒. 高蛋白饮食对中青年肥胖2型糖尿病患者脑肠肽及胰岛β细胞功能的影响[J]. 四川医学,2021,42(4):400-404.
[9]Yilmaz SK,Eskici G,Mertoglu C,et al. Effect of different protein diets on weight loss,inflammatory markers,and cardiometabolic risk factors in obese women[J]. J Res Med Sci,2021(26):28.
[10]Freudenberg A,Petzke KJ,Klaus S. Comparison of high-protein diets and leucine supplementation in the prevention of metabolic syndrome and related disorders in mice[J]. J Nutr Biochem,2012,23(11):1524-1530.
[11]Gardner CD,Kiazand A,Alhassan S,et al.Comparison of the Atkins,Zone,Ornish,and LEARN diets for change in weight and related risk factors among overweight premenopausal women: The A TO Z weight loss study: A randomized trial[J]. JAMA,2007,297(9):969-977.
[12]Wycherley TP,Moran LJ,Clifton PM,et al. Effects of energy-restricted high-protein,low-fat compared with standard-protein,low-fat diets: a meta-analysis of randomized controlled trials[J]. Am J Clin Nutr,2012,96(6):1281-1298.
[13]Skov AR,Toubro S,Ronn B,et al. Randomized trial on protein vs carbohydrate in ad libitum fat reduced diet for the treatment of obesity[J]. Int J Obesity,1999,23(5):528-536.
[14]Belza A,Ritz C,Sorensen MQ,et al. Contribution of gastroenteropancreatic appetite hormones to protein-induced satiety[J]. Am J Clin Nutr,2013,97(5):980-989.
[15]Moon J,Koh G. Clinical evidence and mechanisms of high-protein diet-induced weight loss[J]. J Obes Metab Syndr,2020,29(3):166-173.
[16]Westerterp-Plantenga MS. Protein intake and energy balance[J]. Regul Pept,2008,149(1-3):67-69.
[17]Song G,Kim HL,Jung Y,et al. Fruit of Hovenia dulcis thunb. Induces nonshivering thermogenesis through mitochondrial biogenesis and activation by SIRT1 in high-fat diet-fed obese mice and primary cultured brown adipocytes[J]. J Agr Food Chem,2020,68(24):6715-6725.
[18]Sparks LM,Xie H,Koza RA,et al. A high-fat diet coordinately downregulates genes required for mitochondrial oxidative phosphorylation in skeletal muscle[J]. Diabetes,2005,54(7):1926-1933.
[19]Yi HS,Chang JY,Shong M. The mitochondrial unfolded protein response and mitohormesis: a perspective on metabolic diseases[J]. J Mol Endocrinol,2018,61(3):91-105.
[20]袁慧琦,侯少貞. 影响棕色脂肪组织产热活性因素的研究进展[J]. 动物医学进展,2016,37(10):98-103.
[21]Marlatt KL,Ravussin E. Brown adipose tissue: An update on recent findings[J]. Curr Obes Rep,2017,6(4):389-396.
[22]Weigle DS,Breen PA,Matthys CC,et al. A high-protein diet induces sustained reductions in appetite,ad libitum caloric intake,and body weight despite compensatory changes in diurnal plasma leptin and ghrelin concentrations[J]. Am J Clin Nutr,2005,82(1):41-48.
[23]Westerterp-Plantenga MS,Nieuwenhuizen A,Tome D,et al. Dietary protein,weight loss,and weight maintenance[J]. Annu Rev Nutr,2009(29):21-41.
[24]Campos-Nonato I,Hernandez L,Barquera S. Effect of a high-protein diet versus standard-protein diet on weight loss and biomarkers of etabolic syndrome: A randomized clinical trial[J]. Obes Facts,2017,10(3):238-251.
[25]Despres JP,Lemieux I. Abdominal obesity and metabolic syndrome[J]. Nature,2006,444(7121):881-887.
[26]Smith U. Abdominal obesity: a marker of ectopic fat accumulation[J]. J Clin Invest,2015,125(5):1790-1792.
[27]Despres JP,Lemieux I,Bergeron J,et al. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk[J]. Arterioscler Thromb Vasc Biol,2008,28(6):1039-1049.
Abstract:ObjectiveTo study the effect of complex protein peptide on glucolipid metabolism in obese rats induced by high fat diet. MethodMale SD rats were randomly divided into obesity model group and control group. Obesity model group was fed with high-fat diet for 4 weeks. Selected obesity-sensitive rats were randomly divided into LPP,MPP and HPP groups,containing 25%,50% and 100% protein peptide complex in feed respectively. The model control group 1 (MC1) was set for LPP and MPP with equal energy,and the model control group 2 (MC2) for HPP. Related index were detected after 4-week intervention with protein peptide complex,including body weight,fat content,liver fat storage and brown fat energy metabolism related proteins. ResultProtein peptide complex could significantly reduce the body weight,fat content and lipid level of obese rats,reduce liver lipid droplet density,and increase mitochondrial oxidative phosphorylation (OXPHOS) and uncoupling protein 1 (UCP1) expression levels.ConclusionProtein peptide complex could reduce the visceral fat and white fat of obese rats induced by HFD,which might be related to prompt the OXPHOS and UCP1 expression in brown adipose tissue.
Keywords: protein peptide complex; high-fat diet; obesity; glucolipid metabolism
