大豆苷元靶向MMP12发挥抗口腔鳞状细胞癌的作用
2023-06-09吕红娟张璇李立恒孟媛媛赵亭亭河北北方学院附属第一医院口腔颌面外科河北张家口075000
吕红娟,张璇,李立恒,孟媛媛,赵亭亭 (河北北方学院附属第一医院口腔颌面外科,河北 张家口 075000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是来源于上皮组织的恶性肿瘤,其生长速度缓慢,可发生于口腔不同部位,部分患者会出现反复发作的溃疡和肿块,伴有感染及疼痛等并发症[1-2]。由于部分患者身体状况差不能耐受手术,或经济条件不允许使用比较先进的治疗手段,因此,建立相应的体外模型,筛选有效的治疗药物具有重要临床意义[3-5]。大豆苷元来源于豆科植物的种子,其主要成分为大豆异黄酮类,是一种已经广泛应用于临床各类疾病治疗的药物成分[6-7]。有研究显示,大豆苷元具有良好的心血管保护作用和抗肿瘤活性,已在前列腺癌、乳腺癌治疗等方面取得了较好疗效,其抗肿瘤作用已得到临床认可,为临床肿瘤治疗提供了新的研究方向[8-10]。因此,大豆苷元作为治疗口腔鳞状细胞癌的潜在药物,有望为无法进行手术的患者带来新的希望,但目前有关大豆苷元抗口腔鳞状细胞癌的研究报道较少,其发挥抗口腔鳞状细胞癌的作用机制也尚未阐明。因此,本研究分析了大豆苷元抗口腔鳞状细胞癌的作用机制,旨在为临床综合治疗提供新的方向,现报告如下。
1 材料与方法
1.1 材料、仪器与实验动物
CO2培养箱、全自动酶标仪购自美国Thermo Fisher Scientific公司;人口腔鳞状细胞癌CAL-27和Tca8113细胞均购自上海谷研实业有限公司;大豆苷元购自上海韵泰信息科技有限公司;RPMI 1640培养基、FBS购自武汉益普生物科技有限公司;CCK-8检测试剂盒购自上海经科化学科技有限公司;MTT细胞增殖检测试剂盒购自上海抚生实业有限公司;小鼠抗β-actin单克隆抗体、MMP12单克隆抗体均购自英国Abcam公司。SPF级BALC/c裸鼠18只,雌雄各半,5~7周龄,体质量约20 g,由河北省实验动物中心提供,许可证号:生产许可SCXK(冀)2018-004。
1.2 大豆苷元靶向MMP12分析
网络药理学分析大豆苷元靶点及其与口腔鳞状细胞癌临床表型的相关性。利用SwissTarget(取Top18)和TargetNet(取pro>0)预测大豆苷元的靶点,二者取并集,得到115个大豆苷元靶点。利用GEO2R分析口腔鳞状细胞癌相关数据集GSE138206和GSE74530中具有表达差异的基因(logFC≥1,P<0.05),三者取交集,选择表达水平最高的基因进一步研究。
下载TCGA_HNSC数据,对口腔鳞状细胞癌的数据进行分析。以MMP12表达水平中位数进行分组,将口腔鳞状细胞癌患者分为MMP12高表达组和MMP12低表达组,进行GSEA分析,以探讨MMP12表达与细胞增殖、迁移和侵袭的关系。
1.3 细胞培养、处理与分组
采用含10%FBS的RPMI 1640培养基培养CAL-27和Tca8113细胞,培养条件:37 ℃、pH 7.0~7.2、5%CO2,隔天换液。取一部分培养的CAL-27和Tca8113细胞,分别加入不同浓度的大豆苷元(CAL-27细胞中大豆苷元浓度为0~200 μmol/L,浓度梯度为50 μmol/L;Tca8113细胞中大豆苷元浓度为0~240 μmol/L,浓度梯度为60 μmol/L),置于37 ℃、pH 7.0~7.2、5%CO2培养箱中培养24 h,观察不同浓度大豆苷元对CAL-27和Tca8113细胞生长的影响。随后,将CAL-27和Tca8113细胞分为对照组(CAL-27和Tca8113细胞均予以等量生理盐水)、大豆苷元组(CAL-27细胞中添加大豆苷元150 μmol/L,Tca8113细胞中添加大豆苷元180 μmol/L)以及大豆苷元+MMP12组(MMP12过表达CAL-27细胞中添加大豆苷元150 μmol/L,MMP12过表达Tca8113细胞中添加大豆苷元180 μmol/L)进行后续实验。将携带MMP12编码序列的CAL-27质粒、Tca8113质粒和空白质粒通过脂质体Lipofectamine 2000转染24 h,向细胞中加入10 μg/mL G418进行筛选,以没有转染的MMP12细胞为参照,维持筛选2周,通过Western blot检测验证过表达是否成功。取过表达成功的CAL-27和Tca8113细胞置于37 ℃、pH 7.0~7.2、5%CO2培养箱中培养24 h,取对数生长期细胞用于实验。
1.4 MTT实验检测细胞存活率
取各组对数生长期的CAL-27和Tca8113细胞制备成细胞悬液(2×104/mL),接种于96孔培养板中,每孔加入100 μL,与相应浓度的大豆苷元进行孵育,置于37 ℃、pH 7.0~7.2、5%CO2培养箱中培养24 h。每孔加入5 mg/mL的MTT溶液10 μL,继续培养4 h,检测450 nm波长处各孔的吸光度值。
1.5 CCK-8法检测细胞增殖情况
取各组对数生长期的CAL-27和Tca8113细胞(2×103/mL)接种于96孔培养板中,与相应浓度的大豆苷元进行孵育,于37 ℃、pH 7.0~7.2、5%CO2培养箱中进行预培养,每孔加入10 μL的CCK-8溶液,继续培养4 h,检测450 nm波长处各孔的吸光度值。连续培养5 d后,绘制细胞增殖曲线。
1.6 克隆形成实验检测细胞生长情况
将各组对数生长期CAL-27和Tca8113细胞(2×103/mL)接种于96孔培养板中,与相应浓度的大豆苷元进行孵育,于37 ℃、5%CO2培养箱中培养24 h,待约90%单个克隆细胞数达50个后,采用多聚甲醛(质量分数4%)室温固定10 min,1%结晶紫染色5 min,显微镜下观察每孔内细胞克隆数目,计算克隆细胞数。
1.7 Transwell检测细胞侵袭和迁移
收集各组CAL-27和Tca8113细胞,以无血清RPMI 1640培养基稀释至5×105/mL,于上室(无Matrigel基质胶)中添加100 μL,下室加入500 μL含10%FBS的RPMI 1640培养基,24 h后以无菌棉签去除多余细胞,质量分数为4%多聚甲醛固定15 min,0.1%结晶紫染色15 min,显微镜观察并记录迁移的细胞数。检测细胞侵袭能力时,采用100 μL Matrigel基质胶与500 μL无血清培养基充分混合,吸取50 μL于上室恒温37 ℃静置4 h,其余步骤同上。
1.8 裸鼠移植瘤实验
SPF条件下,裸鼠皮下注射人口腔鳞状细胞癌CAL-27细胞株(8×106/mL)0.2 mL构建人口腔鳞状细胞癌裸鼠皮下移植瘤模型,移植瘤在接种60 d内体积达800 mm3并进行传代视为建模成功。根据是否注射大豆苷元进行分组,daidzein组(n=9)每隔1 d注射大豆苷元1次,每次100 mg/kg,control组(n=9)注射等量生理盐水,接种后每隔2 d观察移植瘤体积,共观察14 d。然后处死全部裸鼠,小心剥离肿瘤并称重。用卡尺测量瘤体长短径,计算瘤体体积,瘤体体积=长×宽2/2。
1.9 免疫组化法检测移植瘤组织中Ki67蛋白表达
取daidzein组和control组裸鼠移植瘤组织,常规固定,制作切片,采用链霉亲和素-生物素-过氧化物酶复合物试剂盒检测移植瘤组织中Ki67蛋白表达。对移植瘤组织进行免疫组化染色,然后将载玻片冲洗、脱水,显微镜下观察并计数由黄色变为棕色的免疫反应细胞,每张切片观察10个视野,统计Ki67染色呈阳性的细胞数量,计算阳性细胞率。阳性细胞率(%)=阳性细胞数目/总细胞计数×100%。
1.10 Western blot检测MMP12蛋白表达
收集各组细胞,弃培养液,采用细胞裂解液裂解,提取总蛋白,严格按照操作说明进行。采用BCA法进行蛋白定量,取50 ng蛋白进行SDS-PAGE凝胶电泳,转膜,室温封闭2 h,采用洗膜缓冲液洗膜并加MMP12一抗(1:1 000),4 ℃孵育过夜,洗膜加二抗(1:10 000),室温孵育2 h。电化学发光显影,用凝胶图象处理系统分析对比条带强弱,选用β-actin作为内参。
1.11 统计学处理
采用SPSS 21.0软件进行数据分析,符合正态分布且方差齐的计量资料以均数±标准差()表示,重复测量方差分析不同时间对照组、大豆苷元组和大豆苷元组+MMP12组细胞活性和MMP12表达间的差异;Mann-Whitney检验比较daidzein组和control组克隆细胞数、Ki67蛋白表达的差异;采用单因素方差分析比较对照组、大豆苷元组和大豆苷元+MMP12组的MMP12表达水平、细胞活性、克隆细胞数、迁移和侵袭间的差异,以P<0.05表示差异有统计学意义。
2 结果
2.1 MMP12与口腔鳞状细胞癌临床病理特征的关系
GEO2R分析显示,MMP12在口腔鳞状细胞癌中表达(P<0.05),且MMP12表达与淋巴结转移相关(P<0.05)。GSEA分析表明,与细胞增殖、迁移和侵袭相关的基因集均富集在MMP12高表达组,即MMP12可能促进口腔鳞状细胞癌的增殖、迁移和侵袭,见图1。
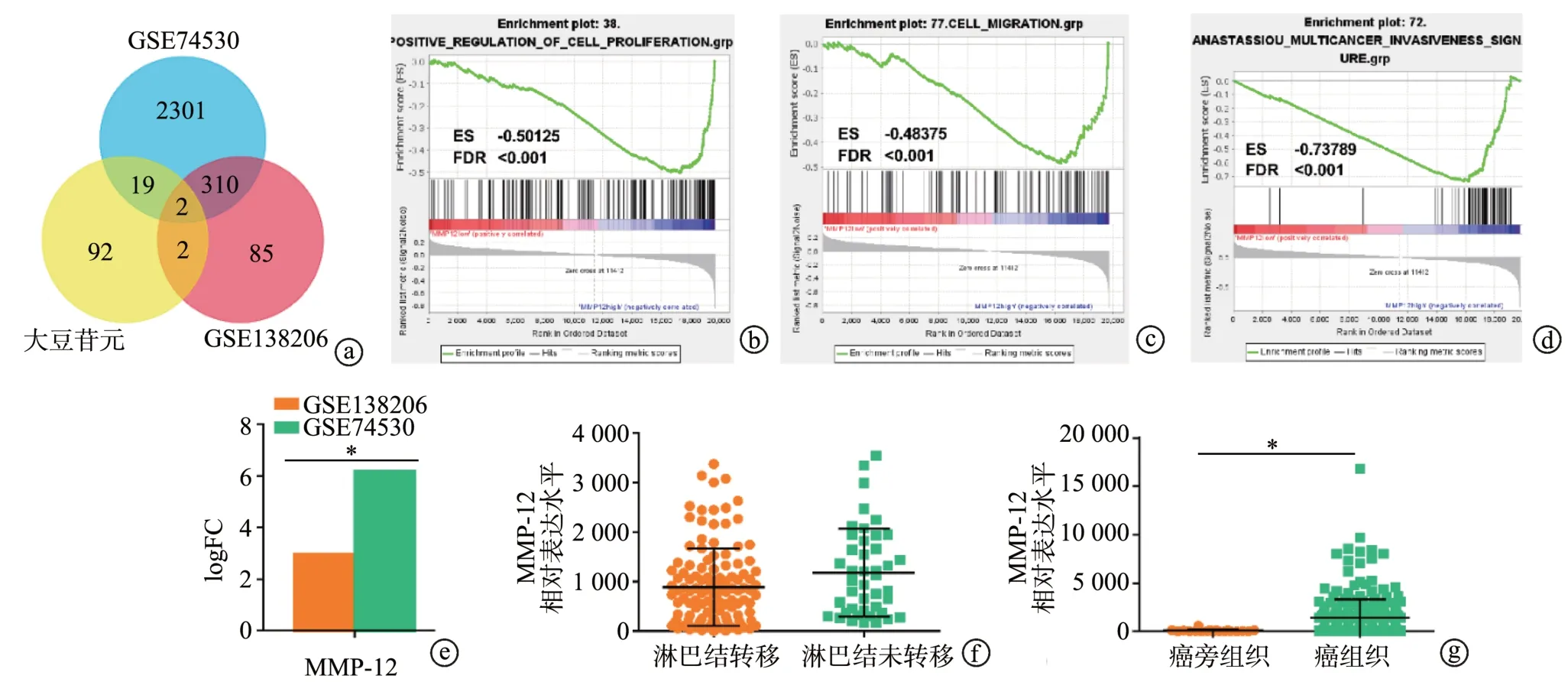
图1 MMP12与口腔鳞状细胞癌临床病理特征的关系
2.2 大豆苷元体外抑制口腔鳞状细胞癌细胞增殖、侵袭和迁移
MTT实验显示,大豆苷元浓度越高,CAL-27和Tca8113细胞存活率越低(P<0.05),当CAL-27和Tca8113细胞中大豆苷元浓度分别为150 μmol/L和180 μmol/L时,细胞存活率降低至约50%。CCK-8实验结果显示,随着大豆苷元作用时间的延长,CAL-27和Tca8113的细胞活性较对照组明显下降(P<0.05)。克隆形成实验显示,大豆苷元作用后,CAL-27和Tca8113克隆细胞数较对照组明显减少(P<0.05)。Transwell实验显示,大豆苷元组发生侵袭和迁移的CAL-27和Tca8113细胞数较对照组明显减少(P<0.05),见图2。
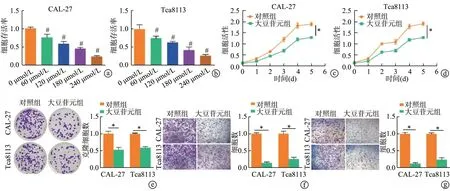
图2 大豆苷元体外抑制口腔鳞状细胞癌细胞增殖、侵袭和迁移
2.3 大豆苷元体内抑制口腔鳞状细胞癌细胞增殖
裸鼠移植瘤实验显示,随着时间延长,daidzein组和control组肿瘤体积均明显增加(P<0.05),但daidzein组的肿瘤体积和质量均明显小于control组(P<0.05)。免疫组化结果显示,daidzein组的移植瘤组织中Ki67蛋白表达水平明显低于control组(P<0.05),见图3。
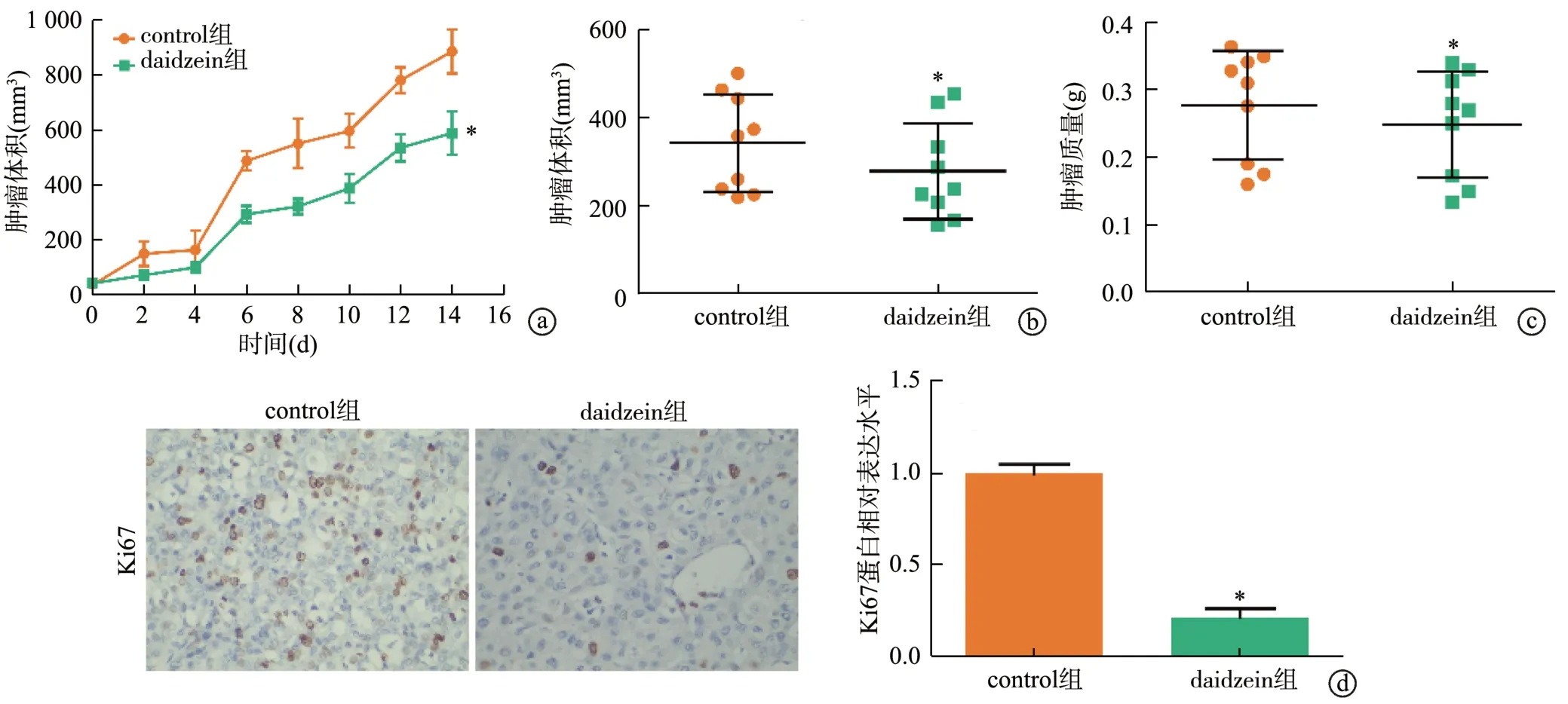
图3 大豆苷元体内抑制口腔鳞状细胞癌细胞增殖
2.4 大豆苷元抑制MMP12表达的浓度依赖和时间依赖
Western blot显示,大豆苷元能够抑制CAL-27和Tca8113细胞中MMP12的表达,且随着作用时间延长和浓度升高,该抑制作用会更明显(P<0.05),见图4。
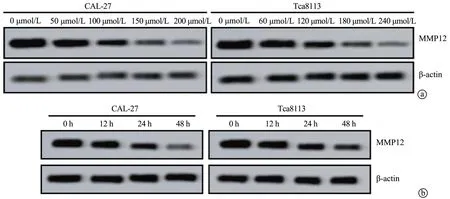
图4 大豆苷元抑制MMP12表达的浓度依赖和时间依赖
2.5 大豆苷元通过MMP12抑制口腔鳞状细胞癌细胞增殖、迁移和侵袭
与对照组相比,大豆苷元组CAL-27和Tca8113细胞中MMP12蛋白表达水平、细胞活性、克隆细胞数、细胞迁移数和侵袭数均明显降低/减少(P<0.05);与大豆苷元组比较,大豆苷元+MMP12组中MMP12表达水平、细胞活性、克隆细胞数、细胞迁移数和侵袭数明显升高/增加(P<0.05),见图5。

图5 大豆苷元通过MMP12抑制口腔鳞状细胞癌细胞增殖、迁移和侵袭
3 讨论
口腔鳞状细胞癌是头颈部恶性程度极高、危害性极大的肿瘤。口腔鳞状细胞癌的发生发展与患者生活方式密切相关,并容易出现远处转移,对患者生活质量甚至生命安全有巨大影响[11-13]。CAL-27和Tca8113细胞株传代数较多且容易培养,是基础研究常用的细胞株,本研究以CAL-27和Tca8113细胞株为研究对象,分析大豆苷元抗口腔鳞状细胞癌的作用机制。
大豆苷元具有良好的抗肿瘤活性,可以抑制肿瘤细胞增殖,促进其凋亡,提高机体免疫力[14]。为了阐明大豆苷元的可能作用机制,本研究通过数据库对大豆苷元的可能作用靶点进行初步分析,结果显示MMP12为大豆苷元靶点之一,并且其表达水平与口腔鳞状细胞癌细胞增殖、迁移和侵袭密切相关,提示大豆苷元可能通过靶向MMP12抑制肿瘤的生长、迁移和侵袭。本研究结果显示,随着大豆苷元浓度升高,作用时间延长,口腔鳞状细胞癌细胞存活率明显降低,细胞克隆数、侵袭和迁移数也明显减少,说明大豆苷元可以有效抑制口腔鳞状细胞癌增殖、迁移和侵袭等恶性生物学行为,并且该抑制效果与大豆苷元的作用时间和浓度有关。研究表明,大豆苷元的抗肿瘤作用机制主要体现在抑制肿瘤增殖,其通过抑制血管增生并诱导肿瘤细胞凋亡来抑制肿瘤生长;同时,大豆苷元可以激活过氧化物酶体增殖物激活受体γ,从而抑制肿瘤细胞迁移[15-16]。本研究结果与上述研究基本一致,说明大豆苷元在抑制口腔鳞状细胞癌恶性增殖、转移和侵袭方面具有良好作用。
Ki67是一种与细胞增殖有关的蛋白,可反映肿瘤生长情况,其阳性表达率还可以用来判断肿瘤的侵袭情况,阳性表达率越高说明肿瘤的恶性程度越强[17-18]。本研究中裸鼠移植瘤实验结果显示,daidzein组的移植瘤体积、质量以及移植瘤组织中Ki67蛋白表达水平均明显小/低于control组,说明大豆苷元干预后Ki67蛋白表达水平明显下降,提示大豆苷元在抑制口腔鳞状细胞癌恶性增殖方面具有一定作用,且这种作用并不仅局限于体外培养细胞,在动物实验中也初见成效,进一步推动了大豆苷元的临床应用进程。
MMP12主要由炎症细胞主动分泌,具有分解细胞外基质和血管壁的作用,因而利于肿瘤细胞转移与侵袭,其在正常细胞中少量表达甚至不表达,而在多种肿瘤细胞中高表达[19]。本研究初步明确了大豆苷元对口腔鳞状细胞癌恶性增殖、迁移和侵袭等行为具有抑制作用后,进一步探讨了其对作用靶点MMP12的影响,结果显示,随着大豆苷元作用时间延长或浓度升高,口腔鳞状细胞癌中MMP12的表达水平明显下降,说明大豆苷元对MMP12的抑制作用具有时间依赖性和浓度依赖性;当MMP12过表达时,大豆苷元的抗肿瘤活性被逆转,说明大豆苷元是通过作用于MMP12靶点,下调MMP12表达水平,从而发挥对口腔鳞状细胞癌恶性增殖、转移和侵袭的抑制作用,提示临床可以通过抑制MMP12表达发挥良好的抗肿瘤作用。
综上所述,大豆苷元可能通过靶向MMP12,下调口腔鳞状细胞癌细胞中MMP12的表达水平,从而抑制肿瘤细胞的增殖,阻止其转移与侵袭,进而发挥抗口腔鳞状细胞癌的作用。
