基于体外酪氨酸酶抑制活性的枇杷花醇提纯化工艺优化及活性成分初步鉴定
2023-06-09陈倩倩陶文扬郑美瑜马子甲陆胜民
陈倩倩,陶文扬,郑美瑜,马子甲,王 璐,陆胜民,*
(1.浙江师范大学 生命科学学院,浙江 金华 321000; 2.浙江省农业科学院 食品科学研究所,浙江省果蔬保鲜与加工技术研究重点实验室,浙江 杭州 310021)
枇杷花是蔷薇科苹果亚属枇杷属植物枇杷[Eriobotryajaponica(Thunb.) Lindl.]的花卉,在我国民间自古就有以枇杷花入药治疗咳疾的记载。自2019年起,枇杷花被国家卫生健康委员会收录为新食品资源原料[1]。为了提高品质和稳产,每年果农都会对枇杷树进行疏花穗处理,因而产生了大量的枇杷花副产物。已报道的文献显示,枇杷花黄酮和多酚类物质具有抑菌[2]、抗炎[3]、抗氧化清除自由基[4]等功效。但目前为止,有关枇杷花的美白功效、枇杷花提取物对酪氨酸酶抑制效果的报道并不多见[5]。
黑色素的过度表达会导致色素沉积而产生色素斑,严重者更是会出现黑色素肿瘤[6]。黑色素合成是一个涉及多重反应的复杂过程,主要涉及酪氨酸酶基因家族的3种酶,包括TYR、TYR-1和TYR-2。其中酪氨酸酶(TYR,EC 1.14.18.1)参与L-酪氨酸(L-Tyr)和左旋多巴(L-DOPA)的氧化过程,L-Tyr被酪氨酸酶催化成L-DOPA,然后进一步催化生成多巴醌[7],而多巴醌再经过一系列反应生成黑色素。酪氨酸酶催化反应被认为是黑色素合成的限速步骤,因而酪氨酸酶可视为黑色素合成的限速酶[8]。目前酪氨酸酶抑制剂主要有曲酸、熊果苷等,但是曲酸可能会致敏,熊果苷可能会引起细胞毒性[9-10],所以找寻一种新的酪氨酸酶抑制剂十分必要。目前,从紫苏[11]中发现芹菜素-7-O-二葡萄糖苷酸、木犀草素-7-O-葡萄糖醛酸苷、黄芩苷和7-羟基香豆素;从千日红[12]中发现香草酸、麦黄酮、对羟基肉桂酸和对甲氧基肉桂酸;还从多种植物中发现槲皮素、异李鼠素、圣草酚、香豆酸和阿魏酸等[13-20]具有抑制酪氨酸酶活性的物质。本实验以酪氨酸酶抑制率为指标,提取纯化枇杷花中的酪氨酸酶抑制成分并鉴定出主要组分,为从天然提取物中寻找新型天然黑色素抑制剂提供新的思路和途径,为枇杷花的研究和利用奠定基础。
1 材料与方法
1.1 仪器
DHG-9070A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;MJ-PB80Easy218搅拌机,广东美的生活电器制造有限公司;AR224 CN型电子分析天平,奥豪斯仪器(上海)有限公司;LXJ-IIB低速离心机,上海安亭科学仪器厂;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;Tecan Spark 多功能酶标仪,广州深华公司;Thermo Vanquish UHPLC 高效液相色谱仪、Q-Exactive HF 高分辨质谱仪,赛默飞世尔科技(中国)有限公司;Zorbax Eclipse C18 色谱柱,安捷伦科技(中国)有限公司。
1.2 材料与试剂
枇杷鲜花穗由宁波美栖生物科技有限公司提供,鲜花在40 ℃条件下热风烘干至含水量5.41%,粉碎过50目筛,密封避光保存备用。
磷酸二氢钾、磷酸氢二钾、二甲基亚砜(DMSO)(均为分析纯),购自上海麦克林生化科技有限公司;酪氨酸酶(500 U·mg-1),购自合肥博美生物科技有限责任公司;左旋多巴(L-DOPA),上海源叶生物科技有限公司;D101大孔树脂,上海麦克林生化科技有限公司;甲醇、乙腈(均为HPLC-MS级),购自德国默克集团(Merck KgaA);甲酸(HPLC-MS级),购自西亚化学科技(山东)有限公司。
1.3 体外酪氨酸酶抑制率测定方法
参考Mahdavi等[21]的方法并在其基础上进行适当修改。按表1进行分组,在96孔板内加入相应试剂混匀,37 ℃孵育9 min,加入100 μL L-DOPA (0.2 mg·mL-1) 37 ℃反应15 min,于475 nm处测D值,设置3组平行。根据测定结果计算酪氨酸酶抑制率。
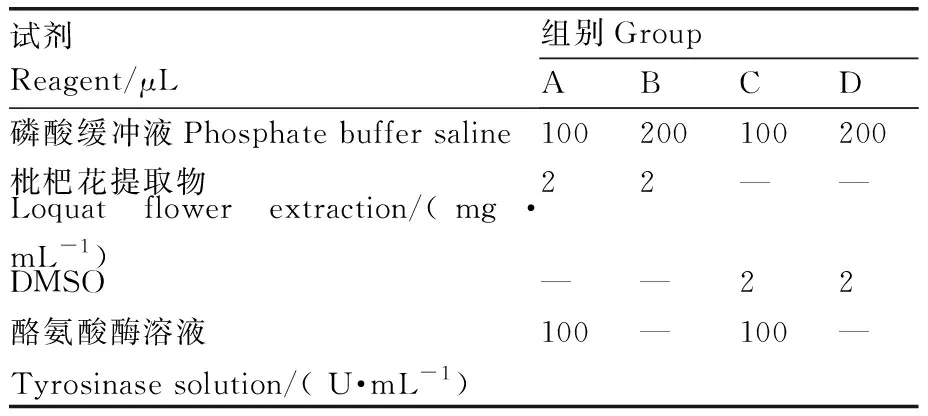
表1 反应体系Table 1 Reaction system
1.4 单因素实验设计
1.4.1 浸提时间对提取物体外酪氨酸酶活性抑制率的影响
称取枇杷花干粉5.0 g,设定料液比(m∶V)为1∶20,提取次数1次,乙醇体积分数50%,浸提温度50 ℃,搅拌转速500 r·min-1,浸提时间分别为0.5、1.0、1.5、2.0、2.5 h的条件下,考察浸提时间对提取物体外酪氨酸酶活性抑制率的影响。
1.4.2 乙醇浓度对体外酪氨酸酶活性抑制率的影响
称取枇杷花原料5.0 g,设定料液比(m∶V)1∶20,浸提温度50 ℃,浸提时间0.5 h,提取次数1次,搅拌转速500 r·min-1,乙醇体积分数分别为10%、30%、50%、70%、90%的条件下,考察乙醇浓度对提取物体外酪氨酸酶活性抑制率的影响。
1.4.3 温度对体外酪氨酸酶活性抑制率的影响
称取枇杷花原料5.0 g,设定提取时间0.5 h,料液比(m∶V)1∶20,提取次数1次,乙醇体积分数50%,搅拌转速500 r·min-1,浸提温度分别为20、40、50、60、80 ℃的条件下,考察浸提温度对提取物体外酪氨酸酶活性抑制率的影响。
1.4.4 浸提次数对体外酪氨酸酶活性抑制率的影响
称取枇杷花原料5.0 g,设定料液比(m∶V)1∶20,乙醇体积分数50%,浸提温度50 ℃,浸提时间0.5 h,搅拌转速500 r·min-1,浸提次数分别为1、2、3、4、5次的条件下,考察提取次数对提取物体外酪氨酸酶活性抑制率的影响。
1.5 正交试验优化提取工艺参数
在单因素实验的基础上,采用四因素三水平正交实验,以体外酪氨酸酶活性抑制率为指标,优化枇杷花醇提物的提取工艺,实验因素及水平见表2。
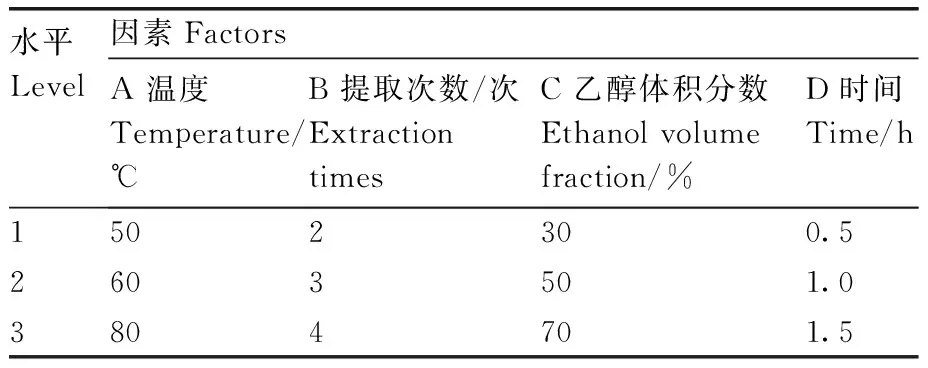
表2 基于体外酪氨酸酶活性抑制率的枇杷花提取工艺优化的正交试验因素及水平Table 2 Orthogonal test factors and levels of loquat flower extraction process optimization based on in vitro tyrosinase inhibition rate
最优提取条件下的枇杷花粗提物冷冻干燥,用于后续实验。
1.6 D101大孔树脂静态纯化工艺优化
1.6.1 大孔树脂预处理
将D101型大孔树脂用蒸馏水冲洗除去劣质树脂,置于95%乙醇中,浸泡24 h使其充分溶胀后用蒸馏水冲洗至无醇味;再将大孔树脂置于5%盐酸中浸泡12 h,用蒸馏水冲洗至中性;最后将大孔树脂用5%的氢氧化钠浸泡12 h,用蒸馏水洗至中性,备用[22]。
1.6.2 大孔树脂吸附平衡时间的确定
准确称取预处理好的大孔树脂1.0 g,置于25 mL的锥形瓶中,加入40 mg·mL-1的枇杷花粗提物水溶液15 mL,在转速160 r·min-1、25 ℃条件下,摇床振荡12 h,每隔1.0 h 取样一次,获得上清液,测定样品对酪氨酸酶活性的抑制率,并计算出不同吸附时间下大孔树脂对酪氨酸酶具有抑制活性物质的吸附率Q。计算公式见式(1):
(1)
式(1)中:C0为枇杷花粗提物对酪氨酸酶活性的抑制率;Ce为上清液对酪氨酸酶活性的抑制率。
1.6.3 大孔树脂解析时间的确定
将吸附饱和的D101大孔树脂重新置入25 mL容量瓶中,加入60%乙醇水溶液10 mL,在转速130 r·min-1、25 ℃条件下,摇床振荡4.5 h,每隔0.5 h 取样一次,获得解析液,测定样品对酪氨酸酶活性的抑制率,并计算出不同解析时间下大孔树脂对酪氨酸酶具有抑制活性物质的解析率D。计算公式见式(2)。
(2)
式(2)中:C0、Ce与式(1)相同;C1为解析液对酪氨酸酶的抑制率。
1.7 D101大孔树脂对动态纯化工艺优化
1.7.1 上样浓度对吸附的影响
采用湿法装柱,称取适量大孔树脂进行装柱,测量出柱体积(BV)为20 mL。配制不同浓度(25、30、40、50 mg·mL-1)的枇杷花粗提物水溶液为上样溶液,上样流速为3.0 BV·h-1,以1.0 BV·h-1收集一次,按1.3节的方法计算收集液对体外酪氨酸酶活性的抑制率。参考王亚楠[11]的方法,当流出液对酪氨酸酶活性的抑制率大于50%时,则认为到达了泄漏点,此时停止上样。记录泄漏点,确定不同上样浓度对大孔树脂动态吸附酪氨酸酶活性抑制成分效果的影响。
1.7.2 上样流速对吸附的影响
采用湿法装柱,称取适量大孔树脂(湿重)进行装柱,测量出柱体积为20 mL。选择质量浓度为40 mg·mL-1的枇杷花粗提物水溶液作为上样液,分别以2、3、4、5 BV·h-1流速进行上样,1 BV·h-1收集一次,按照1.3节的方法测定收集液对体外酪氨酸酶活性的抑制率,达到泄漏点时停止上样。确定不同上样流速对大孔树脂动态吸附酪氨酸酶活性抑制成分效果的影响。
1.7.3 洗脱剂浓度对解析的影响
将吸附饱和的树脂用蒸馏水冲洗去除杂质,然后分别用不同体积分数(40%、50%、60%、70%)的乙醇溶液进行洗脱,洗脱速度设定为4.0 BV·h-1,0.5 BV·h-1收集一次,按1.3节的方法测定收集液对体外酪氨酸酶活性的抑制率,直至收集液对酪氨酸酶抑制率小于10%时停止洗脱。确定不同乙醇体积分数对大孔树脂中酪氨酸酶活性抑制成分洗脱效果的影响。
1.7.4 洗脱流速对解析的影响
将吸附饱和的树脂用蒸馏水冲洗洗去杂质,用60%的乙醇作为洗脱剂,分别用3、4、5、6 BV·h-1的洗脱流速进行洗脱,0.5 BV·h-1收集一次。按1.3节的方法测定收集液对体外酪氨酸酶活性的抑制率,直至收集液的抑制率小于10%。确定不同洗脱流速对大孔树脂洗脱酪氨酸酶抑制成分效果的影响。
1.8 色谱条件与质谱条件
参考文献[23-24]稍加改进,取最优提取及纯化条件下的枇杷花提取物冷冻干燥,用70%甲醇配制成100 mg·mL-1溶液,进行质谱检测。
色谱柱为Zorbax Eclipse C18色谱柱,柱体积为1.8 μm×2.1 mm×100 mm。色谱分离条件为:柱温30 ℃,流速0.3 mL·min-1,流动相A为0.1%甲酸水溶液,流动相B为纯乙腈,进样量为2.0 μL,自动进样器温度为4 ℃。
质谱条件:离子源温度325 ℃;离子喷雾干燥电压3.5 kV;质量扫描范围为m/z100~1 500。
1.9 统计学分析
2 结果与分析
2.1 单因素实验结果
由图1-A可知,随着浸提时间的延长枇杷花粗提物对酪氨酸酶活性的抑制率先升后降,浸提时间在1.0 h时粗提物对酪氨酸酶活性的抑制率达到峰值,为47.9%。浸提时间影响溶剂与不同细胞位置活性物质的接触程度。随着浸提时间的延长,溶剂将渗透至枇杷花组织细胞的更多部位,从而接触并溶解更多的活性物质,有利于有效成分的提取[12]。但随着浸提时间的进一步延长,细胞内部分其他物质也会一同析出,这将降低酪氨酸酶活性抑制成分的占比,过长受热(50 ℃)也会导致该类活性成分的降解从而使粗提物对酪氨酸酶活性的抑制率降低[2]。
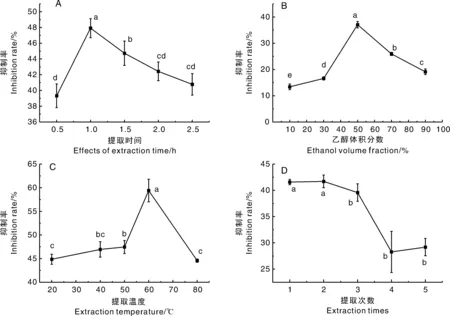
不同处理间没有相同小写字母表示差异显著(P<0.05)。The values with different lowercase letters showed the significant difference (P<0.05).图1 提取时间(A)、乙醇体积分数(B)、提取温度(C)、提取次数(D)对枇杷花粗提物体外酪氨酸酶活性抑制率的影响Fig.1 Effects of extraction time (A), ethanol volume fraction (B), extraction temperature (C), and extraction times (D) on in vitro tyrosinase inhibition rate of loquat flower extracts
由图1-B可知,乙醇体积分数小于50%时,枇杷花粗提物对酪氨酸酶活性的抑制率随乙醇浓度的升高呈上升趋势;乙醇体积分数大于50%后,枇杷花粗提物对酪氨酸酶活性的抑制率出现下降。根据相似相溶的原理,低体积分数乙醇水溶液可以溶解植物中极性较高的成分,如植物细胞的主要成分蛋白质、淀粉等,但这类物质对酪氨酸酶没有抑制作用[12]。因此,适当增加乙醇体积分数有利于具有酪氨酸酶抑制活性物质的浸出[25],而进一步提升乙醇体积分数后,提取物的酪氨酸酶活性抑制率没有随之增加,反而出现下降的情况,说明乙醇体积分数是提取枇杷花中酪氨酸酶抑制活性物质的重要影响因素。
由图1-C可知,随着浸提温度的提高枇杷花粗提物对酪氨酸酶活性的抑制率表现为先升后降,浸提温度在60 ℃时粗提物对酪氨酸酶活性的抑制率达到峰值。温度升高会加快细胞的破裂和有效物质的扩散浸出,而随着温度的进一步升高抑制率出现下降,这可能是有效物质被热分解导致流失[26]。由此可知,浸提温度也是提取枇杷花酪氨酸酶活性抑制物质的重要影响因素。
由图1-D可知,随着提取次数的增加有效物质的提取率反而出现下降,这可能是因为提取次数的增加提高了原料中的可溶性膳食纤维、可溶性蛋白和淀粉等杂质浸出而降低了有效物质的占比[27]。此外,提取次数的增加延长了有效物质与空气的接触时间,这也将导致酪氨酸酶抑制活性物质的氧化,从而导致对该酶抑制效果的减弱[28-29]。
2.2 正交试验结果
由正交试验可知,4个因素对提取物的酪氨酸酶抑制活性影响大小为C>A>D>B,即乙醇体积分数>提取温度>提取时间>提取次数。由k值可知,试验的最优组合为A1B2C2D2,该条件下进行验证实验,其提取物对酪氨酸酶活性的抑制率为65%,高于正交试验表(表3)中最优组合的59.65%,因此最优组合为A1B2C2D2,即温度50 ℃、提取次数3次、乙醇体积分数50%、提取时间1.0 h。在此条件下枇杷花粗提物的得率(得率=粗提物/原料)为30.01%,对酪氨酸酶活性抑制率的IC50值为25 mg·mL-1。
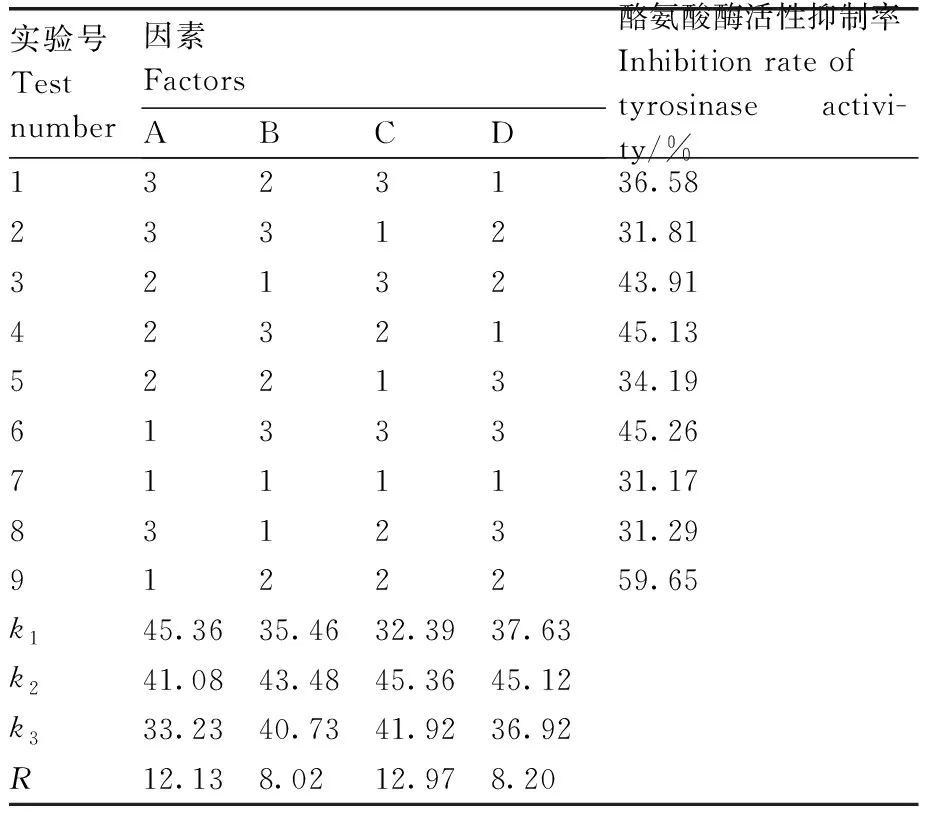
表3 基于体外酪氨酸酶活性抑制率的枇杷花提取工艺优化的正交试验结果Table 3 Orthogonal test results of loquat flower extraction optimization based on in vitro tyrosinase inhibition rate
2.3 分批式吸附-解析实验结果
D101型大孔树脂对枇杷花中具有酪氨酸酶抑制活性物质的吸附平衡时间见图2。由图可知,吸附时间在4.5 h内,随着吸附时间的延长,大孔树脂对枇杷花提取物中具有酪氨酸酶抑制活性物质的吸附率逐渐增大;吸附时间超过4.5 h后,吸附率逐渐趋于稳定。因此,大孔树脂对枇杷花粗提物中酪氨酸酶抑制活性物质的最佳吸附平衡时间选择为4.5 h。
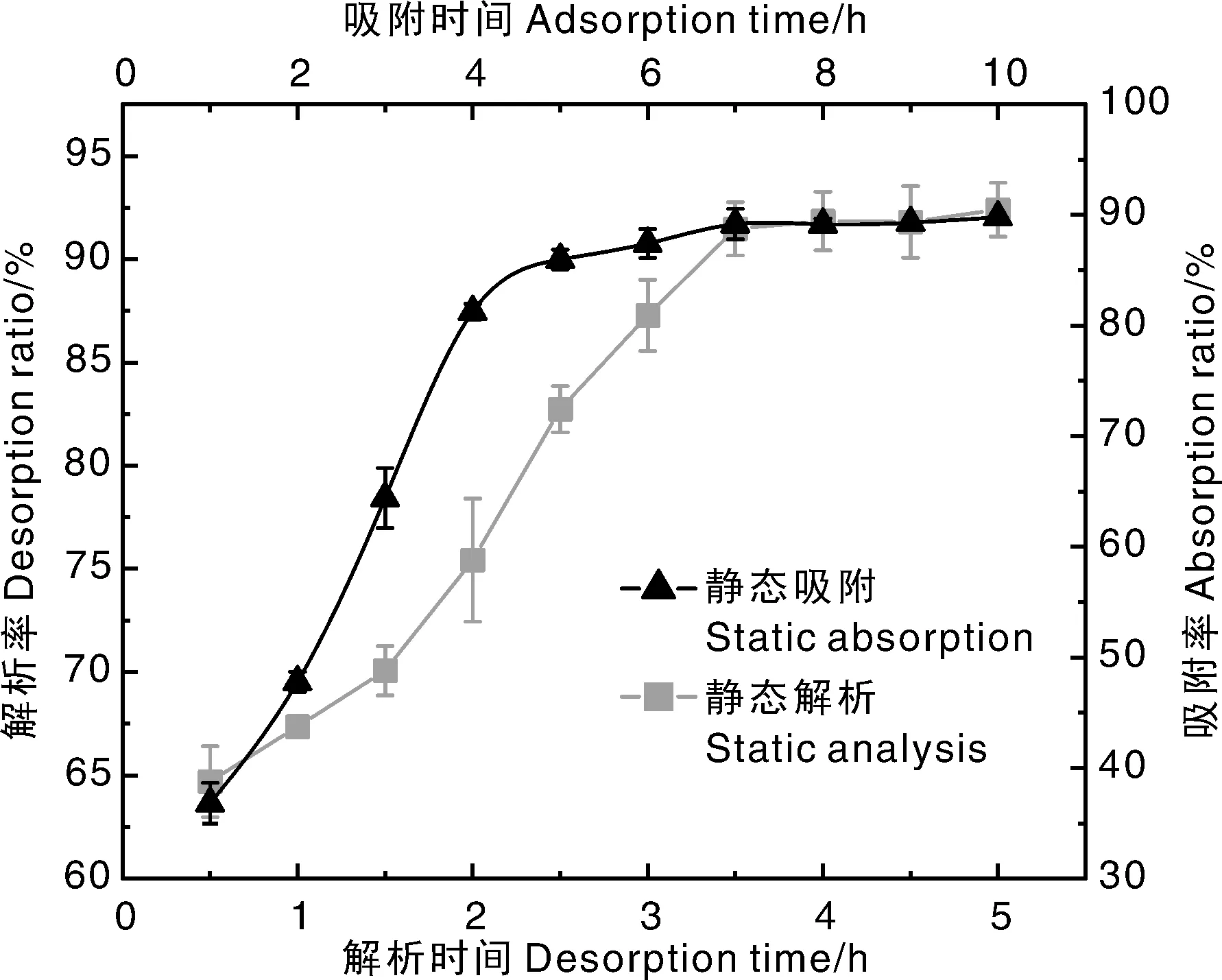
图2 D101型大孔树脂对枇杷花粗提物中具有酪氨酸酶抑制活性物质的分批式吸附-解析动力学曲线Fig.2 Static adsorption-elution kinetic curves of macroporous resin D101 to substances with tyrosinase inhibitory activity in loquat flower ethanol extract
由图2也可知,大孔树脂对枇杷花中具有酪氨酸酶抑制活性物质的解析率随解析时间的延长而增大,在3.5 h之前解析率稳步上升,而当解析时间达到3.5 h后,解析率趋于稳定。因此,大孔树脂对枇杷花粗提物中具有酪氨酸酶抑制活性物质的最佳解析时间选择为3.5 h。
2.4 动态吸附-洗脱实验结果
2.4.1 上样浓度
由表4可知,上样浓度越高,泄漏点出现的时间越早。当上样浓度为50 mg·mL-1时,泄漏点出现在8 BV,这是因为上样浓度过高,样品会堵塞大孔树脂,从而导致有效成分泄露,吸附量减少。而当上样浓度为25 mg·mL-1时,泄漏点出现最晚,树脂对样品中具酪氨酸酶抑制活性物质的吸附量最高,但是用时过长、效率低下。综合考虑选择40 mg·mL-1作为最佳上样浓度。

表4 上样液浓度对D101型大孔树脂动态吸附性能的影响Table 4 Effect of sample solution concentrations on dynamic adsorption performance of macroporous resin D101
2.4.2 上样流速、洗脱剂浓度、洗脱流速对大孔树脂动态纯化酪氨酸酶抑制活性物质的影响
由图3-A可知,上样流速越快泄漏点出现得越早,表现为当上样速度为2、3、4和5 BV·h-1时,泄漏点分别出现在14、14、12和5 BV·h-1。上样过程中,流速过高会导致样液与大孔树脂接触不充分,样品组分来不及被大孔树脂吸附而流出,造成很大程度的浪费[30]。因此,上样流速越低,大孔树脂对样品中有效成分的吸附效果越好。2 BV·h-1和3 BV·h-1泄漏点出现的时间相近,综合考虑选择3 BV·h-1作为最佳上样流速。
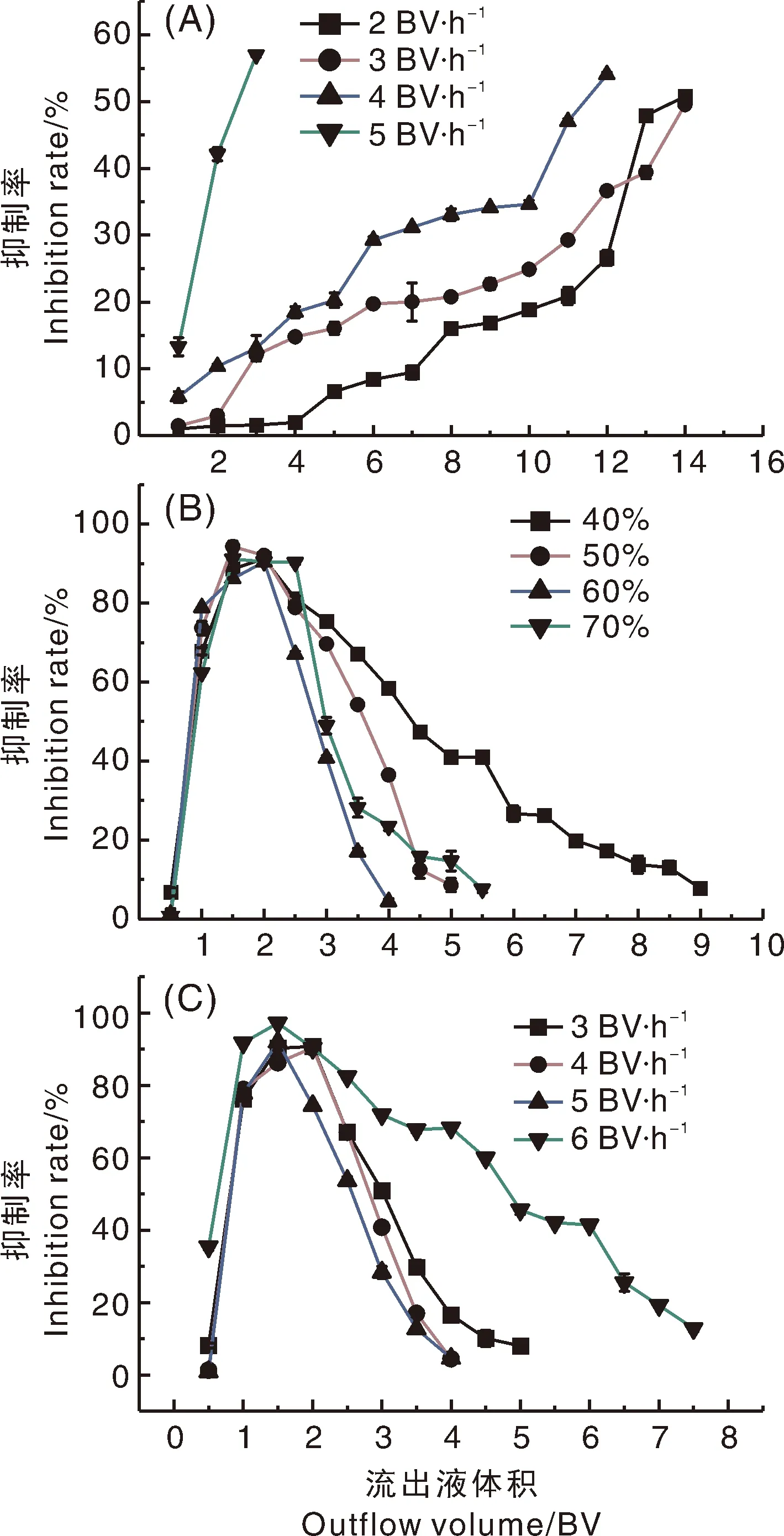
图3 上样流速(A)、乙醇洗脱剂体积分数(B)、洗脱流速(C)对D101型大孔树脂中酪氨酸酶抑制活性物质洗脱效果的影响Fig.3 Effect of sample flow rate (A), ethanol eluent volume fraction (B), and elution velocity (C) on desorption performance of tyrosinase inhibitory substances in macroporous resin D101
由图3-B可知,乙醇洗脱液的体积分数对出峰时间无明显影响。当用40%乙醇溶液洗脱时,峰型最宽且有很严重的拖尾现象,对有效成分的分离效果不理想;50%、60%、70%乙醇溶液洗脱时,峰型相似,但以60%乙醇洗脱的峰型相对更窄。因此,考虑选择60%乙醇作为洗脱溶剂。
选择60%乙醇作为洗脱剂,不同洗脱速度对大孔树脂洗脱有效成分效果的影响结果见图3-C。
在3、4、5、6 BV·h-1洗脱流速下,各组洗脱液中酪氨酸酶抑制活性出峰时间和峰值的最大值相近。其中6 BV·h-1洗脱流速时的峰值最高,但是该条件下峰宽且有拖尾现象,分离效果不好;3、4、5 BV·h-1洗脱流速下的峰面积和最大峰值相似,但5 BV·h-1洗脱流速下的峰面积小于3和4 BV·h-1,可能是大孔树脂吸附的物质大部分被洗脱下来后,由于流速过快洗脱剂不能充分地进入大孔树脂内部洗脱吸附的样品[31]。综合考虑选择4 BV·h-1作为最佳洗脱流速。
因此,D01型大孔树脂对枇杷花粗提物的最优纯化条件为上样浓度40 mg·mL-1、上样流速 3 BV·h-1、60%乙醇体积分数作为洗脱剂、洗脱速度4 BV·h-1。在该条件下纯化物的得率为4.39%,纯化物对酪氨酸酶活性抑制率的IC50值为4 mg·mL-1,未被D101纯化前的粗提物对酪氨酸酶活性抑制率的IC50值为25 mg·mL-1,由数据可知,D101对酪氨酸酶抑制活性物质的收集和纯化还是具有很好的效果。
2.5 枇杷花提取纯化物中酪氨酸酶活性抑制成分的鉴定结果
图4为枇杷花乙醇提取纯化物样本的总离子流(TIC)图。液质联用(HPLC-MS)初步分析发现枇杷花的酪氨酸酶抑制活性提取纯化物中含有黄酮类物质、肉桂酸及其衍生物、苯及其衍生物等26个大类,共鉴定出成分137种。对比中外文献发现,具有酪氨酸酶抑制活性的化合物有12种(表5)。
图4 枇杷花乙醇提取纯化物样本的总离子流(TIC)图Fig.4 Total ion current (TIC) diagram of loquat flower ethanol extraction purified sample
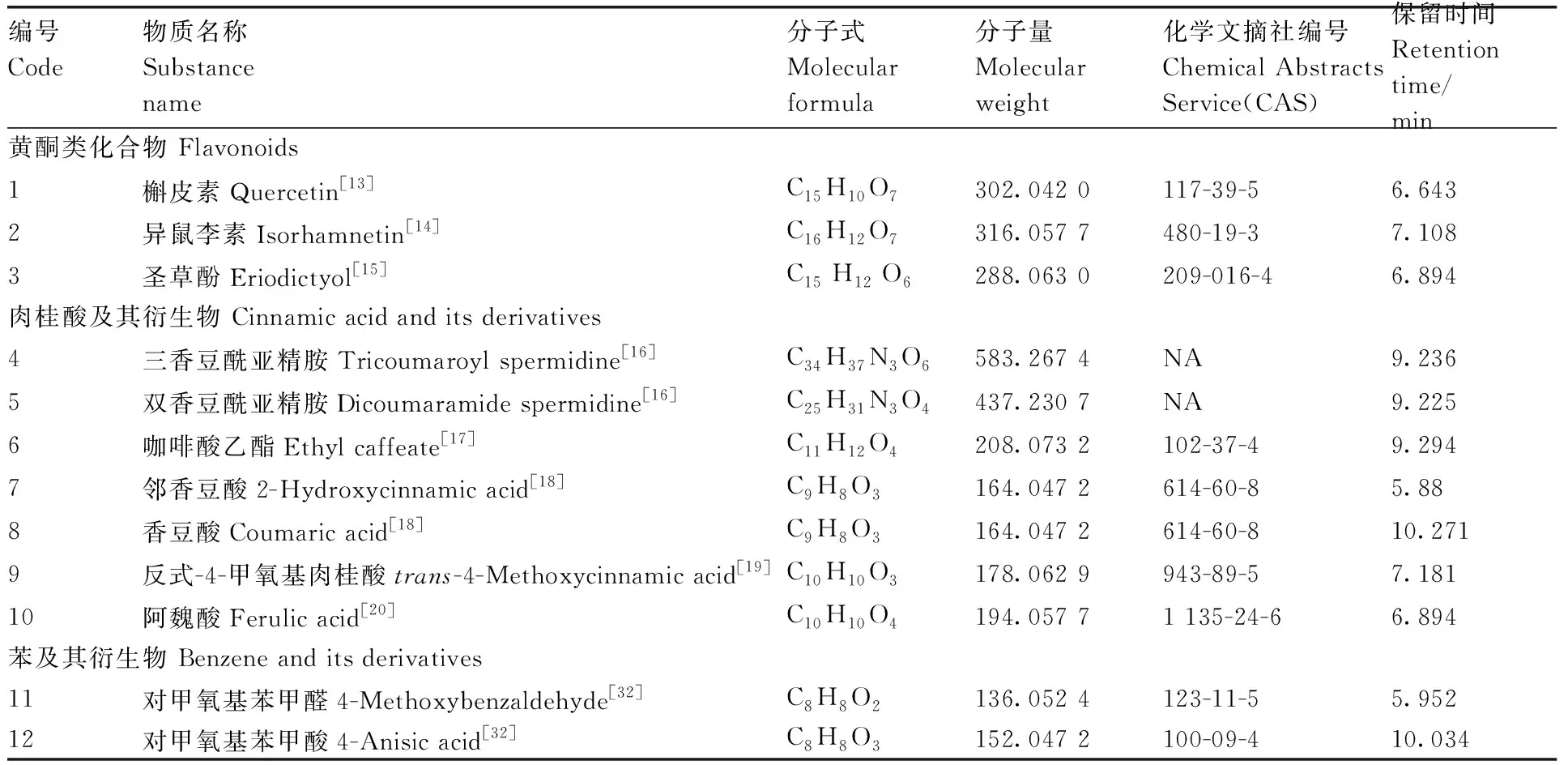
表5 全谱鉴定结果统计表Table 5 Statistical table of full spectrum identification results
3 结论与讨论
以枇杷干花为原料,酪氨酸酶活性抑制率为考察指标,采用单因素结合正交试验,获得枇杷花具酪氨酸酶抑制活性粗提物的最佳提取工艺:在料液比(m∶V)1∶20条件下,提取剂为50%乙醇体积分数,提取温度为50 ℃,提取次数为3次,每次时间为1.0 h。应用D101型大孔树脂纯化枇杷花粗提物时最佳静态吸附平衡时间为4.5 h,静态解析平衡时间为3.5 h;动态吸附-洗脱条件为:上样浓度40 mg·mL-1、上样流速 3 BV·h-1、60%乙醇体积分数作为洗脱剂、洗脱速度4 BV·h-1。在上述条件下粗提物的提取率为30.01%,纯化物的得率为4.39%。液质联用(HPLC-MS)初步分析发现,枇杷花中具有酪氨酸酶抑制活性的物质含有黄酮类、肉桂酸及其衍生物、苯及其衍生物等26个大类,共鉴定出成分137种。对比中外文献发现,其中包含槲皮素、异鼠李素、对香豆酸等12种化合物具有酪氨酸酶抑制活性。本研究为枇杷花的研究和利用提供一种新的方法。
