牛FoxO1基因CDS区克隆及其在脂肪细胞分化过程中的表达分析
2023-06-09宋雅萍雷召雄赵毅昂王兴平罗仍卓么魏大为
宋雅萍,雷召雄,赵毅昂,姜 超,王兴平,2,罗仍卓么,2,马 云,2,魏大为,2,*
(1.宁夏大学 农学院,宁夏 银川 750021; 2.宁夏大学 宁夏反刍动物分子细胞育种重点实验室,宁夏 银川 750021)
牛肉因其胆固醇低、蛋白质高、其氨基酸组成更接近于人体需要等优点而深受广大消费者的喜爱。近年来,随着人们膳食结构的改变和生活水平的提高,牛肉的消费量大幅度提高。然而,与发达国家相比,我国肉牛供不应求、良种率低、优质牛肉紧缺等问题普遍存在,肉牛品种对外依存度高,优质、高档牛肉等也主要依赖于进口(澳大利亚、美国等国)[1]。因此,改良和培育优质肉牛品种是中国肉牛业亟需解决的重要课题。脂肪组织在多种生理途径(能量平衡、机体内分泌和葡萄糖稳态等)中发挥了重要作用,且脂肪组织在牛肉中的分布、比例等与肉质密切相关,如肌内脂肪含量是影响牛肉质量的关键检验指标[2-5]。脂肪的生长发育是通过脂肪细胞的增殖和分化进行的复杂且精细的动态调控,其过程受到许多转录因子的调控及信号通路等的影响。如CCAAT/增强子结合蛋白(CCAAT/enhancer binding protein,C/EBP)家族成员、过氧化物酶体增殖物激活受体-γ(peroxisome proliferators activated receptors,PPARγ)、脂肪酸结合蛋白-4(fatty acid binding protein-4,FABP4)、脂蛋白脂肪酶(lipoprotein lipase,LPL)等均在脂肪细胞分化过程中有重要作用,其中PPARγ和C/EBP是脂肪生成主要的转录因子[6-10]。有关脂肪细胞分化的信号通路有:磷酯酰激醇3-激酶/丝氨酸苏氨酸蛋白激酶(phosphatidylethanol 3-kinase/serine threonine protein kinase, PI3K/AKT)、Wnt信号通路、细胞外信号调节激酶/丝裂原活化蛋白激酶 (extracellular regulated protein kinases/mitogen-activated protein kinase,ERK-MAPK)信号通路、环磷酸腺苷/蛋白激酶A (cyclic adenosine monophosphate/protein kinase A,cAMP/PKA)信号通路和Hedgehog信号通路等[11-12]。
叉头转录因子O1(Forkhead box O1,FoxO1)作为Foxs超家族中FoxO亚家族重要且常见的转录因子之一,参与许多的生理过程,例如糖代谢、细胞凋亡、脂肪代谢、肌细胞的分化、生殖和肿瘤的发生等,影响机体的正常生长和代谢[13-14]。FoxO1在哺乳动物胰岛素反应组织(脂肪、胰腺、肝脏和骨骼肌等)和骨骼中高度表达,其活性受磷酸化、乙酰化和泛素化等转录后修饰的调控,是细胞内稳态的重要调节因子[15-16]。研究表明,FoxO1在脂肪细胞分化信号通路与转录级联反应中具有重要作用[17]。此外,FoxO1还调节脂肪因子的活性或产生,其对白色脂肪组织和棕色脂肪组织的调节具有双重功能[14]。具体而言,FoxO1能通过白色脂肪组织中的能量储存调节能量和营养稳态,且可促进棕色脂肪组织中的能量消耗。研究报道,FoxO1的表达具有时空差异,因而在各组织器官中发挥的作用不同[18-19]。Chen等[19]报道,FoxO1在脂肪细胞分化的细胞周期控制中起主导作用。目前,有关FoxO1基因对脂肪细胞分化影响的研究在人和小鼠等动物中均有涉及,有关牛FoxO1基因的研究近些年也在逐渐增多,如对牛FoxO1基因的组织表达分析、肉质性状关联分析等都有相关研究[20-21],但FoxO1基因对牛脂肪细胞分化中的具体时序表达规律等尚不明晰。
鉴于此,本试验克隆牛FoxO1的编码区序列,利用生物信息学软件和在线工具预测FoxO1的理化性质和功能,进一步采用荧光定量PCR检测了FoxO1在牛脂肪细胞分化中的时序表达规律。以期为探讨牛FoxO1基因的功能及其在脂肪细胞分化中作用机理提供参考信息。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
用于克隆和时序表达分析的脂肪细胞均采自秦川牛皮下脂肪组织(18月龄,n=3),利用无菌器械采集后立刻置于含双抗体积分数为1%的PBS中带回实验室。
1.1.2 主要试验试剂
Trizol、PMD-18T载体、反转录试剂盒和TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)等由TaKaRa公司(大连)提供;DL 4500 DNA Marker、2×TaqPCR Master Mix、胶回收试剂盒(离心柱型)和质粒小提试剂盒(离心柱型)等购自天根生物科技有限公司(北京);琼脂糖Agarose、DH5α感受态细胞等由索莱宝科技有限公司(北京)提供;DMEM/High-Glucose、PBS、青霉素/链霉素抗体(以下简称双抗)和胰酶等购自海克隆生物化学制品有限公司(北京);胎牛血清(FBS)购自赛默飞世尔科技有限公司(中国);罗格列酮、地塞米松和IBMX均购自Sigma公司;无水乙醇、甲醛、氯仿和异丙醇等均为国产分析纯。
1.2 试验方法
1.2.1 总RNA提取和cDNA的合成
参照Trizol RNA提取试剂盒的说明书提取总RNA。选用完整性良好的RNA样品作为模板(以1 μL RNA为模板),按照TaKaRa公司的反转录试剂盒操作说明书合成cDNA,于-20 ℃保存备用。
1.2.2 引物的设计与合成
参照GenBank数据库中公布的序列信息,利用软件Primer 5.0设计引物后交由通用生物技术有限公司(安徽)进行合成。
1.2.3 牛FoxO1基因的克隆
以上述步骤反转录的cDNA为模板进行PCR扩增,反应体系共15 μL,包括Taq酶PCR Master Mix 7.5 μL;ddH2O 5.5 μL;cDNA 1 μL;上、下游引物各0.5 μL。反应条件为:预变性95 ℃ 5 min;变性94 ℃ 30 s,退火70 ℃ 30 s,38个循环;延伸72 ℃ 90 s。用1%的琼脂糖凝胶电泳检测PCR产物,将检验合格的产物用胶回收试剂盒进行纯化后与PMD-18T载体过夜连接,连接产物转化至DH5α感受态细胞后,挑选3~5个阳性克隆,提取质粒,送至杨凌奥科生物技术有限公司进行测序。
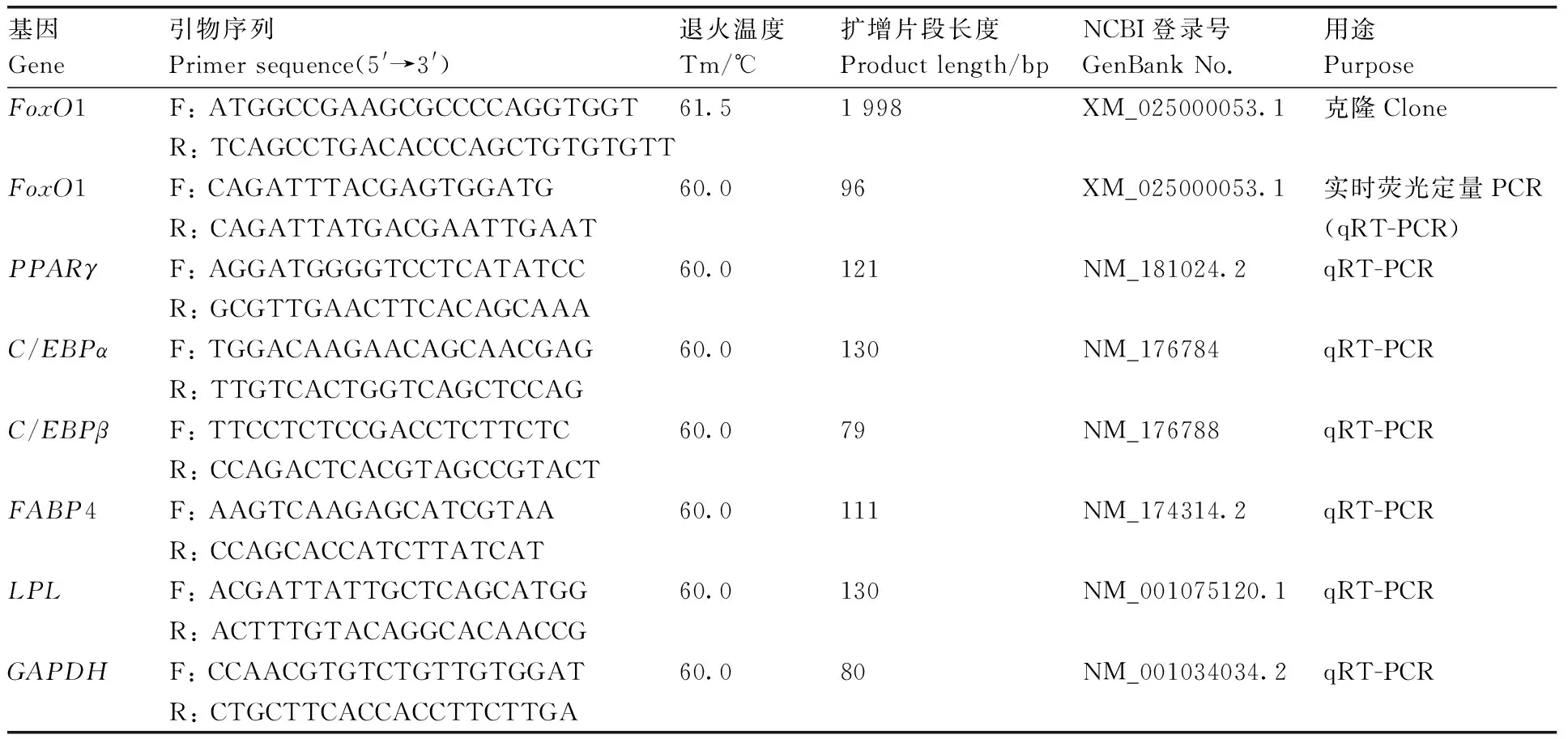
表1 引物信息Table 1 Primer information
1.2.4 牛FoxO1基因的生物信息学分析
牛FoxO1基因的生物信息学分析软件及在线工具见表2。牛FoxO1和其他物种系统进化树序列信息见表3。
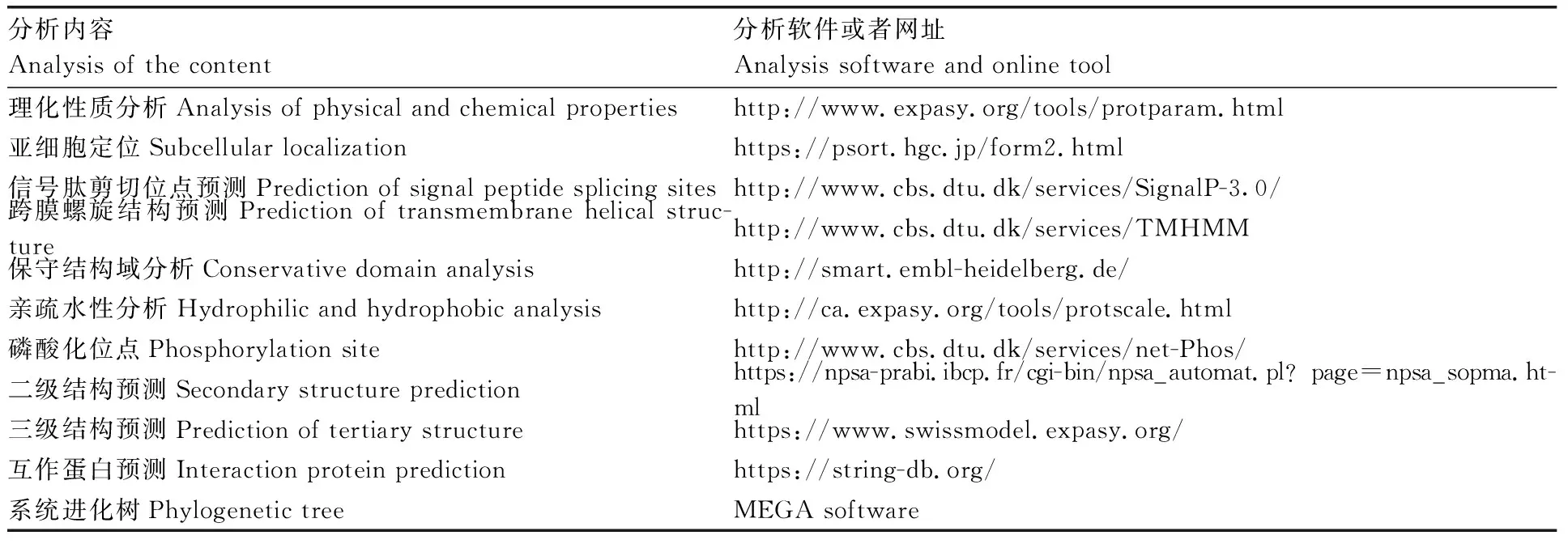
表2 牛FoxO1基因的生物信息学分析软件及在线工具Table 2 Bioinformatics analysis software and online tool of bovine FoxO1 gene
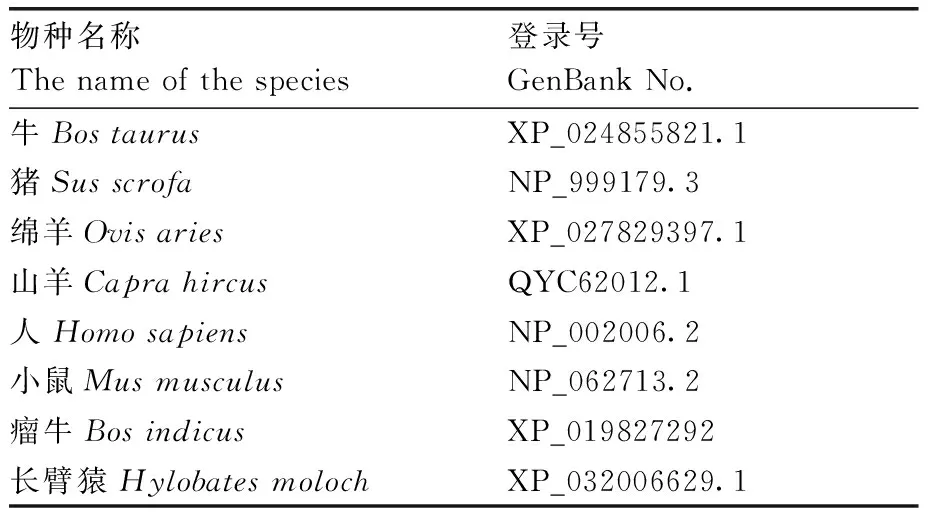
表3 牛FoxO1和其他物种系统进化树序列信息Table 3 Phylogenetic tree sequence information of bovine FoxO1 and other species
1.2.5 牛脂肪细胞分离培养、诱导分化及油红O染色
分离培养:将采集的牛皮下脂肪细胞参考郭红芳等[22]的方法进行分离;分离的脂肪细胞加入生长培养基(1% 双抗+10% FBS+89% DMEM/High Glucose)于培养箱中进行培养。培养箱环境参数为37℃,5% CO2。
诱导分化:参考雷召雄等[9]的方法诱导分化脂肪细胞。诱导培养基:10 μg·mL-1胰岛素、1 μmol·L-1地塞米松、0.5 mmol·L-1IBMX和1 μmol·L-1罗格列酮;维持分化培养基:10 μg·mL-1胰岛素、1 μmol·L-1罗格列酮。
油红O染色:脂肪细胞分化完成后,弃培养基;PBS清洗3~4次后,加入4%多聚甲醛固定5 min;弃去4%多聚甲醛,加同等体积的4%多聚甲醛,室温条件下孵育30 min;弃4多聚甲醛,60%异丙醇清洗;待到培养皿完全干燥后,加入油红O工作液 (60%油红O储存液和40% PBS),室温孵育20 min;弃油红O染液,PBS立即清洗3~4次;最后在显微镜下观察脂滴形成数量和大小来判断脂肪细胞的分化情况并拍照记录。
1.2.6 荧光定量PCR
参照NCBI GenBank数据库中已公布的牛GAPDH(NM_001034034.2)、FoxO1(XM_025000053.1)、PPARγ(NM_181024.2)、C/EBPα(NM_176784)、C/EBPβ(NM_176788)、FABP4(NM_174314.2)、LPL(NM_001075120.1)的mRNA序列,使用Primer 5.0软件设计引物后交由安徽通用生物技术有限公司进行合成(表1)。利用TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus, TaKaRa)试剂盒,参照其说明书检测FoxO1和PPARγ、C/EBPα、C/EBPβ、FABP4、LPL在脂肪细胞分化第0、2、4、6、10天表达水平(n=3)。反应体系为:TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)7.5 μL;cDNA模板2.0 μL;上下游引物各0.3 μL;ddH2O 4.9 μL。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。
1.2.7 数据统计
采用2-ΔΔCT法分析荧光定量的结果,数据均采用“平均值±标准误”表示。用SPSS 26.0软件进行单因素方差 (one-way ANOVA) 分析,**表示极显著差异(P<0.01),*表示显著差异(P<0.05)。
2 结果与分析
2.1 牛FoxO1基因CDS区克隆
用1%琼脂糖凝胶电泳检测扩增获得的牛FoxO1基因的CDS区全长1 998 bp(图1),经BLAST比对发现,与GenBank所公布的牛FoxO1的CDS序列(登录号:XM_025000053.1)完全一致,可用于后续试验。
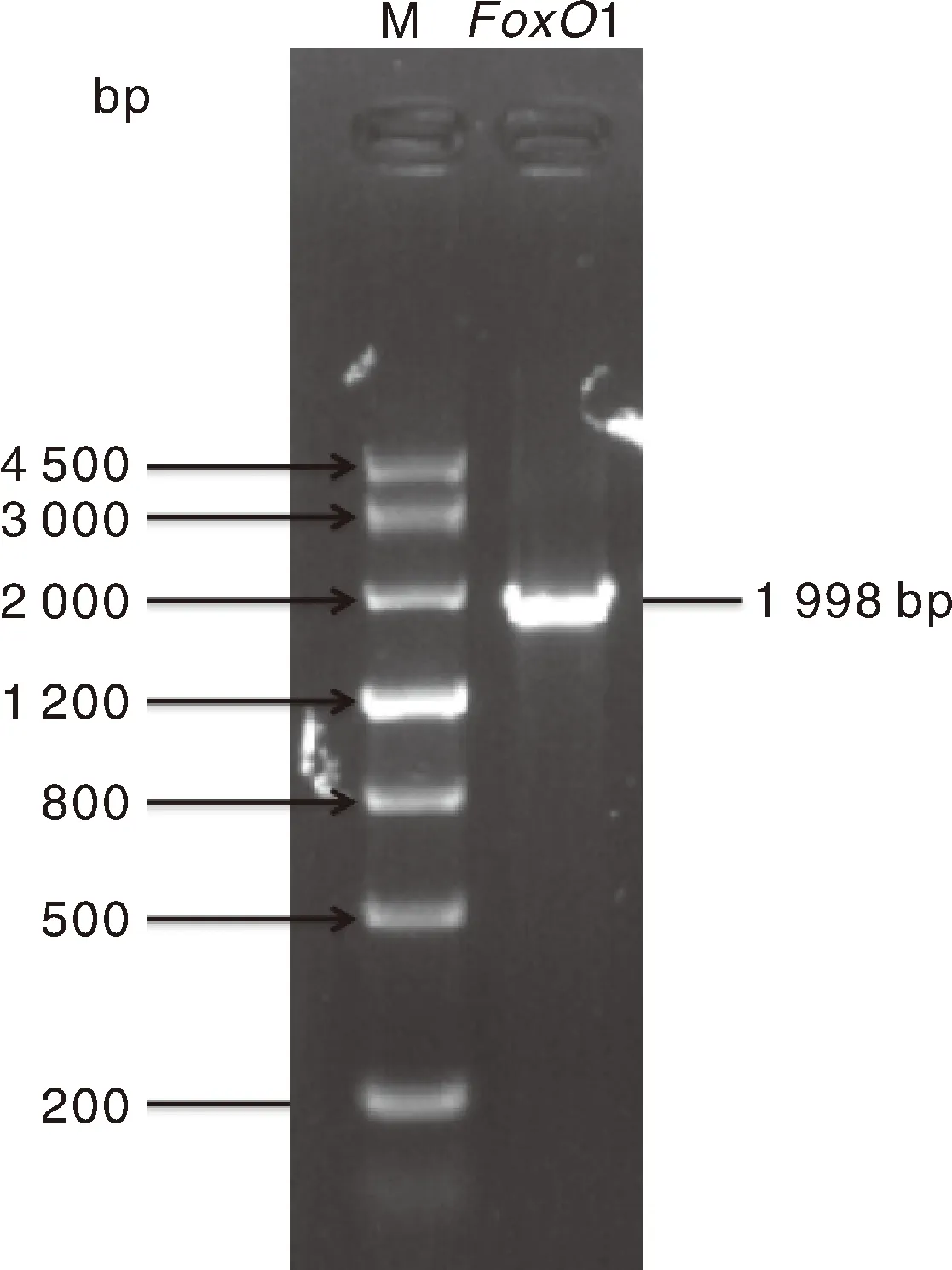
M泳道为DL4500 Maker,1泳道为目的片段。Lane M is DL4500 Maker, lane 1 is the destination segment.图1 牛FoxO1基因的CDS区克隆Fig.1 Cloning of CDS region of Bovine FoxO1 gene
2.2 牛FoxO1基因的生物信息学分析
2.2.1 牛FoxO1结构预测及同源性分析
通过Bioedit软件及Protparam工具进行理化性质预测,结果发现,牛FoxO1基因编码的蛋白质分子式为C3016H4711N871O979S35,分子量为69 958.93 u,半衰期为30 h,理论等电点为6.38,不稳定指数为59.53(>40.00)。因此,推测牛FoxO1基因编码的蛋白质是一种不稳定蛋白。对牛FoxO1蛋白的二级和三级结构进行预测发现,牛FoxO1蛋白的二级结构由无规则卷曲(66.47%)、α-螺旋(23.91%)、延伸链(5.71%)和β-转角(3.91%)构成(图2-A);其三级结构和二级结构的预测结果基本相同(图2-B),推断出牛FoxO1蛋白二级、三级结构以无规则卷曲为主,α-螺旋次之。对牛FoxO1蛋白的互作蛋白进行预测发现,牛FoxO1蛋白与AKT1、AKT2、AKT3、SIRT1、PRKACA、CDK2和MAPK8等蛋白之间存在互作效应(图2-C)。采用MEGA 5软件对牛、猪、绵羊、山羊、人、小鼠、瘤牛和长臂猿FoxO1基因的蛋白质序列构建进化树,结果显示,牛与绵羊、山羊在进化树中最近,同源性最高(图2-D),这一结果说明FoxO1在进化中的功能非常重要且极度保守。
2.2.2 牛FoxO1功能预测
牛FoxO1蛋白质跨膜螺旋预测结果显示,牛FoxO1不存在跨膜区域,其第1~665位氨基酸存在于细胞膜外,属于非跨膜蛋白(图3-A)。磷酸化位点预测结果显示,牛FoxO1蛋白存在95个磷酸化位点,其中,丝氨酸(serine,Ser)、苏氨酸(threonine,Thr)、酪氨酸(tyrosine,Tyr)各有68个、23个、4个潜在磷酸化位点(图3-B)。此外,牛FoxO1蛋白不存在信号肽(图3-C),推测其为非分泌性蛋白。亲/疏水性预测发现,牛FoxO1蛋白在第101~102位氨基酸疏水性最强,分值为2.067;在第260位氨基酸亲水性最强,分值为-2.767。从亲水性/疏水性总体来看,亲水性氨基酸明显多于疏水性氨基酸(图3-D)。由此推断,牛FoxO1蛋白属于亲水性蛋白。保守结构域预测结果显示,牛FoxO1蛋白在第169~259位氨基酸存在一个FH(Forkhead)保守结构域的,而其第37~69、90~108、126~160、272~287、384~405和420~431位氨基酸残基为低复杂性区域(图3-E)。亚细胞定位结果显示,牛FoxO1基因编码蛋白在细胞核、质膜、细胞质、囊泡分泌系统和高尔基体中发挥生物学作用的可能分别为69.6%、13.0%、8.7%、4.3%和4.3%(表4)。由此推测,牛FoxO1基因最有可能定位于细胞核中发挥生物学作用,其次为质膜。
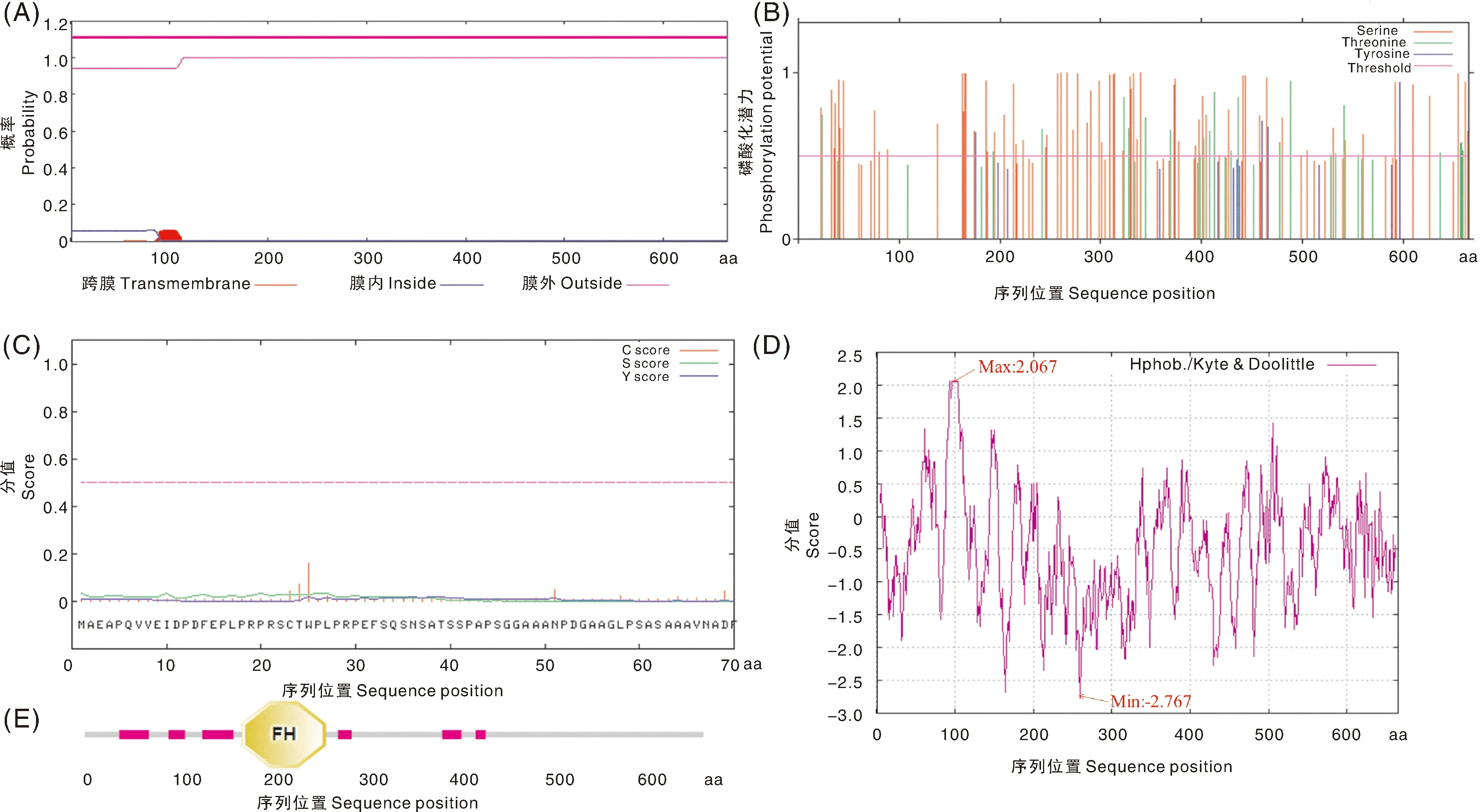
A,跨膜区;B,磷酸化位点;C,信号肽;D,亲/疏水性;E,结构域。A, Transmembrane region; B, Phosphorylation sites; C, Signal peptide; D, Hydrophilic/hydrophobic; E, Domain.图3 牛FoxO1 蛋白功能预测Fig.3 Functional prediction of bovine FoxO1 protein

表4 牛FoxO1亚细胞定位预测结果Table 4 Prediction results of subcellular localization of bovine FoxO1 protein
2.3 牛脂肪细胞诱导分化及油红O染色
本试验成功分离牛脂肪细胞并诱导其分化(图4),未诱导分化时(第0天)脂肪细胞呈梭状,其大小均匀,分散分布且脂滴数量较少。随着分化进程的不断推进,脂肪细胞形态良好,细胞内部脂滴数量逐渐增多并充盈增大。第10天时,视野中可明显地观察到大量脂肪滴,且其余小脂滴呈聚集趋势。进一步使用酶标仪检测脂肪分化前后510 nm吸光值,结果发现,脂肪细胞分化后期吸光值显著性高于分化前。这一结果说明本次分离并诱导分化的牛脂肪细胞,从分化效果、细胞形态等指标检测,其分化效果较好,可用于后续试验。
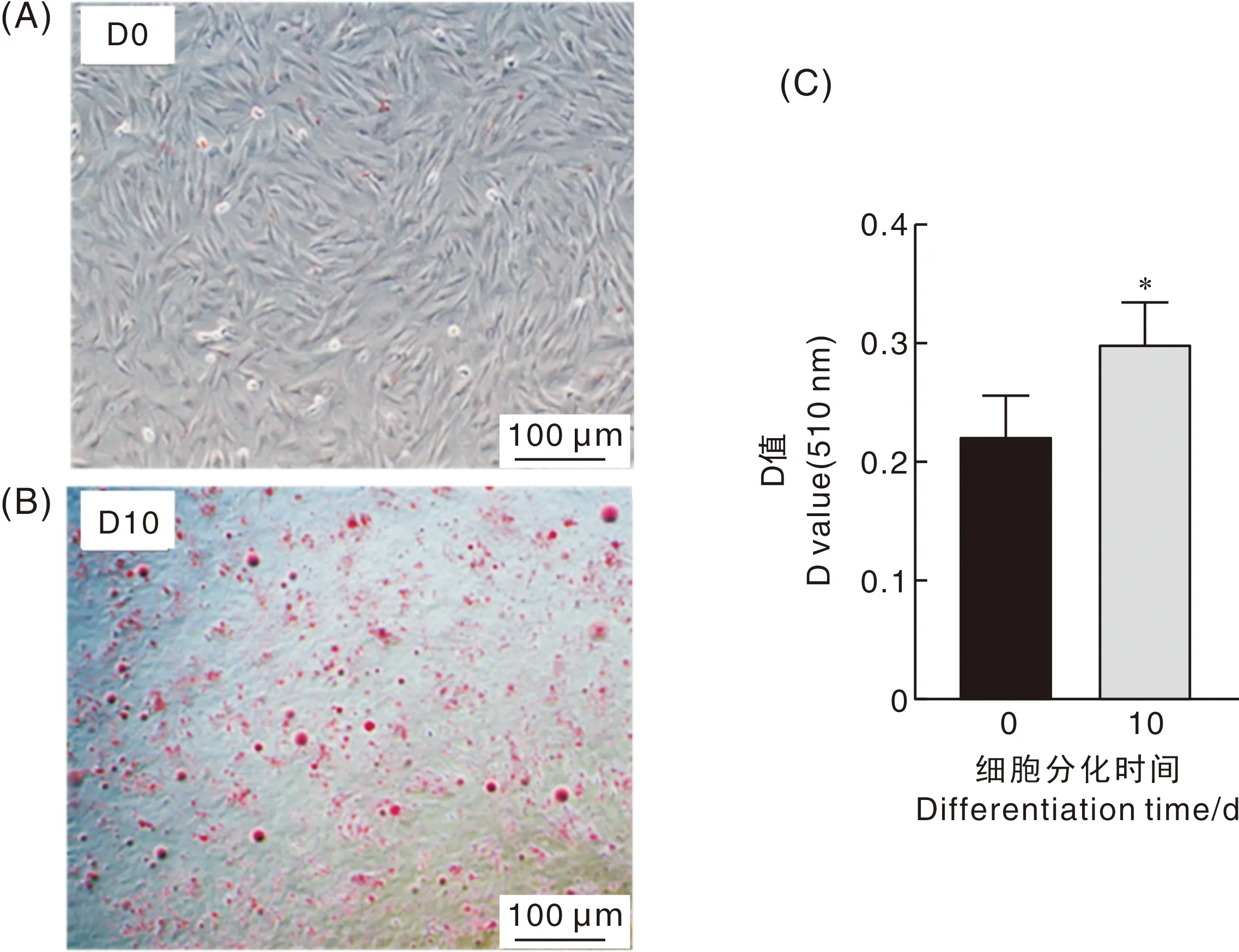
A,未分化前细胞;B,诱导分化后第10天油红O染色;C,510 nm 处D值。“**”,P<0.01;“*”,P<0.05。下同。A, Pre-differentiated cells; B, Oil red O staining 10 days after induced differentiation; C. D value at 510 nm. “**”, P<0.01;“*”, P<0.05. The same as below.图4 牛脂肪细胞第0、10天分化情况Fig.4 Differentiation of bovine adipocytes at 0 and 10 days
2.4 脂肪细胞分化标志基因表达量检测
qRT-PCR检测脂肪细胞分化相关基因(PPARγ、C/EBPα、C/EBPβ、FABP4、LPL)在牛脂肪细胞分化第0、2、4、6和10天时的表达量。如图5所示,PPARγ在分化第0天就有表达,其分化第2、10天表达量显著高于第0天(P<0.05),分化第4、6天极显著高于第0天(P<0.01);C/EBPα随分化进程的不断推进表达量逐渐升高,分化第6天有所下调,随后回升,其在分化第2、4、6和10天表达量都极显著高于第0天(P<0.01);C/EBPβ在分化第4、6天极显著高于第0天(P<0.01),其表达量呈“下降-上升-下降-上升”
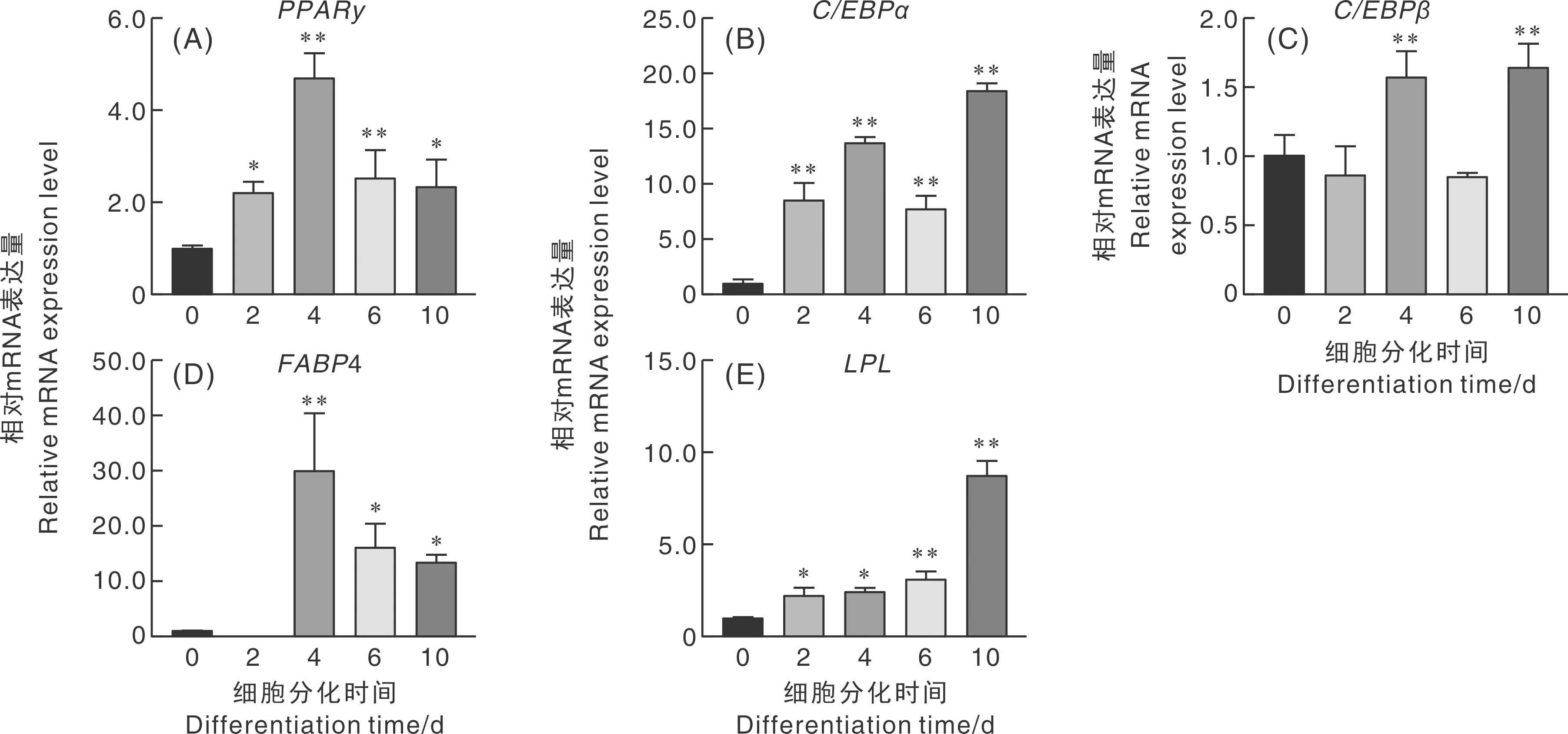
图5 牛脂肪细胞分化各阶段标志基因的时序表达Fig.5 Sequential expression of marker genes at different stages of adipocyte differentiation
趋势;FABP4在分化第0、2天表达量较低,于分化第4天表达量上升达峰值(P<0.01),随后下调,其分化第6、10天的表达量显著高于未诱导分化的第0天(P<0.05);LPL随分化进程推进表达量不断上升,其分化第2、4天表达量显著高于分化第0天(P<0.05),分化第6、10天的表达量极显著高于第0天(P<0.01)。
2.5 牛FoxO1时序表达分析
利用实时荧光定量 PCR检测牛FoxO1基因在脂肪细胞分化过程中的表达量。如图6所示,在牛脂肪细胞分化过程中,与分化第0天相比,FoxO1在分化第2天(P<0.05)和第4天(P<0.01)时逐渐下调,但在第6天表达量极显著升高(P<0.01),此后下调(P<0.05)。
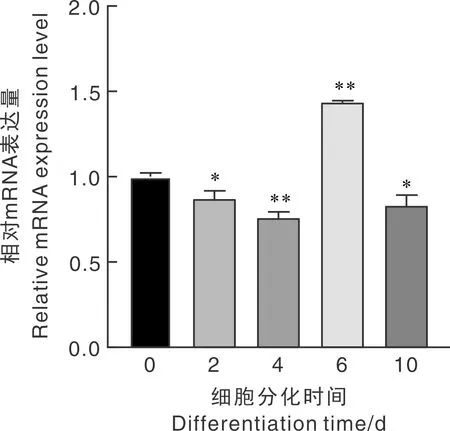
图6 牛FoxO1基因在脂肪细胞分化过程中的时序表达Fig.6 Sequential expression of bovine FoxO1 gene during adipocyte differentiation
3 讨论
动物体脂肪沉积是脂肪细胞增殖与分化的结果,与生脂相关基因的表达水平息息相关。FoxO1基因作为Fox亚家族最早发现的转录因子对脂肪细胞分化和脂肪沉积有重要影响。如Nakae等[23]研究发现,FoxO1在激素激活信号通路与促进脂肪细胞分化的复杂转录级联的整合中起着重要作用。此外,已有研究表明,FoxO1在脂肪细胞中大量表达,组织与脂肪细胞分化、脂质代谢等相关基因转录[24-25]。因此,研究牛FoxO1基因序列、编码蛋白特征及FoxO1基因对牛脂肪细胞分化的时序表达规律,有助于我们深入了解牛脂肪形成的分子机理,增加调节牛脂肪生成的关键候选基因。
CDS区的克隆于基因功能的研究而言有重要意义[26]。本试验克隆得到牛FoxO1基因完整的CDS区,其全长为1 998 bp,编码655个氨基酸,这与NCBI数据库已公布信息一致。蛋白质的半衰期和其稳定性密切相关[27]。本研究预测发现,牛FoxO1半衰期为30 h,不稳定指数较高,为59.53(>40.00),推测其属于不稳定蛋白。再者,牛FoxO1二级结构中无规则卷曲(结构相对较松散)占比高达66.47%,而对蛋白质结构的稳定性有重要影响的α-螺旋仅含23.91%,也进一步证明牛FoxO1为不稳定蛋白。此外,与本研究不一致的是,孙雨佳[20]研究表明,牛FoxO1二级结构中无规则卷曲占比75.42%,α-螺旋占比17.30%。在使用同一二级结构预测工具SOPMA进行分析出现结果不一致的现象,推测是因FoxO1蛋白序列略有差异或SOPMA工具版本更新使预测结果更加准确等原因所致。亚细胞定位结果表明,牛FoxO1最有可能定位于细胞核(69.6%)发挥生物学作用,这与Lettieri Barbato等[25]报道一致,FoxO1主要在细胞核中作为转录因子发挥作用。FH域是一个大约由110个氨基酸所组成的高度保守序列,其可作为DNA结合域发挥作用[28]。本研究发现,牛FoxO1蛋白在第169~259位氨基酸存在一个FH保守结构域,该FH域存在91个保守的氨基酸。在分析FoxO1基因在不同物种中的系统进化树分析发现,牛与瘤牛、绵羊和山羊等物种具有较高同源性,在系统进化树上距离最近,我们推测FoxO1在不同物种中有相近的生物学功能。韩琦[29]研究发现,绵羊FoxO1与牛有较高的同源性。此外,FoxO1的转录活性受磷酸化的调节。具体而言,磷酸化的FoxO1通过核排斥进入细胞质并失去其转录活性[30]。我们通过预测发现牛FoxO1存在95个磷酸化位点。
通过蛋白互作预测发现,牛FoxO1蛋白与AKT1、AKT2、AKT3、SIRT1、PRKACA、CDK2、MAPK8等蛋白之间存在紧密互作关系。已有研究表明,AKT1、AKT2是体内脂肪维持所必须的,而AKT3在分化的脂肪细胞中表达[31-32];SIRT1在间充质干细胞向成骨细胞分化过程中控制脂肪细胞的发育,若SIRT1缺失则会导致C-Myc激活、脂肪细胞增生和脂肪细胞代谢失调[33-34];此外,有报道称PPKACA在草鱼脂肪组织中高度表达,但该蛋白具体对脂肪细胞增殖、分化的调节机制还有待研究[35];促进CDK2的表达会促进脂肪细胞增殖,抑制脂肪细胞分化,减少脂滴形成[36];而MABK8所在的家族MAPK可级联控制C/EBPβ和C/EBPδ基因的早期表达来刺激LIF受体,使前脂肪细胞进行最终分化[37]。因而,我们可以看出,以上蛋白都与脂肪细胞的增殖或分化等密切相关,进而推测出与以上蛋白有互作效应的FoxO1与脂肪细胞的分化有着密不可分的联系,对这一推测还需后期试验进行FoxO1在脂肪细胞增殖分化过程中基因功能验证,并鉴定其靶基因。
PPARγ和C/EBP是作为促进脂肪细胞早期分化的关键因子,其能激活并调控脂肪细胞分化的下游基因的表达,从而精细调控细胞分化成熟[19,38]。研究发现,FoxO1可负调控PPARγ和C/EBP的表达和转录活性,如FoxO1活性降低会促进PPARγ的表达,进而促进脂肪细胞分化[19]。FABP4主要表达于脂肪细胞和巨噬细胞,主要功能是介导脂肪酸的胞内转运,在脂肪细胞分化过程中,其表达和活性均会增加,以此促进脂肪细胞分化[39-40]。脂蛋白脂肪酶(LPL)是由脂肪等组织分泌的一种酶,与动物脂质的含量密切相关,此外LPL基因表达开始于脂肪细胞发育的早期并在分化细胞中维持表达,被用作脂肪细胞分化的早期标记基因[41]。因此,在本试验中分离牛皮下脂肪细胞,对其进行诱导分化,检测在脂肪细胞分化过程中各标志基因(PPARγ、C/EBPα、C/EBPβ、FABP4、LPL)的表达模式,以判断脂肪细胞诱导分化是否成功。本试验结果显示,PPARγ在脂肪细胞分化早期就开始表达,随分化进程推进,其表达量不断上升,于第4天表达量达到高峰(P<0.01),此后下调,这与陈晓佩等[42]报道相似,但表达量达峰值的时间略有不同,推测可能与选择的不同物种脂肪细胞分化成熟时间不同有关。C/EBPα在第0天表达量较低,但其在诱导分化各阶段表达量都极显著高于第0天(P<0.01)。C/EBPβ在细胞分化第4天和第10天达到峰值。对于脂肪细胞分化的另一个关键基因FABP4,其在脂肪细胞分化前期表达量极低,但随着分化进程不断推进,其表达量开始上升,这与Schlottmann等[40]的报道一致。LPL随分化进程推进表达量持续上调,此变化趋势与郭红芳等[22]的报道一致。说明本次诱导分化的牛脂肪细胞效果较好。
Zou等[43]报道,FoxO1在3T3-L1前脂肪细胞分化过程中呈现“S型”激活模式。与此一致的是,本研究通过qPCR发现,牛FoxO1的表达呈现“下调-上调-下调”的趋势。分化前期FoxO1表达量下调可能是细胞重新进入了细胞周期和克隆扩增所致[19]。以上研究结果进一步证明了FoxO1基因对脂肪细胞的分化有一定的影响,对于其具体影响机制还需进一步对FoxO1基因功能进行探究。
4 结论
本试验成功克隆了牛FoxO1基因的CDS区序列,对牛FoxO1基因编码蛋白的结构、理化性质、功能及互作蛋白等进行了预测,分析了FoxO1基因在脂肪细胞分化过程中的时序表达规律,为探究牛FoxO1基因调控脂肪生成的分子机制提供参考信息。
