早期肠内营养耐受性分级干预方案在心脏外科术后重症患者中的应用
2023-06-09熊厚仁方迎迎朱明华郭兰彩倪秀梅陈浩
熊厚仁,方迎迎,朱明华,郭兰彩,倪秀梅,陈浩
(1.安徽医科大学第一附属医院a.心脏大血管外科ICU;b.重症医学科,安徽 合肥 230022;2.安徽省军区合肥第四干休所 门诊部,安徽 合肥 230031)
心脏外科术后重症患者机体长期处于高分解、负氮平衡状态,静息能量消耗增加,蛋白质分解增加,容易导致营养高风险和营养不良[1]。早期肠内营养(early enteral nutrition,EEN)为重症患者入住重症监护病房24~48 h 内,经胃肠道提供营养物质及其他营养素的营养支持方式[2]。然而,喂养不耐受(feeding intolerance,FI)如腹胀、腹泻、呕吐、误吸、胃潴留等,常导致肠内营养(enteral nutrition,EN)喂养延迟或终止,影响目标热量达标[3]。重症超声可视化技术能够实现对病情动态、多维度评估,常用于指导对重症患者的精细化管理。因此,本研究基于重症超声,动态评估营养风险和耐受性,实施期肠内营养耐受性分级干预,取得良好效果,现报道如下。
1 一般资料
采取便利抽样方法,选取2021 年7 月-2022 年6 月合肥市某三级甲等医院心脏外科ICU(cardiac surgery intensive care unit,CSICU)收治的心脏外科术后患者136 例。按入科时间分为标准组和分级组,其中2021 年7—11 月的68 例患者为标准组,2021年12 月—2022 年1 月为团队培训干预期,2022 年2-6 月的68 例患者为分级组。本研究已获得医院伦理委员会审核通过,并取得患者及家属的知情同意。纳入标准:(1)年龄19~80 岁;(2)体外循环下心脏外科手术患者;(3)改良危重患者营养风险筛查(modified nutrition risk in the critically ill score,mNutric 评分)≥5 分,且预计3 d 以上不能经口进食;(4)急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHE Ⅱ评 分)≥8分;(5)预计在心脏外科ICU 治疗时间≥7 d。排除标准:(1)既往有严重营养障碍或消化道疾病、代谢性、消耗性疾病(消化性溃疡穿孔、甲状腺功能亢进、恶性肿瘤等);(2)长期使用激素或免疫抑制剂的患者;(3)血流动力学不稳定,血管活性药物[去甲肾上腺素NE>0.2 μg/(kg·min)]无法纠正[4]。2 组患者一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
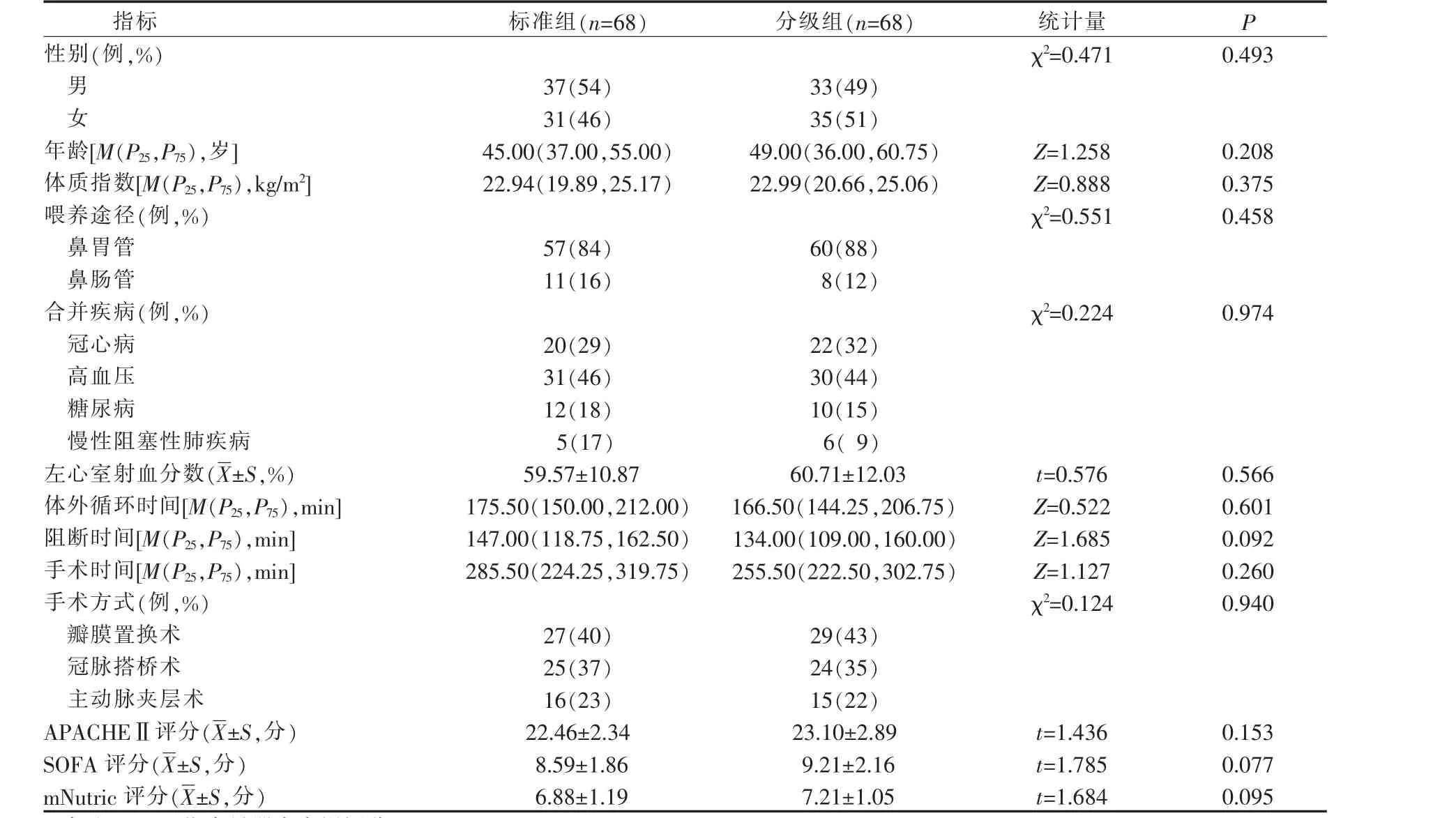
表1 2 组心脏外科术后重症患者一般资料比较
2 研究方法
2.1 标准组干预方法 实施肠内营养耐受性常规干预策略,至患者7 d 内成功达到目标热量。(1)喂养时机:血流动力学稳定情况下,术后24~48 h 内开始早期肠内营养;(2)喂养途径:术后常规放置鼻胃管,误吸高风险患者,超声引导下放置鼻肠管;(3)喂养速度:初始速度20~40 mL/h,最大速度不超过120 mL/h;(4)转移训练:床头抬高30°~45°,根据患者病情实施床上肢体被动运动,包括前屈、后伸、内收、外展、内旋、外旋,20 min/次,2 次/d;(5)目标热量管理:1 周内要求达到目标热量104.60~125.52 kJ/(kg·d),蛋白质1.2~2.0 g/(kg·d);(6)肠内营养制剂管理:现配现用,温度控制在37~40℃;(7)喂养不耐受管理:出现呕吐、腹胀、胃潴留时停止肠内营养,出现腹泻时更换肠内营养制剂,由医师选择使用药物,症状缓解后重新开始肠内营养;(8)误吸集束化管理:氯已定口腔护理2 次/d,开放气道患者行声门下吸引,气囊压力维持在25~30 cmH2O(1 cmH2O=0.098 kPa),及时倾倒冷凝水,减少镇静催眠药使用。
2.2 分级组干预方法 在标准组基础上按照分级干预流程实施早期肠内营养,并对喂养不耐受症状实施分级干预,至患者7 d 内成功达到目标热量,具体方案如下:
2.2.1 成立耐受性分级干预小组 小组成员包括:心脏外科ICU 主任、护士长各1 名,医师3 名,营养师2 名,通过全国重症超声培训专科护士2 名,心肺康复专科护士2 名,专职护士5 名,康复治疗师2名。由护士长担任组长,负责协调小组工作、质量控制;主任负责方案制定、组织多学科查房;医师负责肠内营养耐受性诊断、喂养不耐受症状管理;营养师参与方案制定、营养知识培训;专职护士负责肠内营养耐受性评估、分级干预实施、耐受性评价及健康教育;康复治疗师与心肺康复专科护士共同负责早期活动方案制定及实施;重症超声专科护士负责胃残留量及股四头肌床边超声监测。
2.2.2 制定分级干预策略 (1)腹胀分级干预:专职护士监测腹腔压力,依据腹腔压力分级实施干预策略。具体措施如下。①腹腔压力=(12~15)mmHg(1 mmHg=0.133 kPa):增加肠内营养速度;②腹腔压力=(16~20)mmHg:减少肠内营养速度50%,实施目标导向早期活动[5],由心肺康复专科护士、康复治疗师共同对患者进行体适能评估,根据运动负荷评估结果开具运动处方,内容包括:踝泵运动、坐位弹力带抗阻训练、脚踏车训练等,循序渐进、逐级增量;③腹腔压力=(21~25)mmHg:暂停肠内营养,采取腹部按摩,每次5 min,2 次/d,联合[6]新斯的明足三里穴位注射;④腹腔压力>25 mmHg:停止肠内营养,采取可拆卸式芒硝腹带(实用新型专利,专利号:ZL202220168024.8)进行芒硝外敷联合肛管排气、灌肠,每6 h 复测1 次腹腔压力。(2)腹泻分级干预:专职护士对不同性状、容量的大便分别赋值[7],根据总分实施干预策略。具体措施如下。①Ⅰ级(12~20 分):增加肠内营养速度;②Ⅱ级(21~30 分):维持原肠内营养速度;③Ⅲ级(31~40 分):减少肠内营养速度50%;④Ⅳ级(≥41 分):暂停肠内营养,由医师选择药物治疗,每6 h 评估1 次。(3)呕吐分级干预:①Ⅰ级(恶心感但无呕吐):维持原肠内营养速度;②Ⅱ级(恶心并伴呕吐):减少肠内营养速度50%;③Ⅲ级(呕吐且胃残留量≥500 mL):暂停肠内营养喂养,采取揿针刺激双侧内关穴,联合[8]胃复安足三里穴位注射,每侧穴位5 mg,每6 h 评估1 次。(4)误吸分级干预:①Ⅰ级(轻微误吸,不伴随咳嗽症状,误吸量<1 mL):减少肠内营养速度50%;②Ⅱ级(呼吸道内抽吸出胃内容物>1 mL):暂停肠内营养,行支气管肺泡灌洗,医师选择使用胃肠动力药,每6 h 评估1 次。(5)胃潴留分级干预:应用改良B 超胃窦单切面法每天测定空腹胃窦运动指数,以胃窦面积反映胃残留量。重症超声专科护士采用Sonosite EDGE便携式B 超仪,探头频率2~5 MHz,将患者上身抬高45°,取上腹正中剑突下,B 超探测以肠系膜上动脉、腹主动脉以及肝左叶作为标志,做胃窦切面B超。自鼻胃管注入300 mL 温开水快速充盈胃腔,连续记录充盈后6 min 内胃窦收缩次数,以每2 min 胃窦收缩次数记为胃窦收缩频率,并连续测量3 次胃窦最大舒张(S 舒张)和最小收缩(S 收缩)面积,计算胃窦平均面积变化△S=(S 舒张—S 收缩),用△S/S舒张代表胃窦收缩幅度,空腹胃窦运动指数=胃窦收缩频率×胃窦收缩幅度。专职护士依据空腹胃窦运动指数值调整肠内营养速度,具体如下[9]:①空腹胃窦运动指数<0.4,肠内营养速度为20~30 mL/h,肠内营养总量可为500 mL/d;②≥0.4~<0.8 时,肠内营养速度为40~60 mL/h,肠内营养总量可为1 000 mL/d;③≥0.8 时,肠内营养速度>70 mL/h,肠内营养总量可为≥1 500 mL/d。
2.2.3 制定分级干预流程 (1)全面评估:心脏外科患者术后24 h 内,专职护士应用mNutric 评分量表完成营养风险筛查,应用APACHEⅡ评分量表完成病情危重程度评估;(2)分级干预:mNutric 评分≥5分且APACHEⅡ评分≥8 分的患者,由护士长统一协调成员,组织多学科会诊,根据喂养不耐受症状实施分级干预,直至达到目标热量;(3)综合评价:重症超声专科护士测量股四头肌的肌肉大小,专职护士收集整理患者全部资料,建立档案管理;(4)质量控制:护士长每周五组织疑难病例讨论会议,主管医生、责任组长分别汇报分管患者肠内营养耐受性管理过程中存在的问题,提出整改措施,并达成共识,进行质量持续改进。具体流程见图1。
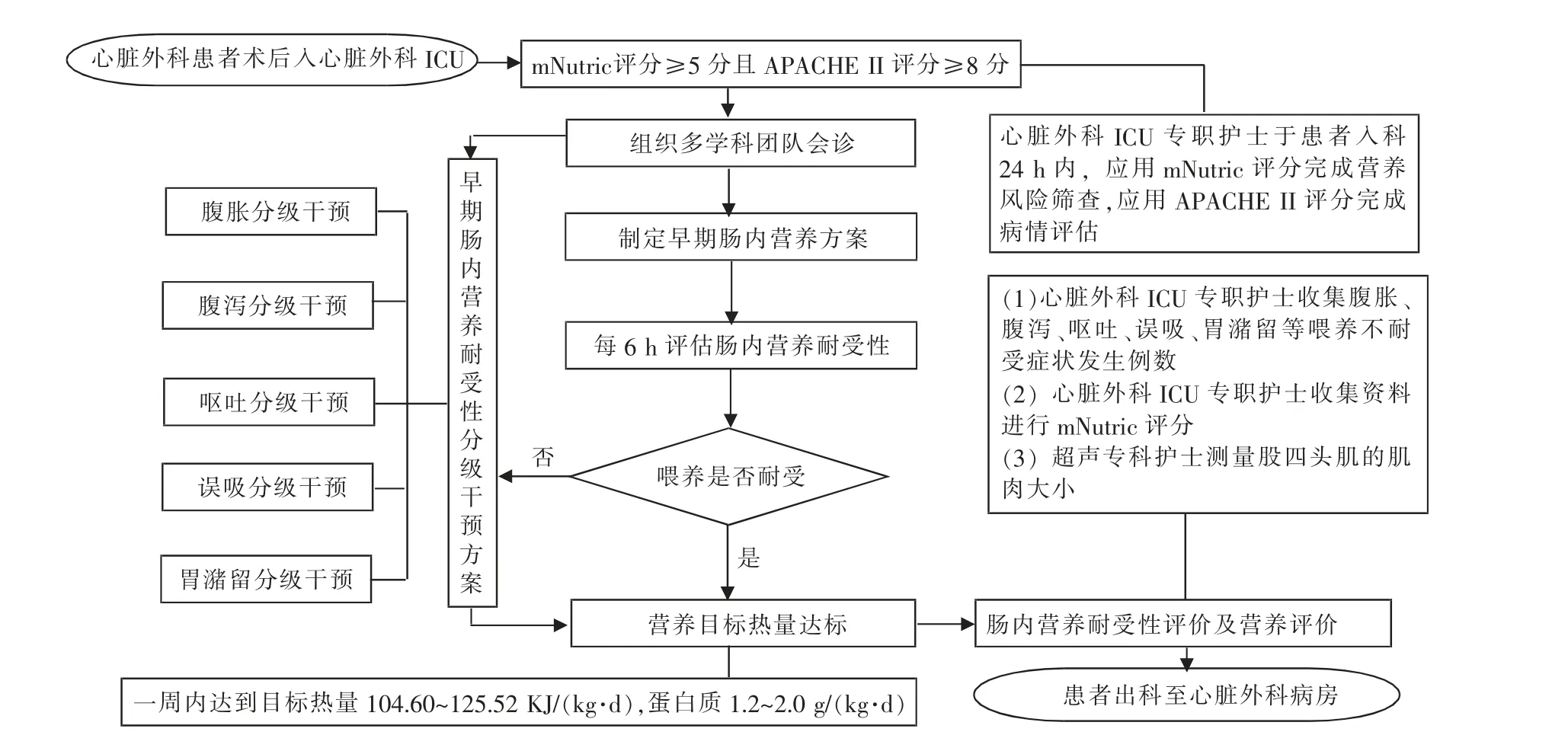
图1 分级干预流程图
2.3 评价指标
2.3.1 肠道耐受性指标:记录2 组患者喂养不耐受症状发生情况,包括腹胀、腹泻、呕吐、误吸、胃潴留。符合其中至少1 项即喂养不耐受,未出现上述情况则为耐受。耐受百分率=(总例数-不耐受例数)/总例数×100%。
2.3.2 营养指标:2 组患者于术后第7 天完成右侧大腿股四头肌超声检查。为减少人为误差,由不参与研究的重症超声专科护士进行,包括股直肌横截面积(RF-CSA)、股直肌厚度(RF-MLT)、股中间肌厚度(VI-MLT)。采用Sonosite EDGE 便携式B 超仪,探头频率6~13 MHz,患者取仰卧位,双下肢生理状态自然伸直,探头垂直放于患者右侧下肢髂前上棘与髌骨上缘的中下1/3 处,调整探头位置使图像同时显示股直肌和股中间肌。股直肌厚度:呈高回声筋膜间的内部垂直距离;股直肌横截面积:沿股直肌筋膜描绘出的横截面积;股中间肌厚度:股骨正上方股中间肌筋膜间垂直距离。每个时间点,均重复测量3次,最终取平均值。
2.3.3 其 他:(1)记 录2 组 患 者 术 后 第7 天 的mNUTRIC 评分、APACHEⅡ评分及SOFA 评分分值;(2)记录2 组患者目标热量达标时间、机械通气时间及ICU 监护时间。
2.4 统计学方法 采用Excel 2016 录入数据,IBM SPSS 21.0 分析数据。计数资料采用频数和百分率进行描述,组间比较采用χ2检验或连续性校正χ2检验;采用Kolmogorov-Smirnov 检验对计量资料进行正态性检验,符合正态分布的采用均数±标准差进行描述,组间比较采用独立样本t 检验;偏态分布的采用中位数 (四分位数)进行描述,组间比较采用Wilcoxon 秩和检验。采用双侧检验,P<0.05 为差异有统计学意义。
3 结果
3.1 2 组心脏外科术后重症患者早期肠内营养期间不耐受症状比较 分级组不耐受症状和不耐受病例数均低于标准组,耐受率高于标准组(P<0.05),见表2。
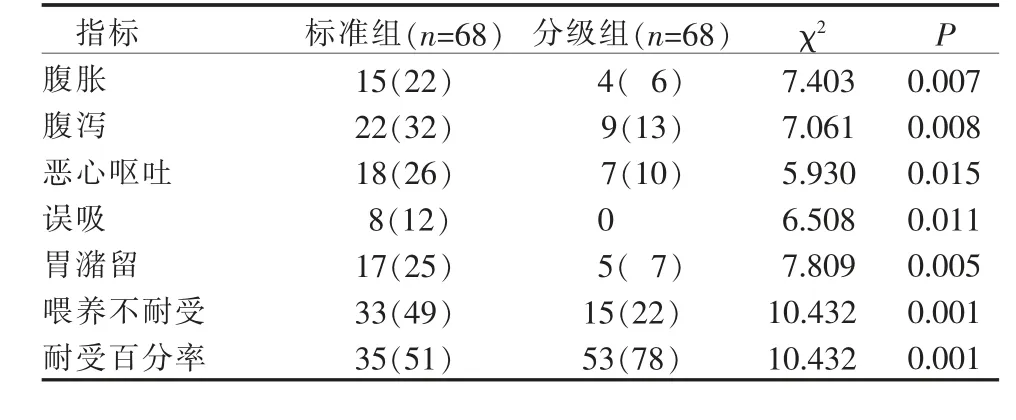
表2 2 组心脏外科术后重症患者早期肠内营养不耐受症状比较(例,%)
3.2 2 组心脏外科术后重症患者营养指标比较 分级组股直肌横截面积、股直肌厚度、股中间肌厚度超声检查均高于标准组(P<0.05);分级组mNutric 评分、目标热量达标时间低于标准组(P<0.05),见表3。
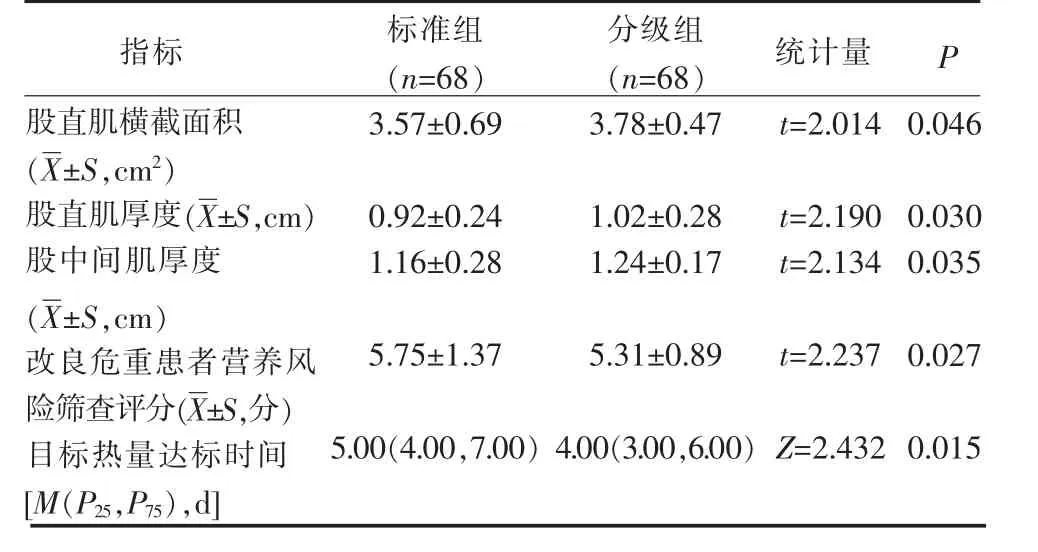
表3 2 组心脏外科术后重症患者营养指标比较
3.3 2 组心脏外科术后重症患者临床预后指标比较
分级组APACHEⅡ评分、SOFA 评分、机械通气时间及ICU 监护时间均低于标准组(P<0.05),见表4。
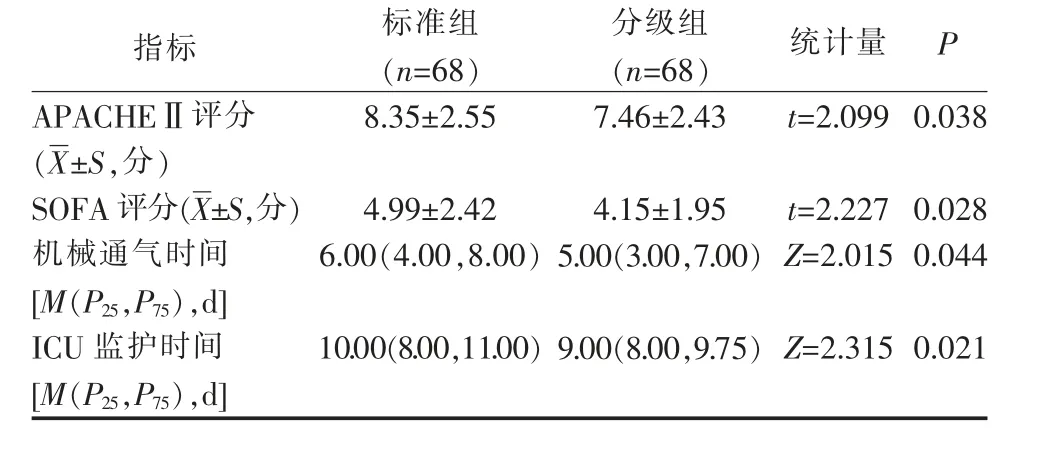
表4 2 组心脏外科术后重症患者预后指标比较
4 讨论
4.1 早期肠内营养耐受性分级干预能改善肠内营养耐受性 本研究中,分级组喂养不耐受症状病例数均低于标准组,表明分级组干预措施能够明显改善肠内营养耐受性。分析原因主要包括:每6 h 评估肠内营养耐受性,实施分级干预,化被动为主动,有效提高患者肠内营养耐受性[10];有效的早期活动可改善肠麻痹,加快新陈代谢,降低腹胀及误吸发生率,促进胃肠蠕动及胃肠功能恢复,提高胃动力,减少胃潴留的发生[11]。此外,苏小平等[12]构建喂养不耐受风险预测模型证实,APACHEⅡ评分越高,发生喂养不耐受风险越大。本研究中,标准组喂养不耐受发生率高于分级组。分析原因可能为:体外循环引发非生理性组织低灌注,胃肠道微循环灌注不良,胃肠蠕动减缓,导致耐受性下降,喂养不耐受发生率增高。
4.2 早期肠内营养耐受性分级干预能改善营养状况 由于全身炎症反应和器官功能障碍,白蛋白、前白蛋白、C-反应蛋白等常规化验不能作为评估当前营养状态的敏感指标[13]。本研究中,应用重症超声观测股四头肌肌肉大小评估患者营养状态,分级组股直肌横截面积、股直肌厚度、股中间肌厚度均高于标准组,表明分级组干预方式在改善患者营养状况方面效果明显。分析原因主要包括:分级组根据肠内营养耐受性,制定出更合理的营养支持方案,提高整蛋白制剂、氮源制剂的摄入量,在修复肠道黏膜同时促进物质和营养元素的消化与吸收,为机体提供必需营养素,促进肌肉蛋白质合成[14];目标导向早期活动在积极缓解患者腹胀同时,也可减少骨骼肌肉的分解,减少蛋白质分解[15]。此外,分级组mNutric 评分、目标热量达标时间均低于标准组,表明分级组干预方式具有更高效地喂养,有助于降低患者营养不良风险。分析原因主要为:分级组采取分级干预措施,包括适当降低肠内营养速度、使用胃肠动力药物及更换肠内营养制剂等,避免盲目暂停或终止肠内营养,缩短目标热量达标时间,降低营养风险。
4.3 早期肠内营养耐受性分级干预能改善疾病预后 张娟等[16]在151 例急性胰腺炎患者回顾性分析研究中指出,APACHEⅡ和SOFA 评分对重症患者病情严重程度有预测价值。本研究中,分级组APACHEⅡ评分、SOFA 评分均低于标准组,表明分级组能够明显改善患者预后。分析原因主要为:分级组明显改善喂养不耐受症状,保证肠内营养实施的连续性,进而保护肠黏膜屏障,降低内毒素的吸收;改善胃肠黏膜血液灌注,防止细菌迁移,减少机体炎性反应,防止机体多器官功能不全。此外,分级组机械通气时间、ICU 监护时间均低于标准组,分析原因主要包括:重症超声专科护士评估胃残留量及股四头肌大小,助力可视化精准诊疗,加快康复进程[17];心肺康复专科护士实施早期活动能够改善机械通气患者的通气状态及康复积极性,有利于早日撤机[18];根据喂养不耐受症状实施分级护理,动态调整干预措施,避免护理不足或护理过度,提高护理效果[19]。由此可见,本研究充分体现护理工作的专业价值,提升重症护理质量,促进患者康复。
[致谢] 感谢安徽医科大学第一附属医院心脏大血管外科二病区李鑫老师在本次研究过程中给予的指导和帮助!
