艳山姜挥发油自乳化释药系统的毒性及对Caco-2 细胞单层细胞旁转运与P-糖蛋白的影响
2023-06-08吴朝花甘诗泉沈祥春
吴朝花,何 丽,肖 婷,陈 英,甘诗泉,沈祥春*,陶 玲*
1. 贵州医科大学第二附属医院,贵州 凯里 556000
2. 贵州医科大学药学院 药用植物功能与应用国家重点实验室,贵州省天然药用资源高效利用工程中心,贵州 贵安新区 550025
3. 贵州医科大学药学院 药物药理教研室,贵州省天然药物药理与可药性高等教育重点实验室,贵阳市联合重点实验室,天然药物资源优化利用重点实验室,贵州 贵安新区 550025
艳山姜为姜科山姜属植物艳山姜Alpinia zerumbet(Pers.) Burtt. et Smith 的干燥成熟果实,其主要化学成分为挥发油类、黄酮类、二萜类和有机酸类等化合物。课题组前期对艳山姜主要活性部位进行了考察,结果表明,艳山姜挥发油(essential oil ofFructusAlpiniazerumbet,EOFAZ)为主要活性部位,具有抗心肌缺氧、抗动脉粥样硬化、降压作用和抗心肌缺血等药理作用[1-7]。EOFAZ 作为治疗心血管疾病的潜在药物,具有较大的开发和利用价值。但EOFAZ 为油状液体,水溶性差,易挥发,传统剂型严重限制了其在临床应用的发展。
自乳化释药系统(self-emulsifying drug delivery system,SEDDS)是由油相、乳化剂和助乳化剂以及药物组成,在胃肠道内通过胃肠道蠕动可自发乳化形成粒径透明、动力学稳定的药物传递系统[8],其具有增加药物表面积和溶解度,提高溶出度和渗透率,提高药物生物利用度,因而成为提高难溶药物溶出度和生物利用度方面的研究热点[9-12]。在前期研究中,课题组将EOFAZ 成功制备成EOFAZSEDDS[13]。然而SEDDS 处方中含有大量乳化剂,乳化剂可能会刺激胃肠道[14-17],同时乳化剂及其代谢产物在机体内引起的生物学变化,亦对机体可能造成的毒副作用包括急性毒性、亚急性毒性、慢性毒性等[18],另一方面,大剂量乳化剂可引起膜损伤和细胞死亡[19],此外,乳化剂还可通过改变肠粘膜屏障通透性等来影响药物渗透性[20],且本研究所用乳化剂Kolliphor HS 15 的安全剂量、耐受剂量其对肠黏膜屏障通透性的影响未见报道。因此,对EOFAZ-SEDDS 的安全性及其对肠黏膜屏障通透性的影响进行考察具有一定的必要性。
人结直肠腺癌Caco-2 细胞在培养条件下可形成完整致密的极性单细胞层,该细胞层的形态和功能类似人体小肠上皮层。已有研究证实Caco-2 细胞保留了P-糖蛋白(P-glycoprotein,P-gp)高表达的特性,可在有代谢状况下测定药物的跨膜转运[21-22],并且药物透过Caco-2 细胞的体外过程与药物口服后在体内的吸收和代谢有良好的相关性[23]。因此,Caco-2 细胞是快速筛选肠吸收和细胞毒性研究的可靠且广泛使用的体外模型。
P-gp 是由多药耐药基因1(multi-drug resistance gene l,MDR1)基因编码的三磷酸腺苷(adenosine triphosphate,ATP)能量依赖的多药耐药外排泵。肠道内的P-gp 可将其底物从肠上皮细胞泵回到肠腔而限制药物的吸收,因此P-gp 的功能和(或)表达的变化,可能影响药物的药动学参数,导致其生物利用度的改变,从而影响其吸收、分布、代谢、排泄和毒性,也会影响化合物与药物、药物与药物、食物与药物、草药与药物、草药与草药的相互作用[24-26]。
本研究在前期基础上进一步采用Caco-2 细胞考察EOFAZ-SEDDS 的细胞毒性,及其对Caco-2 细胞单层通透性和P-gp 表达及功能的影响;采用KM小鼠考察EOFAZ-SEDDS 的体内毒性,为EOFAZSEDDS 进一步开发和合理应用提供参考,为更好地合理利用艳山姜资源从而发挥贵州民族医药产业奠定一定的实验基础。
1 材料
1.1 动物和细胞
SPF 级昆明种小鼠,雌雄各半,体质量18~22 g,6~8 周龄,购自贵州医科大学动物中心,动物合格证号SCXK(黔)2017-0001,实验动物使用许可证号SYXK(黔)2017-0001。所有小鼠均自由摄食和饮水,适应性喂养7 d,室温保持在20~23 ℃,相对湿度保持在40%~70%。动物实验得到贵州医科大学伦理委员会批准(批准号No.1800459)。
Caco-2 细胞购自中国上海富恒细胞中心。
1.2 药材
艳山姜购自贵州省黔西南州贞丰县连环乡巧岩村,经贵州医科大学张旭副教授鉴定为艳山姜A.zerumbet(Pers.) Burtt. et Smith 的成熟果实,凭证标本编号20150930,保存于贵州医科大学药学院天然药物资源优化利用重点实验室(贵阳)。
1.3 药品与试剂
乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(批号A020-2)购自南京建成生物工程研究所;MTT(批号911L051)、罗丹明123(批号1214E051)购自北京索莱宝科技有限公司;P-gp 抗体(批号ab170904)购自英国Abcam 公司;甘油醛-3- 磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号60004-1-g)、二抗(批号SA00001-2)购自美国Proteintech 公司。
1.4 仪器
700-SERIES 型超低温冰箱、3020-426 型多功能全波长酶标仪(美国Thermo Fisher Scientific 公司);HF240型CO2培养箱(上海力申科学仪器有限公司);CFX 型凝胶成像系统(美国Bio-Rad 公司);5810R型冷冻离心机(德国Eppendorf公司);SIM-F140AY65型制冰机(日本SANYO 电子有限责任公司);NovoCyte 流式细胞仪(艾森生物杭州有限公司)。
2 方法
2.1 艳山姜挥发油的提取制备
将艳山姜干燥果实破碎至种子破裂,按《中国药典》2020 年版要求均匀取样,精密称取500 g,加12 倍蒸馏水浸泡1 h,按《中国药典》2020 年版四部通则2204 挥发油测定法提取7 h,收集挥发油,经无水硫酸钠干燥后,-20 ℃冰箱储存备用。艳山姜挥发油经GC-MS 检测,其主要化学成分为β-蒎烯、α-蒎烯、莰烯及1,8-桉叶油醇等,相对质量分数分别为29.549%、9.861%、3.112%、0.248%[27]。
2.2 EOFAZ-SEDDS 的制备
将EOFAZ 与表面活性剂Kolliphor HS 15、乙醇以6∶2∶2 的质量比混合,轻轻摇匀[13]。
2.3 细胞培养
将Caco-2 细胞于含有完全DMEM 培养液(含20%热灭活的胎牛血清、1%非必需氨基酸、1%L-谷氨酰胺、1%青霉素-链霉素)的塑料细胞培养瓶中培养。培养瓶置于37 ℃、5% CO2培养箱培养,每隔1 d 更换1 次培养液。当细胞融合度达到80%时,加入1 mL 0.25%胰蛋白酶-0.02% EDTA 混合消化液,轻轻摇晃培养瓶,放于培养箱中消化1 min,按1∶2 进行细胞传代。使用第20~40 代的细胞进行细胞毒性和转运实验。
2.4 细胞毒性实验
2.4.1 MTT 细胞活力实验 设置空白组(无细胞无药物)、对照组(无药物),EOFAZ(24、36、48、60、72、84 μg/mL)组,EOFAZ-SEDDS 组(40、60、80、100、120、140 μg/mL,分别含24、36、48、60、72、84 μg/mL 的EOFAZ),Kolliphor HS 15+无水乙醇组(16、24、32、40、48、56 μg/mL,相当于EOFAZ-SEDDS 各剂量组中Kolliphor HS 15 和无水乙醇混合物含量)。分别将各组与不同培养天数(1、3、5 d)的Caco-2 细胞温育,每个质量浓度设6 个平行孔,培养24 h。每孔加20 μL MTT(5 mg/mL)溶液,孵育4 h。吸弃各孔液体,加入150 μL 二甲基亚砜,低速振摇10 min,用酶标仪于490 nm 处测定吸光度(A)值,计算细胞存活率。
2.4.2 LDH 活力实验 设置对照组(无药物),EOFAZ(24、36、48、60、72、84 μg/mL)组,EOFAZSEDDS 组(40、60、80、100、120、140 μg/mL),Kolliphor HS 15+无水乙醇组(16、24、32、40、48、56 μg/mL)。收集对数生长期细胞,以4×105个/孔接种于6 孔板中,在37 ℃、CO2培养箱中培养5 d。分别将各组与Caco-2 细胞温育24 h。按照试剂盒说明书测定各样品的A值。
2.5 药物对Caco-2 细胞单层通透性的影响
2.5.1 Caco-2 单层细胞模型的建立 将 0.012 mg/mL 的鼠尾胶原蛋白加入12 孔Transwell 小室中,开盖在超净工作台中过夜晾干,或室温放置1 h后,用PBS 洗3~4 次后直接使用。取处于对数生长期的Caco-2 细胞,以1×105个/孔接种于12 孔Transwell 培养板中。在12 孔Transwell 培养板的细胞内侧(apical,AP)每孔加入0.5 mL DMEM 完全培养基,基底侧(basolateral,BL)每孔加入1.5 mL DMEM 培养基,在接种后的第1 周内隔天更换培养基,1 周后每天更换培养基,直至第21 天,用细胞电阻仪测定Caco-2 细胞的跨内皮细胞电阻(transepithelium electrical resistant,TEER)值。
2.5.2 EOFAZ-SEDDS 对荧光黄渗透性的影响 根据MTT 和LDH 活力实验结果,用培养基稀释EOFAZ、EOFAZ-SEDDS、无水乙醇和Kolliphor HS 15 混合物、Kolliphor HS 15、无水乙醇,得到无毒浓度的EOFAZ(24 μg/mL)、EOFAZ-SEDDS(40 μg/mL)、无水乙醇和Kolliphor HS 15 混合物(16 μg/mL)、Kolliphor HS 15(8 μg/mL)、乙醇(8 μg/mL)。取建模成功的Caco-2 单层细胞模型小心吸去培养基,细胞单层用37 ℃的Hank’s 缓冲液洗细胞表面3 次,每次5 min,以除去残余的培养基。洗涤后,AP 侧分别入含受试样品的Hank’s 缓冲液,并加入荧光黄(40 μg/mL),将1.5 mL 新鲜Hank’s缓冲液(pH 7.4、37 ℃)加到BL 侧中。在15、30、45、60、120 min 从BL 侧取出0.5 mL 样品,并同时补充同温同体积的空白Hank’s 缓冲液。用酶标仪在450 nm 的激发波长和520 nm 的发射波长下测量样品的荧光值,并计算荧光黄渗透量。
2.6 Western blotting 考察EOFAZ-SEDDS 对P-gp蛋白表达的影响
Caco-2 细胞以4×105个/孔接种于6 孔板中培养,细胞融合度达到80%~90%后分别加入环孢素A(1 μmol/L,阴性对照),维拉帕米(80 μmol/L,阳性对照)以及不同质量浓度的EOFAZ(6、12、24 μg/mL)、EOFAZ-SEDDS(10、20、40 μg/mL)、单一表面活性剂(2、4、8 μg/mL)、表面活性剂混合物(4、8、16 μg/mL),另设置不含药物的对照组。温育24 h 后,吸去培养液,用预冷的PBS 润洗3次,加入细胞裂解缓冲液,置于摇床上振摇20 min,收集细胞,4 ℃、12 000 r/min 离心20 min,吸取上清液,采用BCA 蛋白定量试剂盒测定蛋白浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入5%牛血清白蛋白的TBST 溶液,封闭1 h。分别加入P-gp(1∶1000)、GADPH(1∶10 000)抗体,4 ℃孵育过夜;漂洗3 次,每次10 min,加入二抗(1∶7000),孵育2 h,TBST 洗涤3次,使用ECL 化学发光试剂盒进行显色,然后将膜置于凝胶成像系统进行曝光,随后用Image-Lab 软件对数字图像进行量化。
2.7 罗丹明123 摄取法考察EOFAZ-SEDDS 对P-gp 功能的影响
精密称取0.2 mg 罗丹明123,用超纯水配成质量浓度为500 μmol/L 的罗丹明123 溶液。将处于对数生长期的Caco-2 细胞用胰酶消化,用含20%胎牛血清的DMEM 重悬为单个细胞,计数,4 ℃、1500 r/min 离心5 min,弃去上清,用PBS 分散成细胞密度为1×106个/mL 的细胞悬液,取0.5 mL 至1.5 mL EP 管中,1500 r/min 离心5 min,弃上清,分别加入0.5 mL 维拉帕米(50 μmol/L,阳性对照)以及不同质量浓度的EOFAZ(6、12、24 μg/mL)、EOFAZSEDDS(10、20、40 μg/mL)、单一表面活性剂(2、4、8 μg/mL)、表面活性剂混合物(4、8、16 μg/mL),另设置不含药物的对照组。于37 ℃、5% CO2培养60 min,置冰上终止转运,4 ℃、2500 r/min 离心5 min,弃上清,用预冷的PBS 洗涤2 次,离心后弃上清。加入罗丹明123,37 ℃、5% CO2培养60 min,置冰上终止作用,4 ℃、2500 r/min 离心5 min,弃上清,用预冷的PBS 洗涤2 次,离心后弃上清,加入0.5 mL PBS 轻轻吹打,制成单个细胞悬液(1×104个细胞)。采用流式细胞术测定检测胞内罗丹明123 平均荧光强度(激发波长为488 nm、发射波长为535 nm)。
2.8 EOFAZ-SEDDS 的小鼠急性毒性试验
2.8.1 最高致死量和最低致死量的试验研究 预试验目的是为了找出引起动物LD0和100%(LD100)死亡的剂量,以便安排正式实验。取小鼠20 只,体重18~22 g,每个试验组4 只动物,雌雄各半,进行预试验[28]。给药前小鼠禁食不禁水过夜,一次性口服不同剂量的EOFAZ-SEDDS,测定最大耐受剂量(LD0)、绝对致死量(LD100)。预试验结果表明,小鼠口服制剂的LD0和LD100分别为4 g/kg 和7 g/kg,组间剂量比为1∶1.150 1。
2.8.2 小鼠急性毒性试验研究 根据预试验获得的最高致死量和最低致死量对正式试验进行分组,共5 组,每组试验动物10 只,雌雄各半。给药最高剂量为7 g/kg,给药前小鼠禁食不禁水过夜,给药后立刻观察小鼠的外观体征、饮食欲、行为活动、大小便、中枢神经系统症状、呼吸系统等情况,死亡情况,给药后连续观察14 d。对在试验中死亡的动物以及试验结束时处死的动物进行解剖,对组织器官出现的体积、颜色等改变进行详细记录。根据每组药物各剂量动物的死亡数,用。按Bliss 机率单位法计算半数致死剂量(median lethal dose,LD50)及其95%可信限评估EOFZA-SEDDS 制剂对小鼠的急性毒性。给药后逐日观察并记录中毒反应、死亡率和死亡情况。给药后连续观察14 d。对在试验中死亡的动物以及试验结束时处死的动物进行解剖,对组织器官出现的体积、颜色等改变进行详细记录。
2.9 统计学分析
3 结果
3.1 细胞毒性实验
3.1.1 MTT 细胞活力实验 如图1 所示,与对照组比较,无水乙醇与Kolliphor HS 15 混合物在16~56 μg/mL(相当于60~140 μg/mL 的EOFAZ-SEDDS中所含混合乳化剂的量)对培养5 d Caco-2 细胞存活率没有影响,但显著增加培养1、3 d 的Caco-2 细胞存活率(P<0.05、0.01)。与EOFAZ 组比较,EOFAZ-SEDDS 处理培养1、3、5 d 的Caco-2 细胞24 h 后细胞存活率均显著升高(P<0.05、0.01),表明 EOFAZ 的细胞毒性比含有等量 EOFAZ 的SEDDS 的细胞毒性大,说明将EOFAZ 制备成SEDDS 后降低了EOFAZ 的细胞毒性,乳化剂混合物对细胞活力没有影响。

图1 EOFAZ-SEDDS 对培养1 (A)、3 (B)、5 d (C) 的Caco-2 细胞活力的影响 (±s, n = 3)Fig. 1 Effect of EOFAZ-SEDDS on cell viability of Caco-2 cells cultured for 1 (A), 3 (B), 5 d (C) (±s, n = 3)
3.1.2 LDH 活力实验 如图2 所示,与对照组比较,EOFAZ(24~84 μg/mL)、EOFAZ-SEDDS(60~140 μg/mL)、乳化剂混合物(48~56 μg/mL)显著升高细胞LDH 外漏率(P<0.05、0.01)。与EOFAZ组比较,EOFAZ-SEDDS(60~140 μg/mL)组LDH外漏率显著降低(P<0.05、0.01);与EOFAZ-SEDDS组比较,乳化剂混合物(24~56 μg/mL)组LDH 外漏率显著降低(P<0.05、0.01)。表明高浓度乳化剂混合物可损伤细胞膜,将EOFAZ 制备成EOFAZSEDDS 降低了EOFAZ 的细胞毒性。

图2 EOFAZ-SEDDS 对Caco-2 细胞LDH 外漏率的影响 (±s, n = 3)Fig. 2 Effect of EOFAZ-SEDDS on leakage rate of LDH in Caco-2 cells (±s, n = 3)
3.2 药物对Caco-2 细胞单层通透性的影响
3.2.1 Caco-2 单层细胞模型的建立 培养21 d 后Caco-2 细胞的TEER 值>1000 Ω·cm2,细胞单层膜的AP 侧和BL 侧培养基中碱性磷酸酶的活力比大于3∶1,荧光黄由细胞膜单层AP 侧的表观渗透系数(apparent permeability coefficient,Papp)值为(3.57±1.75)×10-7cm/s,说明细胞单层的紧密性良好,满足实验要求。
3.2.2 EOFAZ-SEDDS 对荧光黄渗透性的影响 如图3 所示,EOFAZ、EOFAZ-SEDDS、无水乙醇和Kolliphor HS 15 混合物、Kolliphor HS 15 和无水乙醇可以影响细胞旁通透性,进而影响肠吸收。

图3 药物对Caco-2 单层的荧光黄渗透性的影响 (±s,n = 3)Fig. 3 Effect of samples on Lucifer yellow permeability of Caco-2 monolayer (±s, n = 3)
3.3 Western blotting 考察EOFAZ-SEDDS 对P-gp蛋白表达的影响
如图4 所示,与对照组比较,EOFAZ(12、24 μg/mL)组Caco-2 细胞中P-gp 蛋白表达水平显著降低(P<0.05),EOFAZ-SEDDS(10、20、40 μg/mL)组、Kolliphor HS 15(8 μg/mL)组、无水乙醇(2、4、8 μg/mL)组、Kolliphor HS 15+无水乙醇混合物(8 μg/mL)组P-gp 蛋白表达水平显著升高(P<0.05、0.01)。表明EOFAZ 可抑制P-gp 的表达,而EOFAZSEDDS、Kolliphor HS 15、无水乙醇、Kolliphor HS 15 和无水乙醇混合物均可诱导P-gp 的表达。

图4 EOFAZ-SEDDS 对P-gp 蛋白表达的影响 (±s, n = 3)Fig. 4 Effect of EOFAZ-SEDDS on P-gp protein expression (±s, n = 3)
3.4 罗丹明123 摄取法考察EOFAZ-SEDDS 对P-gp 功能的影响
如图5 所示,与对照组比较,EOFAZ(6、12、24 μg/mL)组、EOFAZ-SEDDS(40 μg/mL)组细胞内罗丹明123 荧光强度显著增加(P<0.05),Kolliphor HS 15、无水乙醇、Kolliphor HS 15+无水乙醇混合物在所考察浓度范围内对细胞内罗丹明123 的荧光强度增强作用与对照组比较无显著性差异。表明EOFAZ 和高剂量的EOFAZ-SEDDS 均对P-gp 外排功能具有抑制作用,低、中剂量的EOFAZSEDDS、Kolliphor HS 15 与无水乙醇混合物、单独Kolliphor HS 15 和无水乙醇对P-gp 外排功能没有影响。
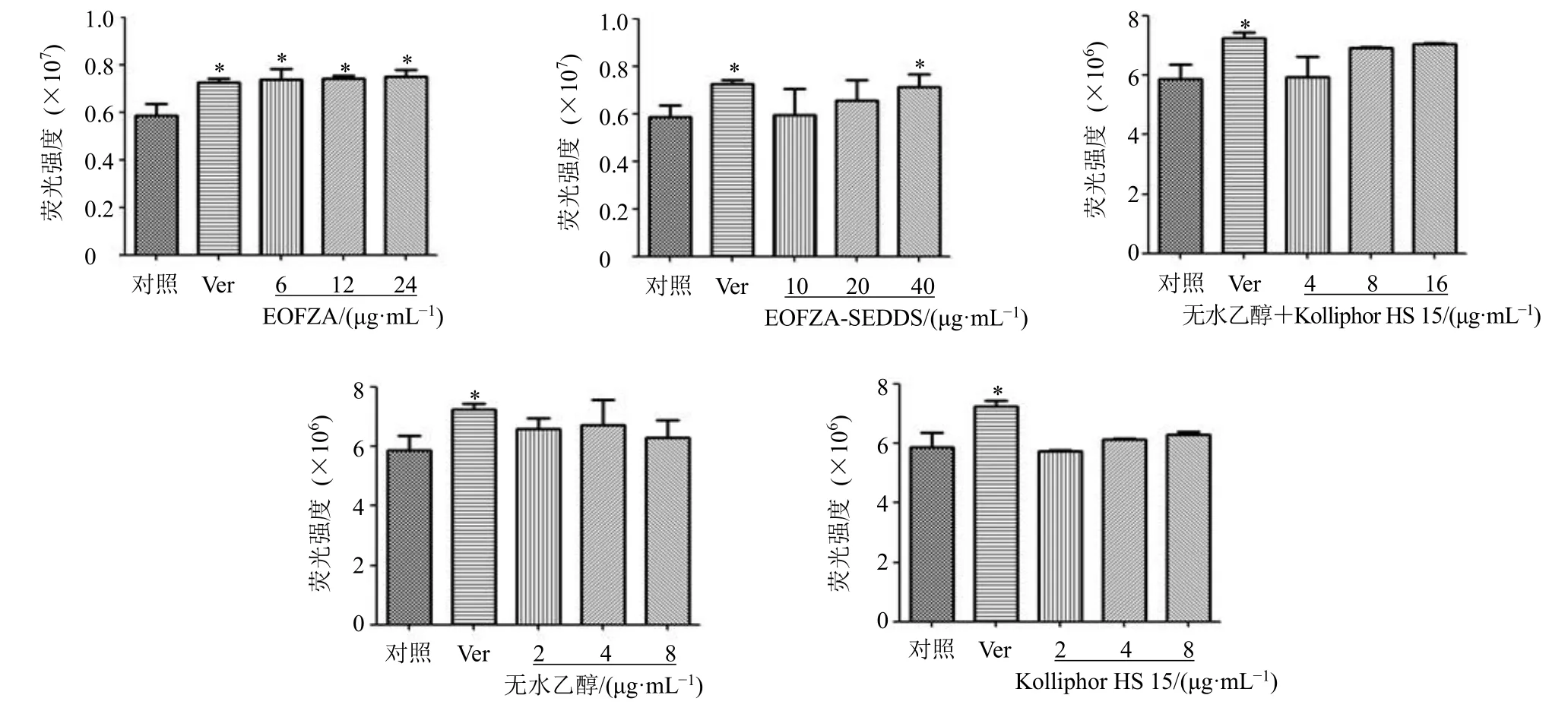
图5 EOFAZ-SEDDS 对P-gp 功能的影响 (±s, n = 3)Fig. 5 Effect of EOFAZ-SEDDS on P-gp function (±s, n = 3)
3.5 EOFAZ-SEDDS 的小鼠急性毒性试验
小鼠口服EOFAZ-SEDDS 制剂正式试验结果发现,小鼠口服制剂的LD50为5.291 5 g/kg,LD50的95%可信限为4.927 8~5.682 1 g/kg(表1)。在小鼠口服EOFAZ-SEDDS 制剂给药后,出现自主活动、探究、梳理、运动减少,同时出现嗜睡、僵住、强直性惊厥、震颤、俯卧、共济失调、呼吸急促、呼吸困难、呼吸暂停、饮食欲下降、水样便、尿失禁、流泪等症状,但停药后恢复正常。将死亡后小鼠剖检可见心、肝、脾、肺、肾的体积和颜色未发现任何异常改变。
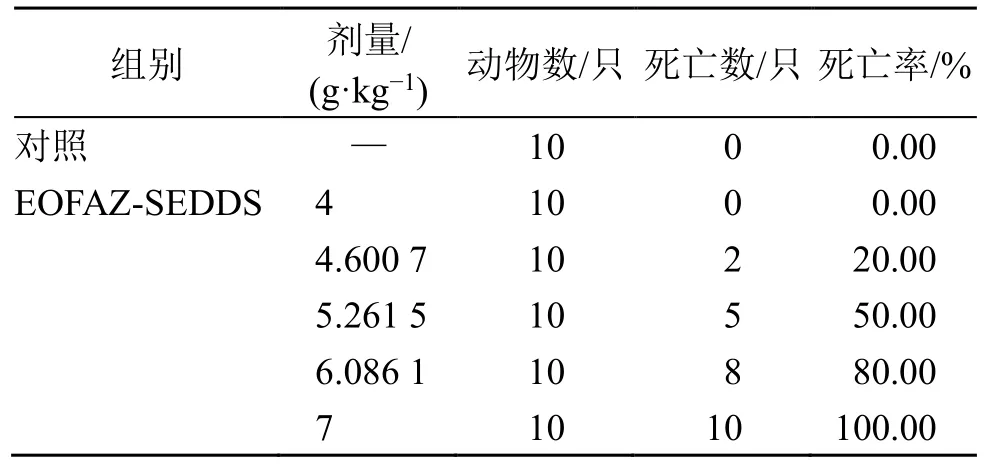
表1 EOFAZ-SEDDS 对小鼠的急性毒性试验结果Table 1 Acute toxicity test results of EOFAZ-SEDDS in mice
4 讨论
Caco-2 细胞广泛用作研究药物肠道渗透和评价细胞毒性的体外模型,但在报道的细胞培养方案中仍存在相当大的差异。关键细胞培养参数的变化如培养持续时间,对Caco-2 细胞群的形态和功能特性有直接影响[29-30]。对于在细胞毒性和渗透试验中使用的细胞的成熟度也没有统一标准。Bu 等[31]证明具有不同融合度和成熟度的Caco-2 细胞对相同的药物表现出不同的敏感性。故在本研究MTT 实验中建立了一系列具有相同初始接种密度但不同培养持续时间的Caco-2 细胞。结果表明EOFAZ 处理培养不同天数的Caco-2 细胞24 h 后细胞存活率均显著低于EOFAZ-SEDDS。与EOFAZ 相比,Caco-2 细胞对EOFAZ-SEDDS 产生显著耐受性,推测可能是由于EOFAZ 留在胃肠道中形成的微乳液的乳滴中,从而限制其与肠细胞膜的接触,从而降低其细胞毒性。MTT 结果表明,与对照组比较,16~56 μg/mL表面活性剂对Caco-2 细胞没有显示出任何毒性作用;而LDH 实验结果表明,48~56 μg/mL 表面活性剂对细胞的毒性具有显著性统计学意义。导致MTT 和LDH 测定结果差异的原因可能是两者测定原理不同所致。
LDH 渗漏是细胞膜损伤的细胞毒性研究的经典生物标志物,当细胞损伤时,发生细胞凋亡或坏死而造成细胞膜结构破坏,导致细胞膜通透性改变,导致细胞质内的LDH 释放到培养液中,因此LDH法通过检测从细胞中释放到培养液中的LDH 的活性,对细胞毒性进行定量分析[32]。MTT 检测原理主要基于在线粒体中MTT 的酶促转化,活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT 还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能,在一定细胞数范围内,MTT 结晶形成的量与存活细胞数呈正相关。Sambuy 等[33]证明表面活性剂的细胞毒性机制不是线粒体呼吸的抑制,而是通过影响膜完整性导致膜组分的溶解,进而产生细胞毒性。因此本研究LDH 结果显示乳化剂混合物可损伤细胞膜,而MTT 检测结果显示乳化剂混合物对细胞线粒体没有影响。
本研采用Caco-2 细胞单层模型考察EOFAZ、EOFAZ-SEDDS、Kolliphor HS 15、无水乙醇、无水乙醇和Kolliphor HS 15 混合物对细胞旁通透性的影响,结果表明,EOFAZ、EOFAZ-SEDDS、无水乙醇和Kolliphor HS 15 混合物、单独的Kolliphor HS 15和无水乙醇均可显著增加细胞旁通透性。而用于荧光黄渗透性实验的EOFAZ、赋形剂或SEDDS 的浓度均为安全浓度,表明EOFAZ、赋形剂或SEDDS的渗透增强作用可能不是由细胞毒性引起的,即EOFAZ、赋形剂、SEDDS 改变细胞单层屏障功能可能是由于损伤细胞间紧密连接所致。已有研究表明乙醇作用后肠上皮屏障通透性增加达到峰值后又逐渐恢复,乙醇是通过短暂性破坏细胞紧密连接的完整性进而增加肠上皮屏障通透性[34]。然而对于EOFAZ、Kolliphor HS 15 或SEDDS 的渗透增强作用是否可逆有待进一步研究。因此,当EOFAZ、EOFAZ-SEDDS 与被动转运药物(如阿昔莫司)联合用药时,可能会增加被动转运药物的生物利用度。
本研究使用Caco-2 单层作为小肠模型评估了EOFAZ、EOFAZ-SEDDS 或赋形剂对肠P-gp 表达和功能的影响。结果表明EOFAZ 可抑制P-gp 的功能和表达,EOFAZ-SEDDS 诱导P-gp 的表达,低、中剂量的EOFAZ-SEDDS 对P-gp 的功能没有影响,只有高剂量的EOFAZ-SEDDS 抑制P-gp 外排功能;乳化剂虽然诱导了P-gp 的表达但对其功能没有影响。由此可见,在一定的浓度范围内EOFAZ-SEDDS虽然诱导了P-gp 的表达但其外排功能并没有增加,这可能与Caco-2 细胞表面新近表达的P-gp 功能缺失有关,研究表明新表达的P-gp 需要大约10 d 的时间才能发挥其全部功能[35]。另一方面可能是因为EOFAZ 停留在形成的微乳液的乳滴中,因此减弱了EOFAZ 对P-gp 功能的抑制作用,当浓度较高时,乳液中游离的EOFAZ 达到一定浓度才发挥了其对P-gp 功能的抑制作用。因此EOFAZ 或较大剂量的EOFAZ-SEDDS 抑制P-gp 的功能增强P-gp 底物的口服吸收,长期应用EOFAZ 或较大剂量的EOFAZSEDDS 可能通过抑制肠道以及其他器官P-gp 的功能而降低P-gp 的活性,改变其他P-gp 底物的生物利用度。
小鼠口服EOFAZ-SEDDS 制剂正式试验结果发现EOFAZ-SEDDS 对小鼠实际无毒。在急性毒性实验中,受试物的给药容量受试验动物胃的内容物的影响,若给药途径为口服给药,小鼠和大鼠在给药前须禁食,可自由饮水。啮齿动物禁食时间的长短也会影响药物代谢酶的活性以及受试物在肠道中的吸收,所以小鼠和大鼠在给药前须严格禁食12 h,给药时间最好在上午。在口服药品的急性毒性试验中,给药体积也会影响受试药物的吸收,从而影响动物死亡率,故本研究选择适宜的给药体积,使每只动物在给药容量上相等。
综上,EOFAZ-SEDDS 对小鼠实际无毒,此外制备所得的EOFAZ-SEDDS 可以降低EOFAZ 的细胞毒性,但改变Caco-2 细胞单层屏障功能,同时诱导P-gp 表达,在一定浓度范围内对P-gp 功能没有影响。本研究有待于进一步观察EOFAZ-SEDDS 作用后,P-gp 表达程度与其活性之间的相关性是否与Caco-2 细胞表面新近表达的P-gp 功能缺失有关,以为临床合理用药提供实验性参考依据。
利益冲突所有作者均声明不存在利益冲突
