人参皂苷Re 对鱼藤酮致SH-SY5Y 细胞帕金森病模型的保护作用机制
2023-06-08赵文学刘冬光朱建国姚景春张贵民
赵文学,徐 燕#,刘冬光,孟 雪*,朱建国,姚 茹,姚景春,张贵民*
1. 鲁南制药集团股份有限公司 新药药理中心,山东 临沂 276006
2. 中药制药共性技术国家重点实验室,山东 临沂 276006
帕金森病(Parkinson’s disease,PD)是发病率仅次于阿尔茨海默病的神经退行性疾病,以其在老年人群中的高发性和对社会的危害性而倍受关注,主要表现为震颤、肌肉强直、运动迟缓和姿势反射障碍等,严重影响患者的生活能力[1-2]。PD 确切的致病机制尚不明确,随着对PD 致病机制的不断探索,线粒体功能障碍与氧化应激学说已逐渐证实在PD 的发生和发展中扮演者重要角色,抑制PD 模型中的线粒体功能损伤与氧化应激已成为当前抵抗PD 的重要策略[3-5]。目前临床对于PD 的治疗主要采取对症治疗,当下复方左旋多巴(levodopa,LDOPA)为治疗PD 的最佳方案,但由于其严重的不良反应,给PD 的药物治疗前景蒙上了阴影[6]。因此,探寻不良反应小的有效治疗药物已成为PD 研究的首要问题。
中药资源丰富,从天然产物中筛选出疗效确切、安全无毒防治PD 的药物具有得天独厚的优势[7]。人参皂苷Re 作为“百草之王”人参PanaxginsengC. A. Mey.中重要的活性成分,属于四环三萜类衍生物,已被证明具有突出的神经保护作用。据报道,人参皂苷Re 对1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)阳离子诱导的人骨髓神经母细胞瘤SH-SY5Y 细胞损伤具有明显的保护作用,人参皂苷Re 也可挽救PTEN 诱导性激酶蛋白-1(PTEN induced putative kinase-1,Pink-1)特异性缺失导致的线粒体电子传递链复合物IV 活力改变,人参皂苷Re 还可逆转PD小鼠多巴胺神经元凋亡一系列调控基因和蛋白的异常表达来实现多巴胺神经元的保护作用,如减少诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),从而减少一氧化氮(nitric oxide,NO)的生成,下调PD 小鼠黑质部促凋亡蛋白p53 的表达,抑制MPTP 诱导小鼠黑质星形胶质细胞增生、调节脑内阿片肽和抗黑质多巴胺能神经元凋亡等[8-11]。课题组前期已对人参皂苷Re 在PD 发生及发展过程中的作用途径进行了初步探索[12],本研究旨在深入剖析人参皂苷Re 潜在的神经保护作用途径及作用机制,为人参类中药防治PD 供科学依据。
1 材料
1.1 细胞
SH-SY5Y 细胞购自东莞赛尔生物科技有限公司。
1.2 药品与试剂
人参皂苷Re(批号B21055,质量分数≥98%)购自源叶生物科技(上海)有限公司;L-DOPA(批号B21710)购自源叶生物科技(上海)有限公司;鱼藤酮(批号MB5842)购自大连美仑生物技术有限公司;Annexin V-FITC(批号556547)购自美国BD 公司;CCK-8 试剂盒(批号AR1199)、线粒体蛋白提取试剂盒(批号C3601)、细胞核蛋白抽提试剂盒(批号P0028)、线粒体膜电位(mitochondrial membrane potential,MMP)检测试剂盒(批号C2008S)、细胞周期检测试剂盒(批号C1052)、活性氧(reactive oxygen species,ROS)检测试剂盒(批号S0033S)、三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒(批号S0027)均购自上海碧云天生物技术有限公司;β-actin 抗体(批号3700S)、二抗(批号14708S)、Parkin 抗体(批号4211S)、Pink-1 抗体(批号6946S)、B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号15071S)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)抗体(批号14796S)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号9662S)、cleaved Caspase3 抗体(批号9664S)、细胞色素C(cytochrome C,Cyt-C)抗体(批号4280S)、核因子E2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗体(批号12721S)、血红素氧合酶-1(heme oxygenase-1,HO-1)抗体(批号26416S)、谷氨酸半胱氨酸连接酶亚基(glutamatecysteine ligase catalytic subunit,GCLC)抗体(批号48005S)、还原型烟酰胺腺嘌呤二核苷酸磷酸( nicotinamide adenine dinucleotide phosphate ,NADPH)醌氧化还原酶-1(NADPH quinine oxidoreductase-1,NQO-1)抗体(批号3187S)均购自美国CST 公司;牛血清白蛋白(bovine serum albumin,BSA,批号A1933)购自默克(中国)有限公司;Seahorse XF 细胞线粒体压力测试试剂盒(批号103015-100)、Seahorse XF 糖酵解速率测定试剂盒(批号103344-100)均购自美国Agilent 公司。
1.3 仪器
AMF5000 型EVOS™成像系统、371 型CO2培养箱、1410101 型Multiskan™ FC 酶标仪(美国Thermo Fisher Scientific 公司);PL203 型天平、S210型pH 计(梅特勒托利多有限公司);SX-700 型高压蒸汽灭菌锅(上海博讯实业有限医疗设备厂);WP-UP-YJ-40 型号超纯水机(沃特浦);1645050 型电泳仪(美国Bio-Rad 公司);FL1000 型蛋白成像系统(上海哈灵生物技术有限公司);Amnis FlowSight 流式细胞仪(美国Merck 公司);Seahorse XF HS Mini 能量代谢分析仪(美国Agilent 公司)。
2 方法
2.1 细胞培养
SH-SY5Y 细胞用含10%胎牛血清、1%双抗的DME/F12 培养基,于37 ℃、5% CO2培养箱中培养。
2.2 PD 细胞模型的构建及人参皂苷Re、L-DOPA安全浓度的摸索
取对数生长期的SH-SY5Y 细胞以2×104/孔接种于96 孔板,待其融合度达到70%时,加入预先配制好的0.1、0.2、0.3、0.4、0.5、1.0 μmol/L 的鱼藤酮工作液处理12、24、48 h,随后按CCK-8 试剂盒操作说明检测各孔吸光度(A)值,计算细胞存活率,筛选出鱼藤酮的最适建模浓度及最佳建模时间。
取对数生长期的SH-SY5Y 细胞以2×104/孔接种于96 孔板,待其融合度达到70%时,加入预先配制好的2.5、5、10、20、40、60 μmol/L 的人参皂苷Re 工作液处理24 h,随后按CCK-8 试剂盒操作说明检测各孔A值,计算细胞存活率,筛选出人参皂苷Re 的安全浓度。
取对数生长期的SH-SY5Y 细胞以2×104/孔接种于96 孔板,待其融合度达到70%时,加入预先配制好的2.5、5、10、20、40 μmol/L 的L-DOPA 工作液处理24 h,随后按CCK-8 试剂盒操作说明检测各孔A值,计算细胞存活率,筛选出L-DOPA 的安全浓度。
2.3 人参皂苷Re、L-DOPA对鱼藤酮诱导的SH-SY5Y细胞活力的影响
取对数生长期的SH-SY5Y 细胞以2×104/孔接种于96 孔板,待其融合度达到70%时,设置对照组、模型组、L-DOPA(2.5、5、10 μmol/L)组和人参皂苷Re(2.5、5 μmol/L)组,模型组和各给药组加入0.3 μmol/L 鱼藤酮,各给药组再加入相应药物,对照组加入不含药物的培养基,处理24 h。按CCK-8试剂盒操作说明检测各孔A值,计算细胞存活率。
2.4 细胞周期的检测
取对数生长期的SH-SY5Y 细胞以4×104/孔接种于6 孔板,待其融合度达到70%时,设置对照组、模型组、L-DOPA(10 μmol/L)组和人参皂苷Re(2.5、5 μmol/L)组,模型组和各给药组加入0.3 μmol/L 鱼藤酮,各给药组再加入相应药物,对照组加入不含药物的培养基,处理24 h。按细胞周期试剂盒操作说明加入RNase/PI 染色工作液,通过Amnis 流式细胞仪检测各组细胞在G1、S、G2期的含量分布。
2.5 细胞凋亡检测
取对数生长期的SH-SY5Y 细胞以4×104/孔接种于6 孔板,待其融合度达到70%时,按“2.4”项下方法分组并给药,胰蛋白酶消化收集细胞并用预冷的PBS 漂洗,4 ℃、1500 r/min 离心10 min,弃上清,用500 μL 1×Binding Buffer 重悬细胞,加入5 μL 的Annexin V-FITC 与5 μL 的碘化丙啶(PI)染液,混匀后避光静置15 min,通过流式细胞仪检测各组细胞凋亡水平。
2.6 细胞能量代谢检测
2.6.1 细胞线粒体压力测定 取对数生长期的SHSY5Y 细胞以2×104/孔接种于XF 细胞培养板中,待其融合度达到70%时,按“2.4”项下方法分组并给药,弃去培养液,每孔加入200 μL XF RPMI 培养液,弃去,反复清洗3 次后加入XF RPMI 培养液,使各孔终体积为180 μL,放于37 ℃无CO2培养箱中静置1 h,随后按细胞线粒体压力测定试剂盒操作说明上机检测。
2.6.2 细胞糖酵解速率测定 取对数生长期的SHSY5Y 细胞以2×104/孔接种于XF 细胞培养板中,待其融合度达到70%时,按“2.4”项下方法分组并给药,弃去各孔培养液,每孔加入200 μL XF RPMI培养液,弃去,反复清洗3 次后加入XF RPMI 培养液,使各孔终体积为180 μL,放于37 ℃无CO2培养箱中静置1 h,随后按细胞糖酵解测定试剂盒操作说明上机检测。
2.7 线粒体功能检测
2.7.1 MMP 的检测 取对数生长期的SH-SY5Y 细胞以4×104/孔接种于6 孔板,待其融合度达到70%时,按“2.4”项下方法分组并给药,胰蛋白酶消化收集细胞,并用预冷的PBS 漂洗,4 ℃、1500 r/min离心10 min,弃上清,用1 mL 罗丹明123 染色工作液重悬细胞,37 ℃避光孵育30 min,1500 r/min离心5 min,弃上清加入适量PBS 重悬细胞,通过流式细胞仪检测各组细胞MMP 的变化[13]。
2.7.2 细胞内ROS 检测 取对数生长期的SHSY5Y 细胞以4×104/孔接种于6 孔板,待其融合度达到70%时,按“2.4”项下方法分组并给药,按ROS试剂盒操作说明对各组细胞进行染色,通过荧光显微镜及流式细胞仪检测各组细胞ROS 含量的变化。
2.7.3 细胞内ATP 含量检测 取对数生长期的SHSY5Y 细胞以4×104/孔接种于6 孔板,待其融合度达到70%时,按“2.4”项下方法分组并给药,弃去培养基,按ATP 检测试剂盒操作说明使用酶标仪检测细胞内ATP 含量的变化。
2.8 线粒体相关蛋白表达的检测
2.8.1 免疫荧光检测Parkin、Pink-1 表达 取对数生长期的SH-SY5Y 细胞以4×104/孔接种于6 孔板,待其融合度达到70%时,按“2.4”项下方法分组并给药,PBS 缓慢清洗各孔细胞,加入适量4%多聚甲醛,于37 ℃固定20 min,弃去多聚甲醛并用PBS 清洗各孔细胞,加入0.5% TritonX-100 置于37 ℃孵育15 min,PBS 洗涤后加入5% BSA 封闭30 min,加入配制好的一抗,4 ℃孵育过夜,次日弃去一抗,加入相应二抗,室温孵育1 h,PBS 清洗后加入适量DAPI 染色20 min,通过荧光显微镜观察Parkin、Pink-1 阳性表达情况。
2.8.2 Western blotting 检测Parkin、Pink-1、Bax、Bcl-2、cleaved Caspase-3、Caspase-3、Cyt-C、Nrf2、HO-1、GCLC 和NQO1 蛋白表达
(1)蛋白提取:取对数生长期的SH-SY5Y 细胞以4×104/孔接种于6 孔板,待其融合度达到70%时,设置对照组、模型组和人参皂苷Re(2.5、5 μmol/L)组,模型组和各给药组加入0.3 μmol/L 鱼藤酮,各给药组再加入相应药物,对照组加入不含药物的培养基,处理24 h。弃去培养基,用PBS 洗涤1 遍,用胰蛋白酶消化细胞,4 ℃、1200 r/min 离心5 min 收集细胞,弃上清,PBS 洗涤2 次,按线粒体蛋白提取试剂盒说明书提取线粒体蛋白,按细胞核蛋白抽提试剂盒说明书提取细胞核蛋白。
(2)Western blotting 检测:采用BCA 蛋白浓度测定试剂盒检测蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,封闭后加入一抗,4 ℃孵育过夜,次日PBST 洗膜后加入二抗,室温孵育2 h,PBST 洗膜后加适量ECL 荧光剂显影,分析条带灰度值。
2.9 统计学分析
3 结果
3.1 鱼藤酮建模浓度及建模时间的确定
如图1 所示,与对照组比较,SH-SY5Y 细胞给予不同浓度的鱼藤酮处理12、24、48 h 后,细胞存活率呈剂量和时间相关性地降低。0.3 μmol/L 鱼藤酮处理24 h 后,细胞存活率为(51.67±4.22)%,处理48 h 与24 h 相比,细胞存活率无显著性变化,因此选择0.3 μmol/L 处理24 h 作为鱼藤酮的最佳建模浓度及建模时间。

图1 鱼藤酮对SH-SY5Y 细胞存活率的影响 (±s, n = 3)Fig. 1 Effect of rotenone on survival rate of SH-SY5Y cells(±s, n = 3)
3.2 人参皂苷Re 安全浓度的确定及对鱼藤酮诱导SH-SY5Y 细胞损伤的保护作用
如图2 所示,SH-SY5Y 细胞给予不同浓度的人参皂苷Re 处理后,当人参皂苷Re 的浓度达到10 μmol/L 时,细胞存活率明显下降(P<0.05),且呈剂量相关性,因此选择2.5、5 μmol/L 的人参皂苷Re进行后续实验。SH-SY5Y 细胞给予不同浓度的Ldopa 处理后,当L-DOPA 浓度达到20 μmol/L 时,细胞存活率明显下降(P<0.05),且呈剂量相关性,因此选择2.5、5、10 μmol/LL-DOPA 进行后续考察。

图2 人参皂苷Re 及L-DOPA 对鱼藤酮诱导的SH-SY5Y 细胞存活率的影响 (±s, n = 3)Fig. 2 Effects of ginsenoside Re and L-DOPA on survival rate of SH-SY5Y cells induced by rotenone (±s, n = 3)
SH-SY5Y 细胞经鱼藤酮诱导损伤后,细胞存活率显著下降(P<0.01);给予2.5、5 μmol/L 人参皂苷Re 或5、10 μmol/LL-DOPA 处理后,细胞存活率明显上升(P<0.05、0.01),其中5 μmol/L 人参皂苷Re 与10 μmol/LL-DOPA 作用效果相比无差异,由此可得出人参皂苷Re 对鱼藤酮诱导的细胞毒性具有良好的改善作用。
3.3 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞周期的影响
如表1 所示,与对照组比较,模型组G0/G1期细胞比例显著升高(P<0.01),S 期与G2/M 期细胞比例显著降低(P<0.01),表明鱼藤酮可诱导SHSY5Y 细胞出现明显的G1期阻滞作用;与模型组比较,各给药组G0/G1期细胞比例显著降低(P<0.05、0.01),S 期与G2/M 期细胞比例显著升高(P<0.05、0.01),以5 μmol/L 人参皂苷Re 作用效果最为显著,表明人参皂苷Re 可显著缓解鱼藤酮诱导SHSY5Y 细胞周期的改变。
表1 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞周期的影响 (±s, n = 3)Table 1 Effect of ginsenoside Re on cell cycle of SH-SY5Y cells induced by rotenone (±s, n = 3)

表1 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞周期的影响 (±s, n = 3)Table 1 Effect of ginsenoside Re on cell cycle of SH-SY5Y cells induced by rotenone (±s, n = 3)
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01,表2 同**P < 0.01 vs control group; #P < 0.05 ##P < 0.01 vs model group, same as table 2
组别 剂量/(μmol·L-1) 细胞周期G0/G1/% S/% G2/M/%对照 — 21.62±2.03 41.83±3.44 30.75±2.68模型 — 57.49±2.41** 10.69±2.87** 12.78±2.28**L-DOPA 10 37.28±2.15## 22.67±3.87# 20.29±1.73#人参皂苷Re 2.5 49.25±2.08# 16.83±1.59# 18.12±1.92#5 32.56±2.67## 27.70±3.12## 24.51±1.62##
3.4 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞凋亡的影响
鱼藤酮可诱导细胞损伤,从而导致细胞发生G0/G1期阻滞,诱发细胞凋亡,因此接下来检测给药前后细胞凋亡的变化,如图3 所示,与对照组比较,模型组细胞凋亡率显著升高(P<0.01);与模型组比较,各给药组细胞凋亡率均显著下降(P<0.01)。
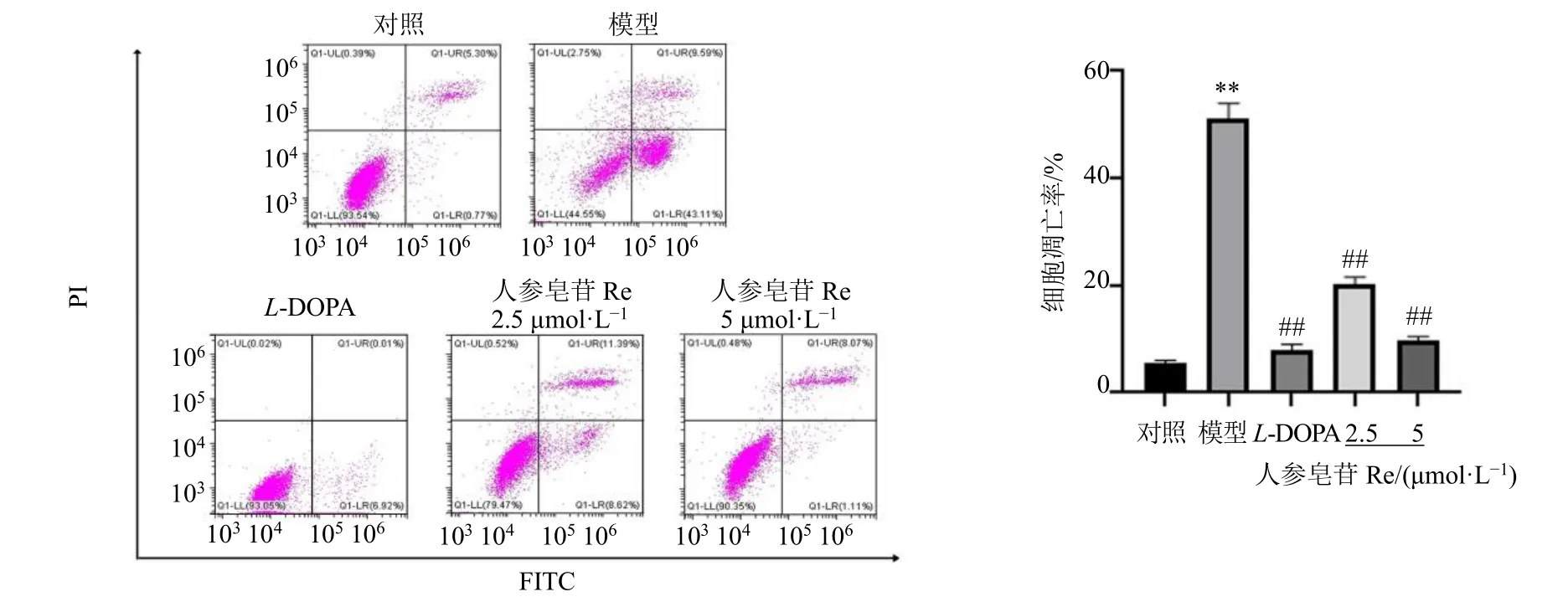
图3 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞凋亡的影响 (±s, n = 3)Fig. 3 Effect of ginsenoside Re on apoptosis of SH-SY5Y cells induced by rotenone (±s, n = 3)
3.5 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞糖酵解功能及线粒体氧化磷酸化功能的影响
接下来对细胞糖酵解及线粒体氧化磷酸化功能进行检测,如图4-A、C 所示,与对照组比较,模型组细胞内糖酵解PER 值显著降低(P<0.01);与模型组比较,各给药组细胞内糖酵解PER 值明显升高(P<0.05、0.01)。如图4-B、D 所示,与对照组比较,模型组细胞的最大呼吸能力、备用呼吸能力及ATP 合成能力均显著降低(P<0.01),质子漏显著增加(P<0.01),从而造成线粒体功能损伤;与模型组比较,各给药组细胞的最大呼吸能力、备用呼吸能力及ATP 合成能力均显著增强(P<0.01),质子漏降低(P<0.05、0.01),其中以5 μmol/L 人参皂苷Re 作用效果最为显著。
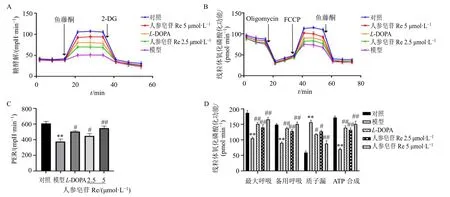
图4 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞能量代谢的影响 (±s, n = 3)Fig. 4 Effect of ginsenoside Re on energy metabolism of SH-SY5Y cells induced by rotenone (±s, n = 3)
3.6 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞线粒体功能紊乱的保护作用
3.6.1 人参皂苷Re 对细胞MMP 的保护作用 接下来对线粒体功能进行一致性评价,首先检测MMP水平的变化,如图5 所示,与对照组比较,模型组胞内MMP 水平显著降低(P<0.01);与模型组比较,各给药组细胞内MMP 明显升高(P<0.05、0.01),以5 μmol/L 人参皂苷Re 作用最为显著。

图5 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞MMP 的影响 (±s, n = 3)Fig. 5 Effect of ginsenoside Re on MMP of SH-SY5Y cells induced by rotenone (±s, n = 3)
3.6.2 人参皂苷Re 对细胞内ROS 生成的保护作用ROS 诱导的氧化应激与线粒体功能紊乱密切相关,并且ROS 也是调控细胞凋亡的重要因素之一。因此接下来检测细胞内ROS 生成量的变化,如图6 所示,与对照组比较,模型组细胞内DCF 荧光强度显著升高(P<0.01),胞内ROS 生成量显著增加(P<0.01);与模型组比较,各给药组细胞内DCF 荧光强度显著降低(P<0.05、0.01),胞内ROS 生成量显著降低(P<0.05、0.01),以5 μmol/L 人参皂苷Re 作用效果最为显著。

图6 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞内ROS 生成的影响 (±s, n = 3;×10)Fig. 6 Effect of ginsenoside Re on intracellular ROS production of SH-SY5Y cells induced by rotenone (±s, n = 3; × 10)
3.6.3 人参皂苷Re 对细胞内ATP 含量的保护作用接下来进一步检测线粒体功能的关键指标——胞内ATP 含量,如表2 所示,与对照组比较,模型组细胞内ATP 含量显著降低(P<0.01);与模型组比较,各给药组细胞内ATP 含量显著升高(P<0.05、0.01),以5 μmol/L 人参皂苷Re 作用最为显著。
表2 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞内ATP含量的影响 (±s, n = 3)Table 2 Effect of ginsenoside Re on intracellular ATP content of SH-SY5Y cells induced by rotenone (±s, n = 3)

表2 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞内ATP含量的影响 (±s, n = 3)Table 2 Effect of ginsenoside Re on intracellular ATP content of SH-SY5Y cells induced by rotenone (±s, n = 3)
组别 剂量/(μmol·L-1) ATP/(μmol·L-1)对照 — 9.64±0.22模型 — 2.76±0.38**L-DOPA 10 5.75±0.87#人参皂苷Re 2.5 4.94±0.93#5 7.52±0.52##
3.7 免疫荧光检测Pakin 和Pink-1 蛋白表达
Parkin、Pink-1 的异常表达与PD 等神经性疾病的发展密切相关,同时也在线粒体功能稳态的维护中起着至关重要的作用[14],因此本研究从Parkin 与Pink-1 对线粒体功能稳态与PD 之间的关系进行深入探讨,如图7 所示,与对照组比较,模型组细胞内Parkin 和Pink-1 蛋白表达减少;与模型组比较,各给药组细胞内Parkin 和Pink-1 蛋白表达增强。

图7 免疫荧光检测人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞内Parkin 和Pink-1 表达的影响 (×10)Fig. 7 Immunofluorescence detection of effect of ginsenoside Re on expressions of Parkin and Pink-1 in SH-SY5Y cells induced by rotenone (× 10)
3.8 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞Parkin、Pink-1、凋亡及抗氧化相关蛋白表达的影响
3.8.1 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞Parkin 和Pink-1 蛋白表达的影响 如图8 所示,与对照组比较,模型组Parkin 及Pink-1 蛋白表达显著下调(P<0.01);与模型组比较,各给药组Parkin蛋白表达显著升高(P<0.05、0.01),人参皂苷Re(5 μmol/L)组Pink-1 蛋白表达显著升高(P<0.01)。

图8 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞Parkin 和Pink-1 蛋白表达的影响 (±s, n = 3)Fig. 8 Effect of ginsenoside Re on Parkin and Pink-1 protein expressions in SH-SY5Y cells induced by rotenone (±s, n = 3)
3.8.2 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞凋亡相关蛋白表达的影响 如图9 所示,与对照组比较,模型组细胞线粒体内Cyt-C 蛋白表达水平显著下调(P<0.01),胞质中Cyt-C 蛋白表达水平显著上调(P<0.01),Bcl-2 蛋白表达显著下调(P<0.01),Bax 和cleaved Caspase-3 蛋白表达显著上调(P<0.01),表明鱼藤酮可破坏细胞线粒体膜通透性,导致Cyt-C 大量释放,造成线粒体功能紊乱,诱导凋亡蛋白Bax、Bcl-2、cleaved Caspase-3 的异常表达;与模型组比较,给予人参皂苷Re 处理后,可显著升高线粒体内Cyt-C 蛋白表达(P<0.05、0.01),降低胞质中Cyt-C 蛋白表达(P<0.05、0.01),降低Bax、cleaved Caspase-3 的表达(P<0.05、0.01),上调Bcl-2 的表达(P<0.05、0.01),表明人参皂苷Re 可通过改变线粒体膜的通透性,抑制Cyt-C 的释放,维护线粒体功能稳态,抑制细胞凋亡的发生。
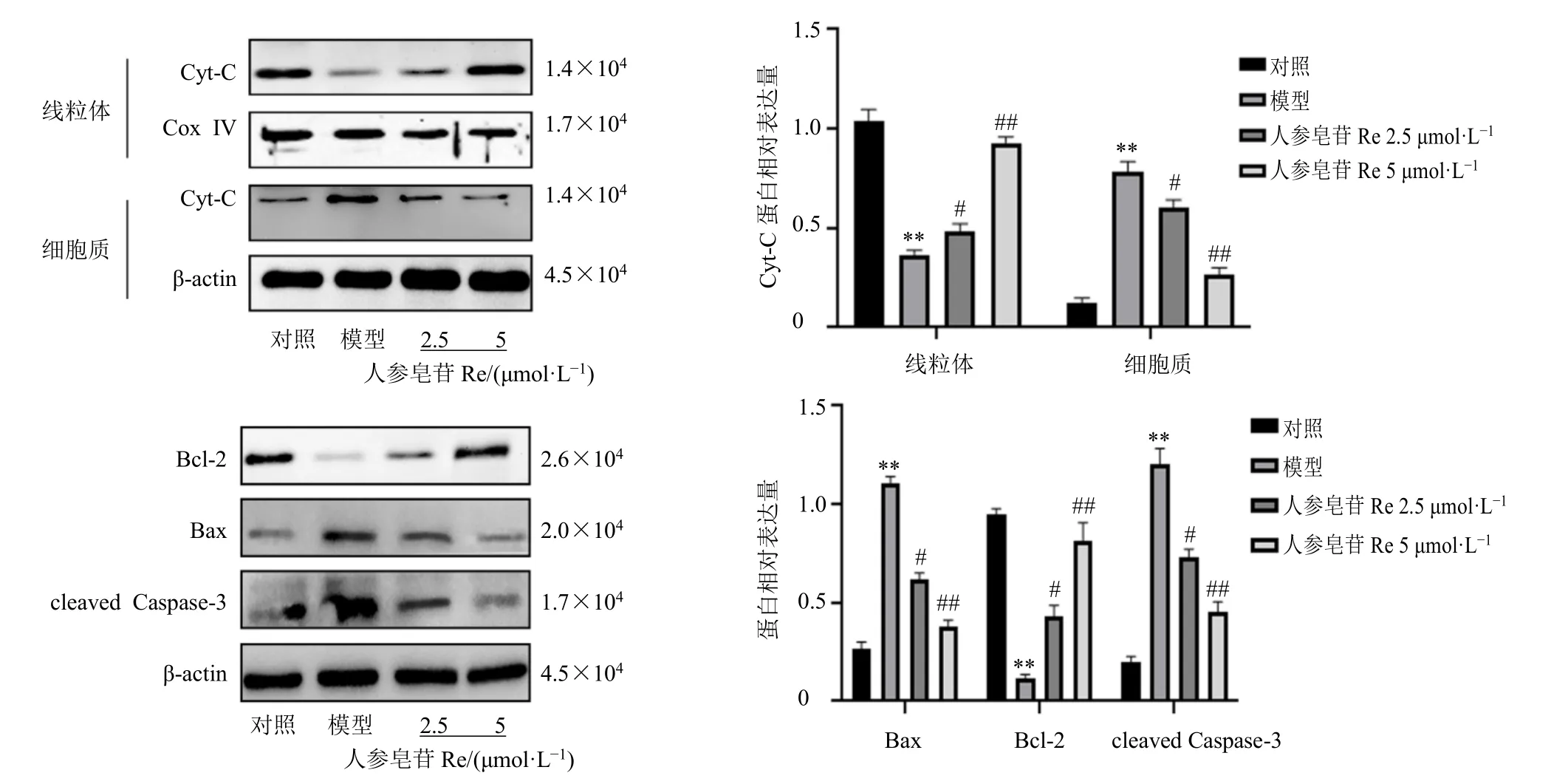
图9 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞凋亡相关蛋白表达的影响 (±s, n = 3)Fig. 9 Effect of ginsenoside Re on apoptosis related protein expressions in SH-SY5Y cells induced by rotenone (±s, n = 3)
3.8.3 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞Nrf2、HO-1、GCLC 和NQO1 蛋白表达的影响 人参皂苷Re 对鱼藤酮诱导神经毒性的保护作用与线粒体稳态的维系密切相关,线粒体是ROS 产生的主要场所,当ROS 含量较高时会发生氧化应激反应,氧化应激亦是诱导PD 的主要病因之一,因此,针对人参皂苷Re 的抗氧化作用进一步研究。如图10所示,与对照组比较,模型组细胞HO-1、GCLC 及NQO1 表达显著下调(P<0.01),Nrf2 核转移显著减少(P<0.01);给予人参皂苷Re 处理后,细胞内HO-1、GCLC 及NQO1 表达显著上调(P<0.05、0.01),Nrf2 核转移显著增多(P<0.05、0.01)。

图10 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞抗氧化相关蛋白表达的影响 (±s, n = 3)Fig. 10 Effect of ginsenoside Re on antioxidant related protein expressions in SH-SY5Y cells induced by rotenone (±s, n = 3)
4 讨论
近年来,针对PD 细胞模型的研究已逐渐成为焦点,常用其探索发病机制、了解药物作用靶点及研发新药等,目前常用于实验研究的细胞株有大鼠肾上腺嗜铬细胞瘤PC12 细胞系、SH-SY5Y 细胞系及原代中脑细胞系等。其中SH-SY5Y 细胞系具有人类成熟神经元的形态,与原代海马神经元相比更容易体外培养,因此被广泛用于中枢神经系统的体外模型研究[15-18]。
MPTP 可选择性地引起黑质致密部多巴胺能神经元损伤,成为第一个被证实有中枢DA 神经元毒性的外源性化学物质,但MPTP 在自然界中并不存在[19-23],鱼藤酮是一种线粒体复合物抑制剂,同时作为MPTP 的结构类似物,具有明显的神经毒性,也具有高度亲脂性,容易越过血脑屏障,不需要任何转运体即可进入多巴胺能神经元[24-27]。因此本研究选用鱼藤酮作为化学诱导剂构建体外PD 模型,并从线粒体功能稳态与氧化应激等方面对机制进行深入研究。
本研究结果显示,SH-SY5Y 细胞经鱼藤酮诱导损伤后,细胞存活率显著下降,细胞凋亡率显著上升,细胞糖酵解能力及线粒体氧化磷酸化能力明显丧失,推测鱼藤酮可能通过破坏线粒体膜的通透性,导致MMP 下降,进而造成线粒体内ATP 合成障碍及线粒体膜转换孔异常打开,从而抑制细胞糖酵解能力及氧化磷酸化能力,诱导线粒体内Cyt-C 大量释放到细胞质,继而激活Caspase-3 信号通路,启动Caspase 级联反应,引起细胞凋亡,抑制神经细胞的生长;给予人参皂苷Re 处理后,上述PD 样病理症状均显著改善,推测人参皂苷Re 可能通过修复线粒体膜的通透性,抑制线粒体内Cyt-C 的释放,继而维护线粒体功能稳态,激活Kelch 样ECH 相关蛋白1(Kelch like ECH associated protein 1,Keap1)-Nrf2-抗氧化反应元件(antioxidant response element,ARE)信号通路,提高神经细胞的抗氧化活力,抑制线粒体介导的Caspase-3 凋亡信号通路,抑制神经元细胞凋亡,从而发挥神经保护作用(图11)。
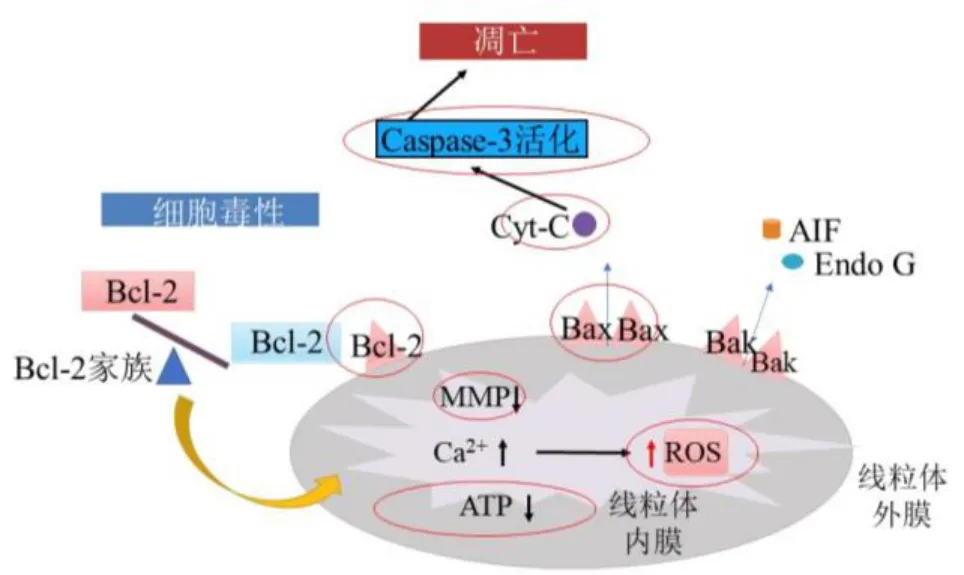
图11 人参皂苷Re 对鱼藤酮诱导的SH-SY5Y 细胞的神经保护作用机制Fig. 11 Neuroprotective mechanism of ginsenoside Re on SH-SY5Y cells induced by rotenone
综上,本研究以线粒体功能稳态与氧化应激学说为切入点,利用化学诱导的方式建立SH-SY5Y 细胞体外PD 模型,充分模仿散发性PD 的主要病因与病机,初步阐明了人参皂苷Re 的神经保护作用机制及靶点,为进一步探索散发性PD 的环境病因提供了大力支持,也为后续PD 的中药治疗提供了宝贵的科学依据。
利益冲突所有作者均声明不存在利益冲突
