化学发光免疫分析法快速检测血清登革热病毒NS1抗原方法的建立及初步应用评价
2023-06-07陈翠翠梁焕坤钟树海陆嫣红李来庆
陈翠翠,梁焕坤,钟树海,陆嫣红,李来庆
(1.广州优迪生物科技股份有限公司,广州 510663;2.济南市来德生物科技有限公司,济南 271100)
登革热是由登革热病毒(dengue virus,DENV)感染引起的一种急性传染性疾病,广泛流行于全球热带和亚热带地区,是分布最广、发病数量最多、危害较大的一种虫媒病毒性疾病[1]。人感染DENV的临床症状有持久高热、头痛、全身肌肉痛、骨关节痛、皮疹等症状[2]。全球每年约有4 亿例登革热病例和2.2 万例死亡病例[3]。自1978年在广东出现首例确诊病例后,登革热在我国呈现由南向北不断蔓延、感染人数不断增加的趋势。以2019年为例,中国大陆高达28 个省(自治区、直辖市)报告登革热病例共计22 599 例,显著高于2018年(5 136例)[4]。目前,登革热病毒并没有有效疫苗或针对性的治疗方法,而快速准确的检测方法对于其防控和治疗具有重要意义[5]。目前,我国的登革热体外诊断试剂均为定性检测产品,对灵敏度更高的定量产品有迫切需求。化学发光免疫分析法(chemiluminescence immunoassay,CLIA)是一种新型的分析方法,具有极高的灵敏度和准确度、选择性较好、仪器简单、分析速度快、线性范围可宽达几个数量级等优点,在近几年的临床检验医学中应用愈来愈广泛[6]。本研究拟采用CLIA 建立一种登革热病毒NS1 抗原快速检测方法,为登革热的快速、准确、早期筛查提供一种新的技术方法。
1 材料与方法
1.1 研究对象 登革热阴阳性样本来自广州市疾病预防控制中心,其中110 例阴性样本来自健康体检志愿者,年龄5~65岁,无传染病、一月内无服药史;85 例阳性样本为临床确诊的患者血清样本(具有登革热临床表现或流行病学史,登革热病毒核酸阳性),年龄6~58 岁,无传染病、一月内无服药史。血清样本的使用已获得作者知情同意。
1.2 仪器与试剂 羧基化磁珠(杭州博岳生物技术有限公司,货号M1000C);NS1 抗原及其配对抗体对为广州优迪生物科技股份有限公司制备;吖啶酯[赫利森(厦门)生物科技有限公司,货号HS-11015006];1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐[(1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide,(EDC,货号22980)],N-羟基磺基琥珀酰亚胺(N-Hydroxysulfosuccinimide sodium,NHS)(Sigma 公司)。化学发光检测仪(重庆科斯迈生物科技有限公司,型号SMART500S)。发光底物(含激发液和预激发液)(雅培公司,货号6E23-82 和6C55-82)。
1.3 方法
1.3.1 NS1单抗-吖啶酯发光试剂的制备:按照4∶1的质量比,将NS1 单抗与吖啶酯混合,室温下振荡反应1h,加入终浓度为0.5%(v/v)赖氨酸溶液终止反应。用0.1mol 磷酸盐缓冲液(phosphate buffered saline,PBS)透析(去除游离的吖啶酯)24h 后,过Sephadex G50 凝胶层析纯化,收集具有高发光强度的产物,即为纯化的NS1 单抗-吖啶酯发光试剂,储存于4℃下备用。
1.3.2 NS1 配对单抗-磁珠偶联物的制备:采用常用的EDC/NHS 方法活化羧基磁珠后再与NS1 配对单抗进行偶联。具体步骤为:0.05mol 吗啉磺酸(pH 6.0)洗涤羧基磁珠后,加入等量的EDC 和NHS,常温下振荡活化30 min 后,按照NS1 配对单抗与磁珠质量比1∶5 加入NS1 配对单抗,室温下振荡反应3h。然后,经封闭缓冲液(0.05 mol Tris+0.02% Triton X-100+5g/dl 牛血清清蛋白)封闭1h 后,0.1mol PBS 洗涤数次后得到NS1 配对单抗-磁珠偶联物,用磁珠稀释液(0.05mol Tris+5g/dl 牛血清清蛋白+0.05% Triton X-100+5g/dl 海藻糖+0.05g/dl Proclin300)溶解,放于4℃下保存备用。
1.3.3 检测步骤:按照优化的条件,在化学发光检测仪上设置各参数,进行全自动化检测。具体检测步骤为:取50μl NS1 配对单抗-磁珠偶联物,分别加入50μl 的NS1 抗原标准品或人血清样本和100μl NS1 单抗-吖啶酯发光试剂,37℃温育反应20 min,外加磁场促使磁珠及其磁珠偶联物聚集到试管底部,洗涤磁珠上吸附的杂质,然后加入100μl 的发光底物预激发液和激发液后,检测吖啶酯光子的相对光强度(relative luminosity,RLU)。样本中的NS1 抗原浓度与收集到的RLU呈正相关,通过检测一系列NS1 抗原标准品绘制标准曲线,利用标准曲线即可计算得出待测样品中NS1 抗原的浓度。
1.3.4 检测线性范围和灵敏度评估:制备NS1抗原系列浓度:0,0.1,1,10,100,500 和1 000 ng/ml,采用本方法检测各浓度对应的发光光度值,采用双对数数学模型进行标准曲线的拟合,绘制标准曲线。每个浓度测定3 个复孔。以不含NS1 抗原的溶液为样本,重复测定20 次,计算平均值()及其标准差(standard deviation,s),数值代入标准曲线方程,得到本方法检测NS1 抗原的灵敏度。
1.3.5 检测特异度评估:采用本检测方法分别检测100ng/ml 人血清清蛋白,100ng/ml 胆红素,100ng/ml血红蛋白,100ng/ml 白细胞介素6(interleukin 6,IL-6)和100ng/ml 甲流病毒抗原样本,以评估该试剂盒的特异度。
1.3.6 参考区间的确定:对110 例健康志愿者血清样本进行检测,应用SPSS17.0 进行数据统计分析。先确定110例样本NS1抗原浓度值是否为正态分布,若为正态分布,采用正态分布法计算参考区间;若为偏态分布,则采用百分位法计算参考区间,取其第95 百分位[7]。
1.3.7 临床样本验证实验:取85 例临床确诊的登革热阳性血清样本,20 例健康志愿者阴性血清样本,采用美国Cortez 公司的登革热NS1 快速检测试剂盒和本试剂盒同时进行检测。检测结果与临床结果进行对比,以确定本试剂盒临床筛查登革热的灵敏度。采用配对卡方检验(McNemar test)和一致性检验(Kappa test)分析两种方法的对比结果。
1.4 统计学分析 采用SPSS 17.0 统计软件,数据以均数±标准差(±s)表示,GraphPad Prism 5软件绘制标准曲线。参考区间采用正态分布法计算。
2 结果
2.1 检测线性范围和灵敏度结果 见图1。以NS1抗原系列浓度为横坐标,其对应的化学发光值为纵坐标,双对数数学模型拟合的标准曲线方程为:Y=0.355 3X+3.446 2,r2= 0.991 3。NS1 抗原浓度在0.1~1 000ng/ml 范围内时,本检测方法具有良好的剂量-反应效应。以不含NS1 抗原的溶液为样本,重复测定20 次,得到本方法检测NS1 抗原的灵敏度为1.12ng/ml。

图1 标准曲线
2.2 检测特异度结果 见表1。用本方法重复3 次检测100ng/ml NS1 抗原,得到的平均浓度为98.60ng/ml;人血清清蛋白、胆红素、血红蛋白、IL-6和甲流病毒抗原,检测值分别为1.46,1.05,1.11,0.96 和1.63ng/ml,交叉反应率均低于2%,表明血清中常见干扰物质对该方法NS1 抗原检测的影响较小,方法特异度较好。
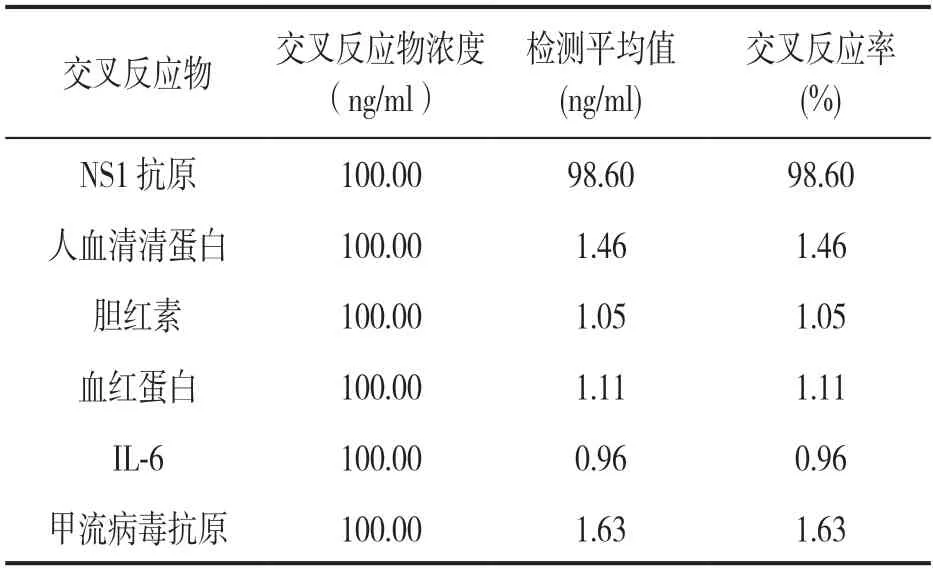
表1 特异度实验结果
2.3 参考区间 110 份健康志愿者血清样本进行检测,计算得到的NS1 抗原浓度使用SPSS 17.0 进行正态性检验,发现其数值呈正态分布,参考区间cut off 值计算公式为±1.64s,110 份健康志愿者NS1 抗原的平均浓度为2.53ng/ml,s为0.692,计算得到cut off 值为3.66ng/ml。这意味着当利用本方法检测临床血清样本时NS1抗原浓度大于3.66ng/ml 时,怀疑患者感染了登革热病毒;NS1 抗原浓度值小于3.66ng/ml 时,患者感染登革热病毒的可能性较小。
2.4 临床样本验证结果 本方法检测85 例临床确诊的登革热阳性血清样本,20 份健康志愿者阴性血清样本,结果发现85 例临床确诊的登革热阳性血清样本全部为阳性,20 例阴性血清样本全部为阴性,提示该方法临床检测准确度较高。两种方法的比对结果采用SPSS 软件进行卡方检验,配对卡方检验(McNemar test)的P值为1.000,一致性检验(Kappa test)的Kappa 值为0.876。卡方检验结果说明了本方法与Cortez 公司试剂盒在临床样本检测上无显著性差异。
3 讨论
酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)和胶体金法是目前登革热病毒抗原和抗体最常用的血清学检测方法,实时荧光定量聚合酶链式反应法(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)是最常用的分子学检测方法[8-9]。美国Cortez 公司的NS1检测试剂盒(胶体金法)是世界卫生组织(World Health Organization,WHO)推荐的、灵敏度和特异度好的登革热快速诊断试剂盒,也是我国进口数量最多、使用最广的登革热快速检测试剂盒[10]。目前,我国的登革热体外诊断试剂均为定性检测产品,远远无法满足国内市场对登革热快速诊断试剂的需求。本实验选择临床检验医学中日益受到青睐的CLIA,经过NS1 单抗-吖啶酯发光试剂的制备、NS1 配对单抗-磁珠偶联物的制备和检测步骤的优化,建立了一种登革热病毒NS1 抗原CLIA,该方法对血清中NS1 抗原的检测灵敏度高、线性范围宽、特异度好、对临床样本的检测准确度较高、与Cortez 公司NS1 检测试剂盒比较无显著性差异,为登革热的快速、准确、早期筛查提供一种新的技术方法。
登革热病毒为单股正链RNA 病毒,基因组全长约11kb,由1 个开放阅读框(open reading frame,ORF)和非编码区(5’UTR,3’UTR)组成,ORF可编码三种结构蛋白(衣壳蛋白、膜蛋白和包膜蛋白)和七种非结构蛋白(NS1,NS2A,NS2B,NS3,NS4A,NS4B 和NS5)[11-12]。其中,NS1 是临床上公认的DENV 感染早期检测的生物标志物[13]。NS1 基因长约1 056bp,编码的NS1 蛋白是登革热病毒非结构蛋白中唯一的糖蛋白,该糖蛋白在登革热病毒四种病毒血清型间高度保守,其在血清中的检测常早于IgM 抗体和RNA 的产生,在登革热的早期诊断中具有重要作用[14]。此外,在13例原发性登革热感染病例中,NS1 抗原是5 例中检测到的唯一标志物[15]。因此,本研究选择NS1 抗原作为检测对象,建立了一种登革热临床筛查的新方法。
临床样本验证结果显示,85 例临床确诊的登革热阳性血清样本全部为阳性,20 例阴性血清样本全部为阴性,说明本CLIA 法的检测准确度较高。Cortez 公司试剂盒的检测结果有2 例阳性样本检测为阴性,2 例阴性样本检测为阳性,其准确度不如该CLIA 法。但配对卡方检验和一致性检验显示CLIA 法与Cortez 公司试剂盒无显著性差异,提示该CLIA 法具有更高的检测灵敏度(假阴性率低)和特异度(假阳性率低)、抗溶血等干扰能力较强。虽然在操作简便性、快捷性上不如Cortez 公司的胶体金试剂,该方法优势在于可全自动化检测,检测的灵敏度和特异度更好。值得注意的是,临床检验中对阳性结果的判断一定要慎重,不能仅凭单一检测结果而确诊,要结合流行病学调查及患者的临床症状进行综合分析。
本研究也有一些局限性。首先,由于临床样本数量有限,参考区间cutoff 值的获得可能与实际情况存在偏差,后续实验需增加样本量,进一步明确参考区间。其次,临床样本验证选择的是85 例临床确诊的登革热阳性血清样本,缺少疑似病例样本的验证,后续将补充临床疑似病例样本、治疗恢复期的临床样本,全面考核该CLIA 法的检测性能。本研究建立的CLIA 法,仅仅进行了初步的灵敏度、特异度和临床样本验证评价,明确该方法达到了实验室检测的基本要求,且具有与商业化试剂相当的检测性能,有开发为临床检测试剂的潜力,但未进行全面客观的评价,并未获得国家注册,目前还无法临床应用。
综上所述,本研究建立的登革热NS1 抗原CLIA 法,具有高灵敏度、高准确度、强特异度、简便快捷等优点,可为临床登革热的诊断提供一种新的技术手段,在登革热的早期诊断和疗效评估等方面可能发挥重要作用。
