水分胁迫对朱砂根种子萌发及幼苗生长的影响
2023-06-07俞伶俐魏升华白玲利文琴琴严福林
俞伶俐 魏升华 白玲利 文琴琴 严福林

摘 要 开展5个水分处理下的朱砂根种子萌发试验,测定比较其对种子萌发、幼苗生长情况和幼苗的3个生理生化指标的影响。结果表明,随着PEG-6000溶液浓度增加,朱砂根种子的发芽率、发芽势呈先上升后下降趋势,发芽指数和活力指数呈先下降后上升趋势;PEG-6000浓度为10%时,发芽率最高;PEG-6000浓度为5%时,发芽势最高,CK组的发芽指数和活力指数均高于其他组。CK组胚根最长,CK组与各试验组之间的胚根数、干重、相对含水量参数基本相同,差异不显著。水分胁迫促使朱砂根幼苗叶片数、须根数、鲜重和干重均有所增加,相对含水量、叶长、叶宽有所减小。幼苗的叶绿素含量和SOD活性随PEG-6000溶液浓度增加呈先上升后下降趋势,PEG-6000溶液浓度为5%时,幼苗叶绿素含量和SOD活性最高,MDA含量与PEG-6000溶液浓度大致呈正相关,CK组与试验组均具有显著性差异(p<0.05)。综上,朱砂根具有一定的抗旱能力,种子萌发需要适当的水分,其中PEG-6000溶液浓度为5%时最佳。
关键词 水分胁迫;朱砂根;种子;萌发;幼苗;生理指标
中图分类号:S567.1 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.03.016
朱砂根(Ardisia crenata Sims)是紫金牛科(Myrsinaceae)紫金牛属(Ardisia)的一种常绿小灌木,广泛分布于我国各地[1]。由于其果期长,果实鲜艳,象征富贵吉祥,又名“富贵子”,具有较好的观赏价值[2]。朱砂根全株可入药,其干燥根部为常用中药,具有解毒消肿、活血止痛、祛风除湿等功效。主要用于治疗咽喉肿痛、风湿痹痛、跌打损伤等疾病[3-5]。现代研究表明,朱砂根主要有岩白菜素、皂苷类、黄酮类、苯醌类、香豆素等成分,具有抗炎、活血化瘀、抗肿瘤、抗病原微生物等药理作用[6-9]。朱砂根为贵州特色苗药“八爪金龙”的主要来源,也是贵州苗药大品种“开喉剑喷雾剂”“养阴口香合剂”和“咽喉清喉片”等成药的主要原料之一。近年来,随着人们生活水平的不断提高,中医药、民族医药逐渐获得了广泛认可,市场需求呈逐年上升趋势,朱砂根的资源消耗也急剧加大,然而目前“八爪金龙”的开发利用严重依赖野生资源,且药用品质形成周期较长。随着朱砂根市场需求的不断扩大和野生资源的长期大量、不规范滥采乱挖,野生资源急剧减少,不能满足需求,这给苗药原料供应造成极大压力,也限制相关产业发展。因此,朱砂根药材的人工种植迫在眉睫。
繁殖材料的收集、保存、萌发并获得足够的种苗是农业规模化生产的物质基础,有性繁殖具有系数大、适应性好等优点。朱砂根种子为顽拗性种子,当水分下降到一定程度极易失活。因此,水分是朱砂根种子萌发及幼苗生长发育过程中的主要影响因素。聚乙二醇(PEG)是一种亲水性很强的高分子聚合物,大量研究表明了PEG用于人工模拟干旱的可行性[10]。采用不同浓度PEG-6000对朱砂根种子进行模拟水分胁迫处理,探究朱砂根在干旱胁迫下种子的萌发情况及幼苗的生长情况,为朱砂根育苗移栽及种植技术提供一定的参考。
1 材料与方法
1.1 试验材料
朱砂根果实于2021年11—12月采自黔东南州施秉县及雷山县,凭证标本经贵州中医药大学魏升华教授鉴定为紫金牛属朱砂根,保存于贵州中医药大学中药材种植(养殖)及加工研究所。试验时选取籽粒饱满、质地均匀、大小一致的果实,用自来水浸泡3 h,搓去外果皮及果肉,沥干后用70%乙醇浸泡1 min进行消毒,再用灭菌的纯化水清洗5次,吸水纸吸干种子表面水分备用。
1.2 试验方法
1.2.1 PEG-6000溶液配制及种子前处理
以蒸馏水为空白对照(CK),配置浓度为5%、10%、15%、20%的PEG-6000溶液。分别在培养皿中加入等100 mL PEG-6000溶液,每个培养皿放入30粒朱砂根种子,以滤纸为萌发基质,放置于光照培养箱,培养条件为16 h光照、8 h黑暗,25 ℃恒温培养,每个处理3次重复,待种子萌发结束后统计并分析种子发芽情况。不同浓度PEG-6000溶液的水势计算:
ψs=-(1.18×10-2)C-(1.18×10-4)C2+(2.67×10-4)CT+(8.39×10-7)C2T (1)
式中:ψs渗透势(bar),1 bar =0.1 MPa;C为PEG6000溶液浓度(g·kg-1);T为溶液温度(25 ℃)。
1.2.2 测定指标的计算方法
发芽率=正常发芽种子数/供试种子数×100%;
发芽势=发芽高峰时正常发芽种子数/供试种子数×100%;
发芽指数=∑(Gt/Dt);
活力指数=发芽指数×S;
式中,Gt与Dt分别表示第t天的发芽数和相应的发芽天数;S为幼苗长势,本试验为幼苗平均鲜重。
胚根参数测定:试验结束后,每个处理随机选取10粒种子,分别测其胚根长和胚根鲜重、干重、相对含水量。
幼苗参数测定:种子发芽结束30 d后,随机选取10株幼苗测定其根长、须根数量、叶片数量、叶长、叶宽、植株鲜重、干重及相对含水量,并测定幼苗叶绿素、丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性指标(参照《植物生理学实验》测定)。
1.2.3 数据处理与分析
采用Microsoft Excel 2020和Graph Pad Prism 8.0.1软件对数据进行处理和绘图,采用 SPSS V. 26.0分析软件进行方差分析和多重比较。
2 结果与分析
2.1 不同濃度PEG-6000对朱砂根种子萌发的影响
用不同浓度的PEG-6000溶液分别培养朱砂根种子,对种子发芽率、发芽势、发芽指数及活力指数进行统计,结果见表1。随着PEG-6000浓度的增加,发芽率呈先上升后下降的趋势,均显著高于CK组(p<0.05),其中,PEG-6000浓度为10 %时,发芽率最高(83.34±4.72)%,显著高于其他处理组(p<0.05),CK组发芽率明显较低(55±2.36)%,且在萌发过程中出现了显著的霉变腐烂现象。PEG-6000浓度为5%时,发芽势最高,为(55.00±2.36)%,显著高于其他组别(p<0.05)。随着PEG-6000浓度的增加,发芽指数与活力指数均呈先下降后上升趋势,其中发芽指数和活力指数最高为CK组,分别为(30.74±0.76)%和(8.33±0.21)%,显著高于其他处理组(p<0.05)。
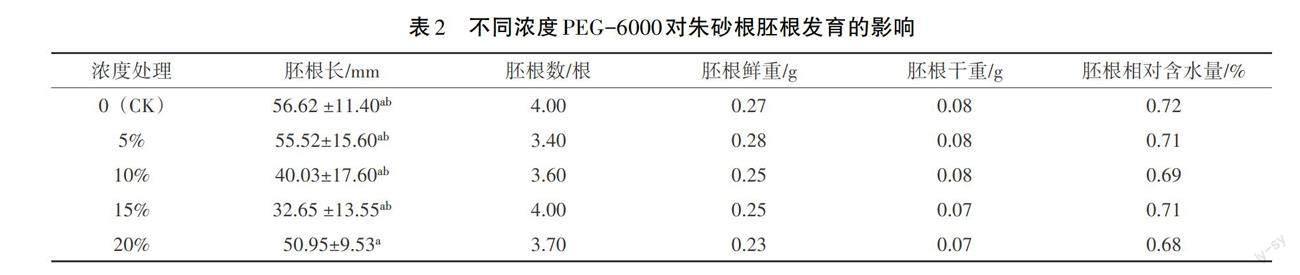
2.2 不同浓度PEG-6000对朱砂根胚根发育的影响
胚根的生长情况是评价种子萌发后能否正常成苗的关键指标,本研究对不同浓度PEG-6000下朱砂根的胚根长度、胚根须根数、胚根鲜重、干重与相对含水量进行统计分析,结果见表2。CK组胚根最长,为(56.62±11.40)mm,显著高于所有PEG-6000处理组(p<0.05),处理组中,胚根的长度随着PEG-6000浓度的升高呈先降低后升高趋势,PEG 5%与PEG 20%胚根长度无显著性差异(p>0.05)。CK组与各试验组之间朱砂根的胚根数、干重、相对含水量参数基本相同,无显著性差异。胚根鲜重随着PEG-6000浓度的增加,略呈下降趋势,鲜重最大的是5%浓度处理,为0.28 g;其次为CK组,为0.27 g;最低为20%浓度处理,为0.23 g,CK组与PEG 20%浓度组具有显著差异(p<0.05)。
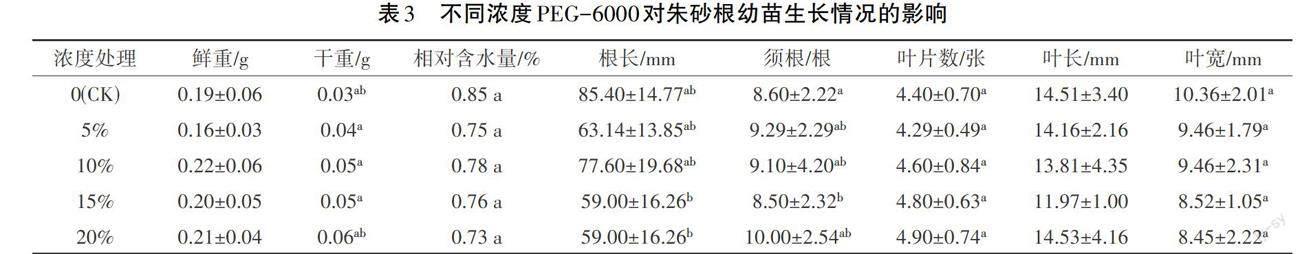
2.3 不同浓度PEG-6000对朱砂根幼苗生长的影响
中药材种苗的质量关系到植株抗性、移栽成活率、田间管理以及中药材的质量和产量结果见表3。随着PEG-6000浓度的增加,30 d龄朱砂根幼苗相对含水量呈逐渐下降趋势,均显著低于CK组(p<0.05);各组间幼苗鲜重比较无显著性差异(p>0.05);随着PEG-6000浓度的增加,干重逐渐增加,各组间比较具有显著性差异(p<0.05)。朱砂根幼苗须根数随PEG-6000浓度的增加而增加,除PEG15%组外;根长随PEG-6000浓度的增加而减小,处理组均显著低于CK组(p<0.05)。朱砂根幼苗叶片数随PEG浓度的上升呈逐渐增多趋势,但叶片宽度随着浓度的增加逐渐变小,叶片长度组间比较差异不显著(p>0.05)。
2.4 不同浓度PEG-6000对朱砂根幼苗叶绿素含量的影响
在不同水分胁迫程度下,朱砂根幼苗的叶绿素含量不同,详见表4。PEG-6000浓度在0%~15%时,叶绿素含量大致呈上升趋势,浓度为5%时叶绿素含量最高,达到6.37 mg·L-1;PEG-6000浓度在15% ~ 20%时,幼苗叶绿素含量呈下降趋势,浓度为20%时叶绿素含量最低,为3.15 mg·L-1。PEG-6000浓度为5%、10%、15%时,叶绿素含量显著高于CK组(p<0.05),分别增加了20.42%、13.80%、20.60%;但PEG-6000浓度为20%时,叶绿素含量显著低于CK组(p<0.05),减少了40.45%。
2.5 不同浓度PEG-6000对朱砂根幼苗丙二醛含量的影响
水分胁迫可能会引起幼苗活性氧代谢失控,细胞膜脂可能会发生脂质过氧化现象,导致较多的丙二醛(MDA)产生,因此可以将MDA作为描述幼苗生长健康与否的指标[11]。由表4可知,在不同水分胁迫程度下,朱砂根幼苗MDA含量不同。随着PEG-6000浓度的升高,MDA含量呈上升趋势,在浓度为20%时,MDA含量最高,为7.42 nmol·g-1;CK组MDA含量最低,为5.47 nmol·g-1。PEG-6000处理组幼苗的MDA含量均显著高于CK组,分别增加了14.44%、20.41%、19.44%、35.65%。
2.6 不同浓度PEG-6000对朱砂根幼苗SOD活性的影响
由表4可知,在不同水分胁迫程度下,朱砂根幼苗超氧化物歧化酶(SOD)活性不同。PEG-6000浓度在0% ~ 5%之间,幼苗SOD活性呈升高趋势,当PEG-6000浓度为5%时,SOD活性最高,为334.49 U·mg-1;PEG-6000浓度在5% ~ 20%之间,SOD活性呈降低趋势,当PEG-6000浓度为20%时,SOD活性最低,为190.08 U·mg-1。PEG-6000浓度为5%时,SOD活性高于CK组,增加了9.52%;PEG-6000浓度为10%、15%、20%时,SOD活性均低于CK组,分别减少了13.90%、30.21%、37.76%,当PEG-6000浓度为10%时,SOD活性急剧降低,之后随着PEG-6000浓度的增加,SOD活性降低较为平缓。
3 小结与讨论
朱砂根为阴生常绿灌木,其根为常用药材。本课题组前期调查发现,朱砂根野外群居个体数量较少,且植株个体之间间隔往往较远,未发现聚集群体,这可能与朱砂根种子在野外的萌发较为困难有关。种子的萌发与外界环境有着密切关系,常常需要适宜温度及水分才能完成。前期研究发现,朱砂根种子的萌发温度在20 ~ 25 ℃时萌发率最高,初步掌握了朱砂根种子萌发适宜温度。
研究发现,随着PEG-6000浓度的增加,发芽率呈先上升后下降的趋势,其中PEG-6000浓度为10%时,发芽率最高,且试验组朱砂根种子的发芽率均大于CK组,这与冷蒿种子随着干旱程度的加深,发芽率降低的现象具有一定的差异[12]。可能预示不同物种的种子对干旱的响应不同,适当的干旱处理不但有利于促进朱砂根种子的萌发,还可以防止水分较多而出现发霉、腐烂的现象。中药材种苗的质量关系到植株抗性、移栽成活率、田间管理及中药材的质量和产量。本研究对不同浓度PEG-6000下朱砂根根长、须根数、鲜重、干重与相对含水量等参数进行分析发现,水分胁迫促使朱砂根叶片数、须根数、鲜重和干重总体均呈增加趋势,但根长、叶宽与PEG-6000浓度呈负相关关系。这可能是因水势降低,主根变长无法满足植物对水的需求,只有增加须根数,才能更多地从土壤中获取足够的水分。在水分胁迫环境下,朱砂根叶片变小、变窄,可能是为了对抗水分胁迫,减少水分散失。植物叶绿素含量的改变是植物适应不良环境的重要特征,也是植物受害程度的重要体现。叶绿素是植物进行光合作用,将光能转化为化学能的活性物质,叶绿素含量的高低是反映植物光合作用强弱的一项重要指标[13],生長发育旺盛的植株会合成较多的叶绿素,表现较强的抗性,反之则少[14]。
随PEG-6000浓度的升高,朱砂根幼苗的叶绿素含量先增加后减少,在PEG-6000浓度为5%达到最高,除浓度为20%时比CK组低,其余均高于CK组。说明在一定的干旱条件下,朱砂根光合作用增强,但后期干旱过度,叶绿素低于CK组,在浓度为20%时,影响了正常的光合作用反应而导致。当植物处于适宜的环境条件下,ROS的产生和清除处于动态平衡状态,在植物受到环境胁迫后,这种平衡被打破,ROS含量上升,然后导致MDA积累,使膜脂质过氧化[15-16]。本研究结果显示,随着PEG-6000浓度的升高,朱砂根幼苗的MDA含量总体呈上升趋势,这与薛静怡等[17]对千金子种子水分胁迫的生理生化特性结果一致。这可能是因为PEG-6000浓度的升高,水势较低,水分胁迫下朱砂根幼苗膜结构遭到破坏引起代谢絮乱,导致了MDA含量升高。水分胁迫使植物细胞内产生活性氧,干扰正常的生命代谢活动[18]。但植物对逆境的响应会产生自我保护的抗氧化酶,维持活性氧的动态平衡,如SOD、POD等,SOD是生物体内清除活性氧的主要保护酶之一[19]。
通过测定朱砂根幼苗SOD的活性,分析不同水势对抗氧化酶活性的影响。结果显示,随着PEG-6000浓度的升高,不同干旱处理组幼苗的SOD活性呈先上升后下降的变化趋势,PEG-6000浓度为0%~5%时,SOD活性呈上升趋势;在浓度为5%时,SOD活性达到最高,且高于CK组。这与刘亚西等[20]研究水分胁迫对多年生黑麦草种子萌发和生理调控的影响结果相似。说明朱砂根幼苗对干旱胁迫表现出一定的适应性,加速分解种子内部产生的超氧自由基。PEG-6000浓度为5%~20%,SOD活性呈下降趋势,且都低于CK组。与李莉等[21]研究中发现野燕麦在水分胁迫下,SOD表现为先应激性上升后下降的动态变化一致。这可能是因为胁迫程度的加剧一定程度干扰SOD活性及植物体内其他酶彼此之间的互作过程,导致SOD活性降低且低于CK组。
综上所述,朱砂根种子的萌发及幼苗生长需要一定量的水分,但是水分也不宜过多,朱砂根种子萌发所需的水分比幼苗生长过程所需水分要高,朱砂根种子萌发在PEG-6000浓度为5%下萌发为最佳选择。此外,朱砂根具有一定的抗旱能力,当PEG-6000浓度为20%时,超过了植物自身的可抵抗的程度,会出现持续性萎蔫、甚至死亡的现象。朱砂根作为一种阴生植物,其生长过程中,也并非水分越多越好,这可能和野外资源调查发现朱砂根容易发生根腐病有一定关系,本试驗结果为进一步研究朱砂根规范化育苗、移栽及种植提供参考。
参考文献:
[1] 濮文辉,刘永花,李志英.朱砂根植物学特性及种子离体快繁技术[J].现代农业科技,2015(23):98,107.
[2] 黄素华,邱丰燕,洪燕萍.观赏植物富贵籽种子发芽试验研究[J].龙岩学院学报,2015,33(2):94-99.
[3] 彭光天,黄上志,傅家瑞.紫金牛属植物种子贮藏和萌发的初步研究[J].中山大学学报(自然科学版),2003(4):79-83.
[4] 邱迎君,易官美,单文.4种紫金牛属观赏植物的种子萌发试验研究[J].种子,2010,29(10):8-9,14.
[5] 雷宝盛,周兰英,袁定昌,等.不同温度和浸种时间对朱砂根发芽的影响[J].种子科技,2009,27(1):26-28.
[6] 江纪武.药用植物辞典[M].天津:天津科学技术出版社,2005.
[7] 刘毅.朱砂根[J].中国民族民间医药,2021,30(3):123.
[8] 全国草药汇编编写组.全国中草药汇编(第2版)[M].北京:人民卫生出版社,1996.
[9] HORGEN F D, Guinaudeau H, Pezzuto J M, et al. Isolation and structure elucidation of ardisenone: a new, cytotoxic alkenylphenol from Ardisia iwahigensis[J]. Journal of natural products, 1997, 60(5):533-535
[10] 何学青,呼天明,许岳飞,等.PEG-6000模拟水分胁迫对柳枝稷种子萌发及幼苗生长的影响[J].草地学报,2014,22(3):556-563.
[11] 孙清洋.老芒麦萌发和幼苗生长对两种渗透胁迫的不同响应[D].北京:中国农业科学院,2016.
[12] 李阳,丁芳兵,魏莹,等.水分胁迫对冷蒿种子萌发和幼苗生长的影响[J].广西林业科学,2021,50(4):434-439.
[13] 侯舒婷,张倩,刘思岑,等.黄金香柳对水分胁迫的生长与生理响应[J].西北植物学报,2014,34(12):2491-2499.
[14] 郭慧娟,胡涛,傅金民.苏打碱胁迫对多年生黑麦草的生理影响[J].草业学报,2012,21(1):118-125.
[15] 姜玉萍,郝婷,邹宜静,等.淹水对植物生长发育的影响及适应机理的研究进展[J].上海农业学报,2013,29(6):146-149.
[16] 杨利艳,杨小兰,朱满喜,等.干旱胁迫对藜麦种子萌发及幼苗生理特性的影响[J].种子,2020,39(9):36-40.
[17] 薛静怡,杨浩娜,唐易,等.水分胁迫对千金子种子萌发及生理生化特性的影响[J].种子,2021,40(5):33-38.
[18] YEUNG E, VAN V H, VASHISHT D, et al. A stress recovery signaling network for enhanced flooding tolerance in Arabidopsis thaliana[J]. Proceedings of the National Academy of Sciences, 2018, 115(26):201803841.
[19] HOSSAIN Z, L?PEZ-CLIMENT M F, ARBONA V, et al. Modulation of the antioxidant system in Citrus under waterlogging and subsequent drainage[J]. Journal of Plant Physiology, 2009,166(13):1391-1404.
[20] 刘亚西,周杨,李杨,等.模拟水分胁迫对多年生黑麦草种子萌发和生理调控的影响[J].草业科学,2022,39(7):1383-1390.
[21] 李莉,刘梦,梁维维,等.野燕麦对水分胁迫的生理生化响应[J].草食家畜,2020(3):22-27.
(责任编辑:易 婧)
