薇甘菊化学成分对六种核桃病原真菌的抑菌活性
2023-06-04祁进康李晋芳胡世俊闫晓慧
张 威,祁进康,李晋芳,胡世俊,闫晓慧
(西南林业大学,a.生物多样性保护学院/云南省森林灾害预警与控制重点实验室;b.林学院/西南地区生物多样性保育国家林业局重点实验室,昆明 650233)
薇甘菊(Mikania micranthaH.B.K)是菊科假泽兰属植物,原产热带南美洲,已在世界上许多国家发生和分布。薇甘菊是一种危害性极大的农林杂草,由于其较强的攀援、繁殖扩散能力,可致使其他树木枯死,素有“植物杀手”之称,被列为世界上最具危害性的100 种外来入侵物种之一[1,2]。在中国,薇甘菊于1919 年在香港出现,后逐渐蔓延至华南其他地区。薇甘菊在其原产地被广泛用作传统民间草药,可治疗脚气、皮肤瘙痒、蛇咬伤等疾病[3],其次生代谢产物丰富,包括单萜、倍半萜、二萜、三萜、黄酮、甾体等多种结构类型[4]。已有研究表明薇甘菊粗提物具有抗菌、抗肿瘤、抗病毒等作用[5,6];许华等[7]研究发现薇甘菊粗提物对黄瓜枯萎病菌等农业病原菌有一定的抑制效果;祝木金等[8]、郝彩琴等[9]研究发现,薇甘菊乙酸乙酯提取物对苹果炭疽病、番茄灰霉病、小麦赤霉病等植物病原菌真菌菌丝的生长具有显著的抑制作用。上述研究表明,薇甘菊粗提物具有抗植物病原真菌活性,而粗提物中具体的抗菌成分值得进一步研究。
核桃(Juglans regia)又称胡桃,是一种世界性分布的重要“木本粮油”生态树种。中国是核桃的产地之一,其种植面积和产量居世界前列。中国核桃产区普遍受到黑斑病、炭疽病及枯枝病等病害的危害[10-12],严重影响核桃的品质和质量,且随着中国核桃种植面积逐渐增加,病害发生日趋严重。核桃病害防治仍依赖化学药剂,但随着人们对绿色无污染食品的需求和生态环保意识的提高,植物源杀菌剂已成为核桃病害防治的重要发展方向之一。冯小飞等[13]、谭亚婷等[14]研究发现飞机草、小飞蓬、波斯菊等菊科植物提取物对核桃病原真菌的生长均有不同程度的抑制效果,发掘了菊科植物在植物源杀菌剂方面的潜能。
本研究采用平皿法,以6 种核桃病原真菌为筛选模型,通过活性追踪不同溶剂萃取物对菌丝生长的抑制活性,发现抑制活性成分集中于乙酸乙酯萃取物中,进一步对该部分进行化合物的分离纯化,并进行了分离化合物的抑菌活性研究。本研究将为薇甘菊的综合开发利用提供新的依据,通过发掘薇甘菊在植物源杀菌剂方面的潜能,力求变废为宝,变害为利,为薇甘菊的资源化利用提供科学依据。
1 材料与方法
1.1 材料与菌种
1.1.1 供试植物来源 薇甘菊地上部分于2016 年8月采自云南省腾冲市,由西南林业大学胡世俊副教授鉴定。
1.1.2 供试菌株来源 供试菌株由采自云南省楚雄市、大理白族自治州等地发病的核桃病理组织中分离得到,分别为炭疽菌(Colletotrichumsp.)、拟茎点霉(Phompsissp.)、叶点霉(Phyllostictasp.)、链格孢(Alternariasp.)、壳二孢(Ascochytasp.)及壳梭孢(Fusicoccumsp.),均由西南林业大学生命科学学院陈玉惠教授提供。
1.2 仪器与试剂
1.2.1 仪器 N-1100 型旋转蒸发仪,上海爱朗仪器有限公司;DL-1 型万用电炉,天津市赛得利斯实验分析仪器制造厂;正相色谱硅胶,青岛海洋化工厂;ZF-6 型三用紫外分析仪,上海嘉鹏科技有限公司;WPL-230BE 型恒温电热培养箱,天津市泰斯特仪器有限公司;无菌超净工作台,苏净集团苏州安泰空气技术有限公司;自动压力蒸汽灭菌器,致微(厦门)仪器有限公司;Bruker DRX 500 型核磁共振波谱仪,瑞士布鲁克公司。
1.2.2 试剂 多菌灵,四川国光农化股份有限公司;MCI 小孔树脂、40~70 μm 葡聚糖凝胶Sephadex LH-20,瑞典Amersham Pharmacia Biotech AB 公司;工业纯硫酸、分析纯乙醇、二甲基亚砜(DMSO)均购于云南杨林汕滇药业有限公司;石油醚、乙酸乙酯、正丁醇、丙酮、三氯甲烷、甲醇、乙腈均购于昆明锴泰纳工贸有限公司;氘代氯仿、氘代丙酮均购于美国Cambridge Isotope Laboratories 公司。
1.3 提取与分离
称取薇甘菊地上部分13.50 kg,风干粉碎,甲醇回流提取3 次,每次2 h,合并提取液,减压浓缩得到甲醇提取物浸膏,水溶解后依次用石油醚、乙酸乙酯、正丁醇萃取,分别减压浓缩后得到石油醚萃取物300.00 g、乙酸乙酯萃取物120.15 g 和正丁醇萃取物213.00 g。活性测定结果表明,乙酸乙酯萃取物对核桃病原菌的抑制活性较好,因此进一步对乙酸乙酯萃取物的化学成分进行活性追踪。乙酸乙酯萃取物用丙酮溶解后,经硅胶柱层析,依次用石油醚-丙酮(1∶0~0∶1,V/V)梯度洗脱,浓缩得到5 个馏分:Fr1(1.76 g)、Fr2(1.94 g)、Fr3(2.34 g)、Fr4(26.58 g)和Fr5(19.40 g)。Fr3 经MCI 色谱柱10%~95%甲醇溶液分离后,经葡聚糖凝胶色谱柱(三氯甲烷∶甲醇=1∶1,V/V)纯化后重结晶析出白色针晶,为化合物1(131.90 mg);Fr4 经MCI 色谱柱10%~95%甲醇溶液分离后,采用硅胶柱色谱分离,以氯仿-丙酮(1∶0~0∶1,V/V)洗脱,分成7 个亚部分,为Fr4-1 至Fr4-7,其中,Fr4-1 经重结晶析出白色不规则晶体,为化合物2(171.20 mg);Fr4-3 经葡聚糖凝胶色谱柱(三氯甲烷∶甲醇=1∶1,V/V)纯化为黄色不定形粉末,为化合物4(60.00 mg);Fr4-4 经液相色谱柱乙腈∶水(50∶50,V/V)分离纯化为白色针状结晶,为化合物3(93.00 mg);Fr5 经MCI 色谱柱10%~95%甲醇溶液分离后,经葡聚糖凝胶色谱柱(三氯甲烷∶甲醇=1∶1,V/V)纯化后重结晶析出淡黄色针状晶体,为化合物5(19.50 mg)。
1.4 薇甘菊化学成分抑菌活性测定
精确称取供试粗提物及化合物,采用二甲基亚砜将提取物配制成100.0 mg/mL,化合物配制成2.0 mg/mL 的母液,过滤除菌后于4 ℃冰箱保存备用。采用平皿法[15]测定薇甘菊甲醇提取物、不同萃取物及分离得到5 个化合物的抑菌活性。PDA 培养基灭菌后冷却至50 ℃以下,准确吸取一定量母液加入培养基中,粗提物稀释至1 mg/mL,单体化合物稀释至100 μg/mL 迅速摇匀倒平板,冷却后制成含药平板。用打孔器在供试菌种边缘打直径为4 mm 的菌饼,用镊子将菌饼接入平板中央,每皿放置1 个菌饼,将处理好的培养皿置于28 ℃的电热恒温培养箱培养,每个处理重复3 次。根据式(1)和式(2)计算菌丝生长抑制率。
1.5 薇甘菊化学成分毒力测定
将薇甘菊提取物母液加入熔化冷却至50 ℃的PDA 培养基,混匀,制备提取物含量为0.25、0.50、1.00、2.00 mg/mL 的PDA 平板;同样,制备单体化合物浓度为25、50、100、200 μg/mL 的PDA 平板,以加入等梯度的等体积DMSO 为对照,每个处理共5 个重复,接种与培养方式同“1.4”。采用几率值分析法,以药剂质量浓度对数为横坐标(x),抑菌活性概率为纵坐标(y),采用数据软件绘制毒力曲线,求得毒力回归方程和相关系数,计算EC50,对不同粗提物、化合物的毒力大小进行比较。
1.6 数据处理
数据均采用Excel 2010 软件进行统计,运用SPSS 17.0 软件(One-Way ANOVA,Duncan post hoc testP<0.05)进行多重比较分析。
2 结果与分析
2.1 化合物结构鉴定
化合物1:白色针状结晶;ESI+MS:m/z412[M+H]+,确定分子质量为412 u;分子式为C29H48O;1H NMR(CDCl3,500 MHz)δ:5.35(1H,m,-OH),5.14(1H,m,H-22),5.01(1H,m,H-23),3.52(1H,m,H-3),1.02(3H,s,H-21),1.00(3H,s,H-19),0.80(3H,d,J=7.6 Hz,H-29),0.78(3H,d,J=11.5 Hz,H-27),0.67(3H,d,J=9.2 Hz,H-18);13C NMR(CDCl3,500 MHz)δ:36.1(d,C-1),36.5(d,C-2),71.8(d,C-3),42.3(t,C-4),140.8(s,C-5),121.7(d,C-6),31.9(q,C-7),31.7(t,C-8),50.2(d,C-9),37.3(t,C-10),21.2(t,C-11),40.5(s,C-12),42.2(t,C-13),56.9(d,C-14),24.4(t,C-15),29.0(t,C-16),56.0(d,C-17),12.1(q,C-18),19.4(q,C-19),39.7(s,C-20),21.1(q,C-21),138.4(d,C-22),129.3(d,C-23),51.3(d,C-24),29.7(t,C-25),21.1(t,C-26),19.0(q,C-27),25.4(t,C-28),12.3(q,C-29)。上述数据与文献[16]报道基本一致,故鉴定化合物1 为豆甾醇。
化合物2:白色不规则晶体;ESI+MS:m/z291[M+H]+,确定分子质量为290 u;分子式为C15H14O6;1H NMR(CD3COCD3,500 MHz)δ:7.62(1H,d,J= 1.8 Hz,H-3),6.24(2H,d,J= 3.6 Hz,H-13),4.48(1H,dd,J= 3.1,6.0 Hz,H-6),2.28(1H,d,J= 16.9 Hz,H-1),2.25(2H,dd,J=11.0,2.5 Hz,H-9),1.12(3H,s,H-14);13C NMR(CD3COCD3,500 MHz)δ:58.4(d,C-1),56.3(d,C-2),50.8(d,C-3),130.9(s,C-4),149.3(d,C-5),84.3(d,C-6),51.1(d,C-7),77.4(d,C-8),43.7(t,C-9),57.9(s,C-10),139.6(s,C-11),168.2(s,C-12),122.2(t,C-13),21.6(q,C-14),171.3(s,C-15)。上述数据与文献[17-19]报道基本一致,故鉴定化合物2 为薇甘菊内酯。
化合物3:白色针状结晶;ESI+MS:m/z299[M+ Na]+,确定分子质量为276 u;分子式为C15H16O5;1H NMR(CD3COCD3,500 MHz)δ:7.78(1H,brs,H-5),5.44(1H,brs,H-6),4.81(1H,m,H-8),3.49(2H,d,J= 1.5 Hz,H-2),1.15(3H,s,H-14);13C NMR(CD3COCD3,500 MHz)δ:61.9(d,C-1),23.7(t,C-2),22.3(t,C-3),149.6(d,C-5),82.8(d,C-6),50.7(d,C-7),78.5(d,C-8),44.3(t,C-9),57.3(s,C-10),133.1(s,C-11),138.8(s,C-12),22.2(t,C-12),172.6(s,C-13),20.5(q,C-14),168.4(s,C-15)。上述数据与文献[20]报道基本一致,故鉴定化合物3 为去氧薇甘菊内酯。
化合物4:黄色不定形粉末;ESI+MS:m/z353[M + Na]+,确定分子质量为330 u;分子式为C17H14O6;1H NMR(CDCl3,500 MHz)δ:8.54(2H,dd,J=8.8,8.8 Hz,H-2′,6′),6.77(1H,s,H-8),3.98(3H,s,7-OCH3),3.86(3H,s,6-OCH3);13C NMR(CDCl3,500 MHz)δ:123.8(d,C-1′),148.1(s,C-2),130.7(d,C-2′,6′),138.0(s,C-3),116.5(d,C-3′,5′),177.6(s,C-4),159.3(s,C-4′),152.7(s,C-5),132.4(s,C-6),161.0(s,C-7),91.2(d,C-8),152.5(s,C-9),105.8(S,C-10),56.4(q,6-OCH3),60.7(q,7-OCH3)。上述数据与文献[21]报道基本一致,故鉴定化合物4 为异泽兰素。
化合物5:淡黄色针状结晶;ESI+MS:m/z339[M + Na]+,确定分子质量为316 u;分子式为C16H12O7;1H NMR(CD3COCD3,500 MHz)δ:7.49(1H,dd,J= 2.2,7.7 Hz,H-6′),7.46(1H,d,J= 2.3 Hz,H-2′),6.98(2H,d,J=8.3 Hz,H-3′,5′),6.59(1H,s,H-8),6.57(1H,s,H-3),3.86(3H,s,6-OCH3);13C NMR(CD3COCD3,500 MHz)δ:123.8(s,C-1′),165.2(s,C-2),114.1(d,C-2′),103.6(d,C-3),146.4(s,C-3′),183.5(s,C-4),150.0(s,C-4′),154.0(s,C-5),116.6(d,C-5′),132.1(s,C-6),120.1(d,C-6′),157.5(s,C-7),94.6(d,C-8),153.9(s,C-9),105.7(s,C-10),60.6(q,6-OCH3)。上述数据与文献[22]报道基本一致,故鉴定化合物5 为泽兰黄酮。
化合物1 至化合物5 的化学结构如图1 所示。

图1 化合物1 至化合物5 的化学结构
2.2 薇甘菊粗提物的抑菌活性
采用平皿法测定了薇甘菊粗提物对6 种核桃病原真菌的菌丝生长抑制活性,结果见表1。由表1 可知,薇甘菊甲醇提取物、正丁醇萃取物、乙酸乙酯萃取物和石油醚萃取物对叶点霉均表现出一定的抑菌活性,抑菌率为17.82%~40.59%,其中,正丁醇萃取物对叶点霉的抑菌作用最强,显著高于其他粗提物;正丁醇萃取物、乙酸乙酯萃取物和石油醚萃取物对炭疽菌均表现出一定的抑菌活性,其中,乙酸乙酯萃取物对炭疽菌的抑菌作用最强,抑制率高达40.00%,显著高于其他粗提物;甲醇提取物对炭疽菌无抑菌活性;薇甘菊各粗提物对链格孢的抑菌活性差异显著,其中,甲醇提取物对链格孢的抑菌作用最强,显著高于其他粗提物,石油醚萃取物对链格孢的抑菌作用最差;各粗提物对壳梭孢的抑菌活性均较弱,抑菌率为0.39%~21.82%;甲醇提取物对拟茎点霉的抑菌作用最强,正丁醇萃取物对拟茎点霉无抑菌活性。上述结果表明,薇甘菊对供试6 种核桃病原菌的抑菌活性成分主要集中在乙酸乙酯萃取物中,因此,对乙酸乙酯萃取物的抑菌成分进行研究。

表1 薇甘菊提取物对6 种核桃病原菌的抑菌活性(单位:%)
2.3 薇甘菊粗提物对供试病原菌的毒力
对核桃病原真菌菌丝生长抑制活性的初筛结果表明,薇甘菊乙酸乙酯萃取物和正丁醇萃取物对供试病原菌表现出明显的抑制作用。进一步用浓度梯度法测定不同浓度的乙酸乙酯萃取物、正丁醇萃取物分别对炭疽菌、叶点霉菌丝生长的抑制活性,并建立浓度与抑制活性的回归方程,分析2 种萃取物对2种核桃病原真菌的毒力。由图2、表2 可知,不同浓度薇甘菊乙酸乙酯萃取物和正丁醇萃取物对供试病原菌的抑制率差异显著。在浓度为2.00 mg/mL 时,薇甘菊乙酸乙酯萃取物对炭疽菌菌丝生长的抑制率可达63.89%,EC50为1.250 00 mg/mL;正丁醇萃取物对叶点霉菌丝生长的抑制率为53.85%,EC50为1.660 000 mg/mL。毒力测定以多菌灵为阳性对照,其对炭疽菌的EC50为0.000 78 mg/mL,对叶点霉的EC50为0.000 49 mg/mL,毒力均高于薇甘菊萃取物。
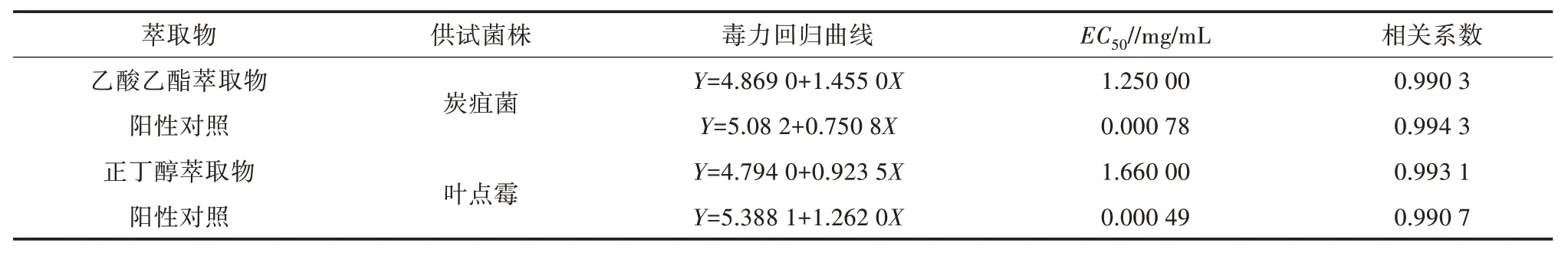
表2 薇甘菊粗提物对供试菌株的相对毒力
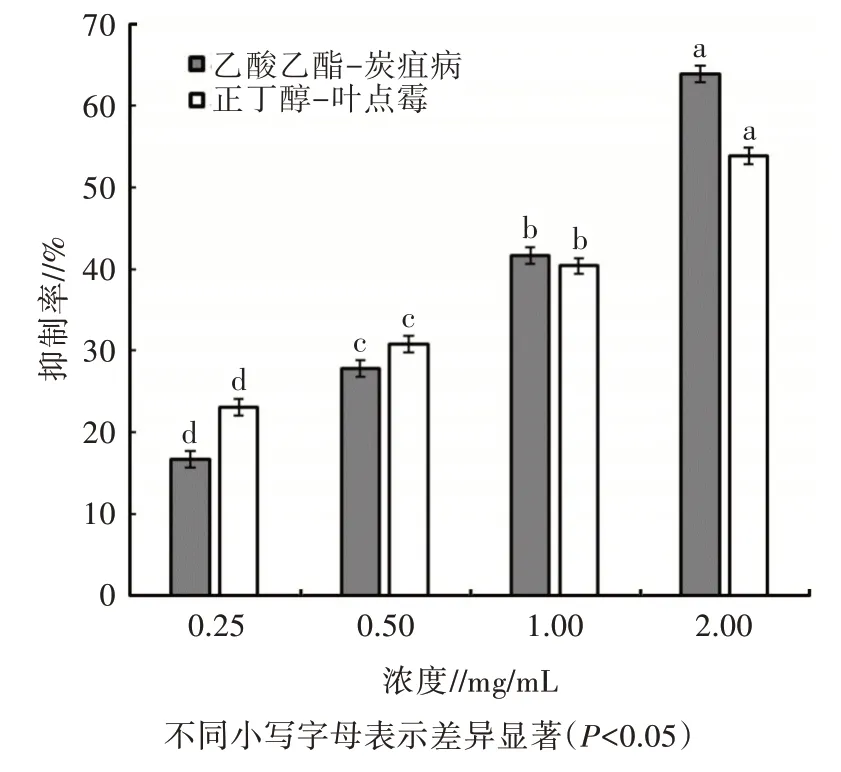
图2 不同浓度萃取物对供试菌株的抑制效果
2.4 化合物对供试病原菌的抑菌活性
从抑菌活性较好的乙酸乙酯萃取物分离纯化,得到5 个量大的化合物,以这5 个化合物为供试化合物,测定其对6 种核桃病原真菌菌丝生长的抑制活性。结果(表3)表明,不同化合物对各病原真菌菌丝生长抑制率之间的差异显著,5 个化合物具有较广谱的抑菌活性。5 个化合物对壳梭孢均表现出一定的抑菌活性,菌丝生长抑制率为12.26%~59.77%,其中,化合物2 对壳梭孢的抑制作用最强,化合物3次之;5 个化合物对拟茎点霉均表现出不同程度的抑菌活性,其中,化合物2 对拟茎点霉的抑制作用最强,抑制率高达62.65%,显著高于其他化合物,其次为化合物3。各化合物对壳二孢、叶点霉、炭疽菌、链格孢的抑菌活性强弱表现为化合物2>化合物3>其他3 个化合物(化合物1、化合物4、化合物5)。表明化合物2 和化合物3 对6 种核桃病原菌均表现出较好的抑菌作用,对拟茎点霉菌丝生长抑制作用较强。
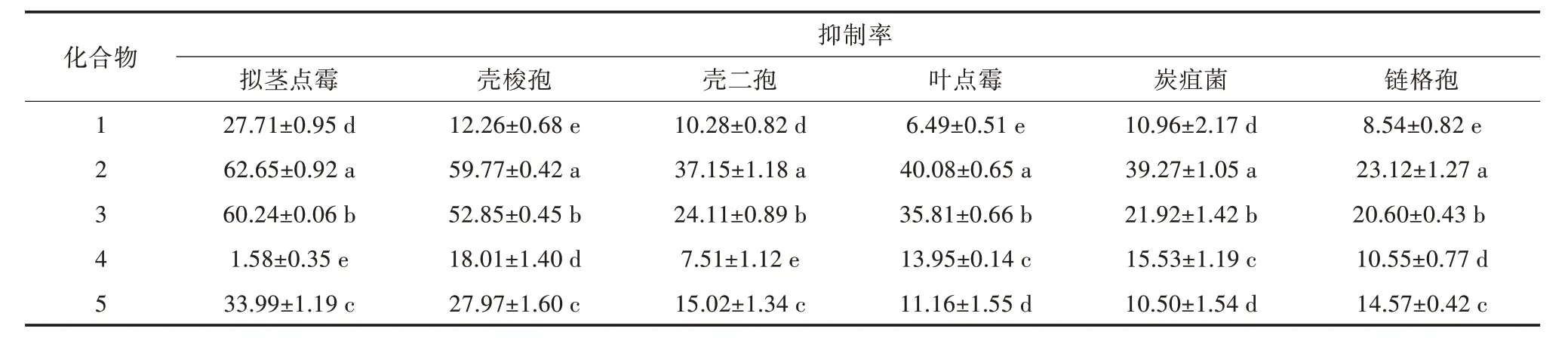
表3 化合物对6 种核桃病原真菌的抑菌活性(单位:%)
2.5 化合物对供试病原菌的毒力分析
进一步以抑菌活性较好的3 个量大的化合物2、化合物3、化合物5 为供试化合物,测定其对核桃病原真菌的抑菌毒力,结果(图3、表4、图4)表明,不同化合物对核桃病原真菌的毒力存在显著差异,且随着浓度的增加,5 个化合物的抑制效果均有所提高。在浓度为200 μg/mL 时,化合物2、化合物3 和化合物5 对拟茎点霉的菌丝生长抑制率分别为71.33%、72.00%、53.00% μg/mL,EC50分别为60.62、89.13、190.55 μg/mL,毒力测定以多菌灵为阳性对照药剂,其对拟茎点霉的EC50为0.08 μg/mL,3 个化合物对拟茎点霉的毒力显著低于阳性对照。在浓度为200 μg/mL 时,化合物2、化合物3 对壳梭孢菌丝生长抑制率分别为72.84%、71.60%,EC50分别为43.65、61.66 μg/mL;化合物2 对叶点霉、壳二孢、炭疽菌菌丝生长均表现出较好的抑制作用,抑制率为53.06%~60.67%,其EC50分别为218.78、144.54、138.04 μg/mL,毒力测定以多菌灵为阳性对照,其对叶点霉的EC50为0.49 μg/mL,对壳二孢的EC50为0.07 μg/mL,对壳梭孢的EC50为14.79 μg/mL,对炭疽菌的EC50为0.78 μg/mL,对拟茎点霉的EC50为0.08 μg/mL,毒力均高于从薇甘菊乙酸乙酯提取物中分离的3 个化合物。
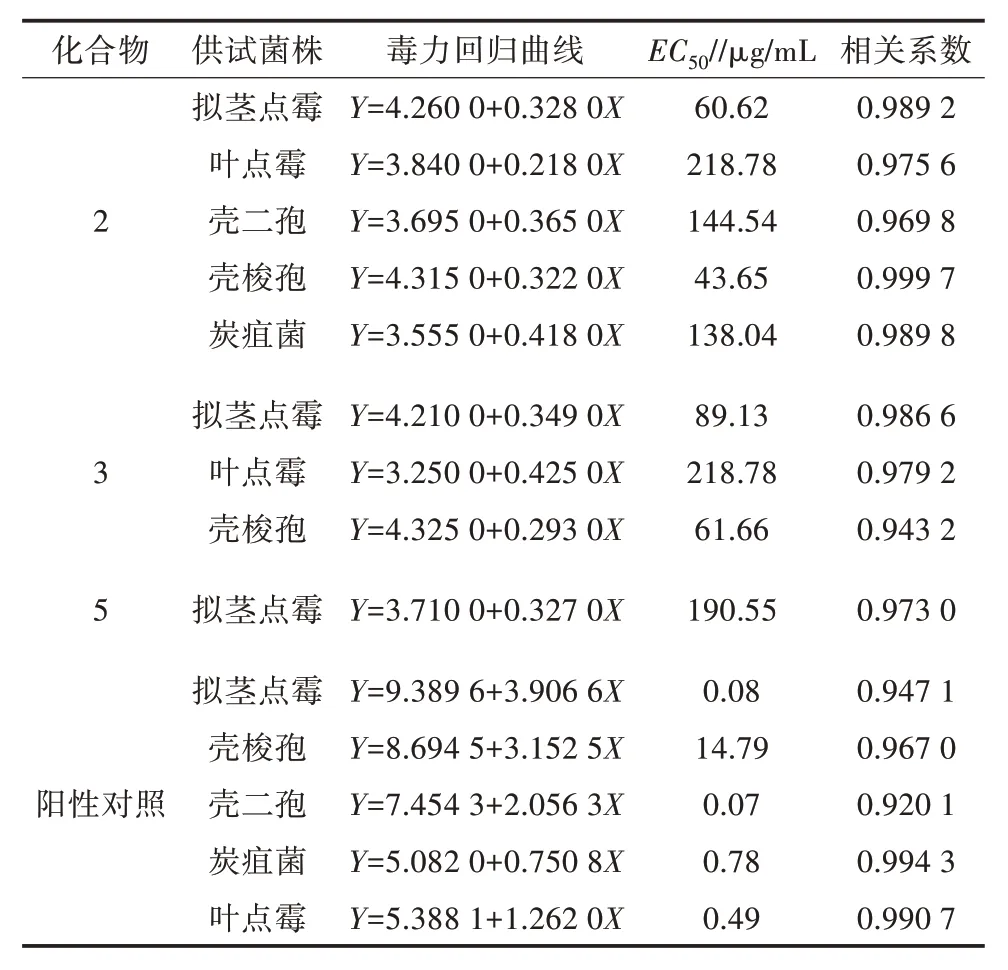
表4 化合物对供试菌株的相对毒力
3 小结与讨论
本研究对薇甘菊粗提物及从中分离的化合物的抑菌活性进行测定,结果表明,薇甘菊粗提物及其化合物对供试的6 种核桃病原真菌菌丝生长都有一定的抑制作用,且呈明显的剂量效应,随着粗提物、化合物浓度升高,抑菌率也相应增大。研究发现,薇甘菊对供试6 种核桃病原菌的抑菌活性成分主要集中在乙酸乙酯萃取物中,可能是由于抑制核桃病原真菌的活性成分极性与乙酸乙酯极性相似。该萃取物经多种柱层析技术分离纯化得到5 个化合物,比较发现,化合物2 和化合物3 能够有效抑制拟茎点霉、壳梭孢病原菌,抑制率为52.85%~62.65%,进一步测定了化合物2、化合物3、化合物5 对几种核桃病原真菌的抑菌毒力,化合物2(薇甘菊内酯)对拟茎点霉的EC50为60.62 μg/mL,对壳梭孢的EC50为43.65 μg/mL;化合物3(去氧薇甘菊内酯)对拟茎点霉的EC50为89.13 μg/mL、对壳梭孢的EC50为61.66 μg/mL,该结果与已报道的吉玛烷型倍半萜内酯类化合物薇甘菊内酯、去氧薇甘菊内酯具有抗菌作用相吻合[23]。祝木金等[8]、郝彩琴等[9]研究发现,薇甘菊乙酸乙酯提取物对多种植物病原真菌菌丝的生长具有显著的抑制作用。董丽梅[24]研究发现薇甘菊中的单体化合物主要为倍半萜和二萜类化合物,并且发现吉玛烷型倍半萜内酯对植物病原细菌青枯假单胞菌和萎蔫短小杆菌的抑制活性显著。马秋等[25]研究发现薇甘菊中吉玛烷型倍半萜类化合物薇甘菊内酯和二氢薇甘菊内酯对绿脓杆菌、枯草芽孢杆菌、金黄色葡萄球菌等表现出抑菌作用。庄世宏等[26]从薇甘菊中分离得到4 种抑菌活性物质,包括去氧薇甘菊内酯、二氢薇甘菊内酯、豆甾醇和β-谷甾醇,发现去氧薇甘菊内酯和二氢薇甘菊内酯对小麦纹枯病菌、辣椒疫霉病菌和棉花立枯病菌的菌丝生长抑制作用较强。综上所述,推测薇甘菊抑菌活性成分主要为倍半萜类化合物,本研究发现薇甘菊内酯、去氧薇甘菊内酯对6 种核桃病原菌的抑制效果较其他3 个化合物显著,与上述研究结果中倍半萜类物质具有较强的生物活性一致,进一步丰富了薇甘菊的抑菌生物活性谱,发掘了薇甘菊在植物源抑菌药物方面的潜能。
本研究发现,从薇甘菊乙酸乙酯萃取物中分离到的薇甘菊内酯、去氧薇甘菊内酯对拟茎点霉、壳梭孢、壳二孢、叶点霉、炭疽菌及链格孢6 种核桃病原真菌的菌丝生长都表现出了一定的抑制活性,说明这2 个化合物对上述6 种病原真菌的菌丝体生长造成一定的影响,阻碍其在培养基上的正常生长。本研究明确了活性化合物的结构和种类,为核桃病原菌的防治提供了参考,也为薇甘菊的资源化利用提供新的依据。
