急诊经皮冠状动脉介入治疗术后围术期心肌肌钙蛋白T水平对心肌内出血的预测价值
2023-06-03任道元陈铟铟金航徐仁德戴宇翔黄嘉王齐兵钱菊英
任道元 陈铟铟 金航 徐仁德 戴宇翔 黄嘉 王齐兵 钱菊英
急性心肌梗死(acute myocardial infarction,AMI)仍然是我国致死及致残的主要病因之一。ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)的早期再灌注治疗可以有效减少最终梗死面积,并减少主要不良心血管事件(major adverse cardiovascular events,MACE)[1]。然而,即使在冠状动脉的血流恢复后,手术中常常可见冠状动脉血流并未完全恢复,即无复流现象,这种现象通常被称为再灌注损伤。再灌注损伤是多种机制共同参与的一种复杂病理生理过程,微血管内皮微环境损伤在再灌注损伤中有重要作用[2]。既往研究表明,再灌注损伤可导致高达50%的最终梗死面积,但具体因素尚未明确[3]。且再灌注损伤会造成心脏功能的进一步损伤,并影响心肌梗死患者的预后[4-5]。鉴于目前临床试验中,尚没有成熟治疗方法可以有效控制再灌注损伤[6-7],因此进一步寻找生物标志物对于预测再灌注损伤发生和判断预后至关重要[8]。由于再灌注损伤可破坏心肌微血管结构及功能,导致微血管内红细胞外渗,心肌内出血(intramyocardial hemorrhage,IMH)在一定程度上可反映心肌再灌注损伤程度。同时,心肌梗死再灌注术后不同时间点心肌肌钙蛋白T(cardiac troponin T,cTnT)水平存在明显差异。既往研究提示,cTnT可用于评估心肌梗死患者风险程度[9]。本研究旨在探讨IMH对STEMI患者再灌注后围术期cTnT水平的影响,并评估cTnT水平对IMH的预测价值。
1 对象与方法
1.1 研究对象
前瞻性、连续性纳入复旦大学附属中山医院2018年1月至2019年8月共计70例STEMI患者。纳入标准:(1)诊断为STEMI患者(符合缺血性胸痛、具备心电图动态演变及血清心肌标志物浓度动态演变三项中的二项),起病后24 h内成功行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)再灌注治疗者;(2)年龄18~70岁。排除标准:既往冠状动脉再通及心肌梗死、心律失常、肾功能不全、既往心脏磁共振成像(cardiac magnetic resonance,CMR)对比剂过敏史、图像质量差、金属假体置入和幽闭恐惧症。所有患者在PCI术后4~7 d接受CMR检查。本研究经复旦大学附属中山医院伦理委员会批准,所有研究对象均已签署知情同意书(伦理批件号:B2018-286)。
1.2 CMR检查及图像分析
CMR采用Siemens MAGNETOM Area 1.5 T超导M R 仪。梯度场强45 m T/m,梯度切换率200 mT/(m.ms),心电门控采用CMR兼容的无线心电门控板。采用头先进仰卧位扫描,先后获得长轴和短轴电影图像及短轴位T2* mapping图像,注射对比剂后10 min行长轴和短轴延迟增强(late gadolinium enhancement,LGE)成像。
图像分析:由1名具有7年以上CMR经验的放射科医师使用Cvi42软件(Circle Cardiovascular Imaging Inc.,Calgary,Canada)分析图像。电影图像行心功能分析,获得左心室射血分数(lef t ventricular election factor,LVEF)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDV)和左心室收缩末期容积(left ventricular end-systolic volume,LVESV)。于T2*图像上描记心肌内出血区域,定义平均信号强度低于远处心肌平均信号强度2个标准差的区域为IMH,并测量IMH容积和IMH T2*值。将LGE图像信号强度高于远处心肌平均信号强度5个标准差的区域描记为梗死区,手动描记微血管阻塞(microvascular obstruction,MVO)区并计入梗死区,获得梗死容积。
1.3 观察指标
将患者按CMR检查结果分为IMH组及非IMH组。分别收集两组患者基线临床资料,包括年龄、性别、身体质量指数、体表面积、收缩压、舒张压、心血管危险因素、冠状动脉造影结果(包括罪犯血管)及实验室检查结果(包括血常规、血生化及心脏标志物)。获取资料的方法为从住院病史摘录。围术期cTnT水平的测量为分别采集患者术前、PCI术后即刻、术后1 d、术后3 d及术后5~7 d共5个时间点的血清,测定各自的cTnT数值,并记录下峰值cTnT。
1.4 统计学分析
采用SPSS 22.0进行统计学分析,计量资料满足正态分布的以均数±标准差描述,组间均数比较采用独立样本t检验;不符合正态分布的采用中位数(四分位数间距)[M(Q1,Q3)]表示。计数资料以[例(%)]表示,采用χ2检验行组间比较。鉴于cTnT不符合正态分布,相关性分析采用Spearman秩相关分析。受试者工作特征(receiver operating characteristics,ROC)曲线分析不同时间点cTnT预测IMH的诊断效能,曲线下面积(area under ROC curve,AUC)的比较采用DeLong法。以P<0.05为差异有统计学意义。
2 结果
本研究共排除6例患者,其中3例患者因幽闭恐惧症无法完成CMR检查,另有3例患者的T2*图像无法评估。最终入组64例患者,根据CMR T2*图像19例确定为非出血性梗死(非IMH组),其余45例为出血性梗死(IMH组,图1)。
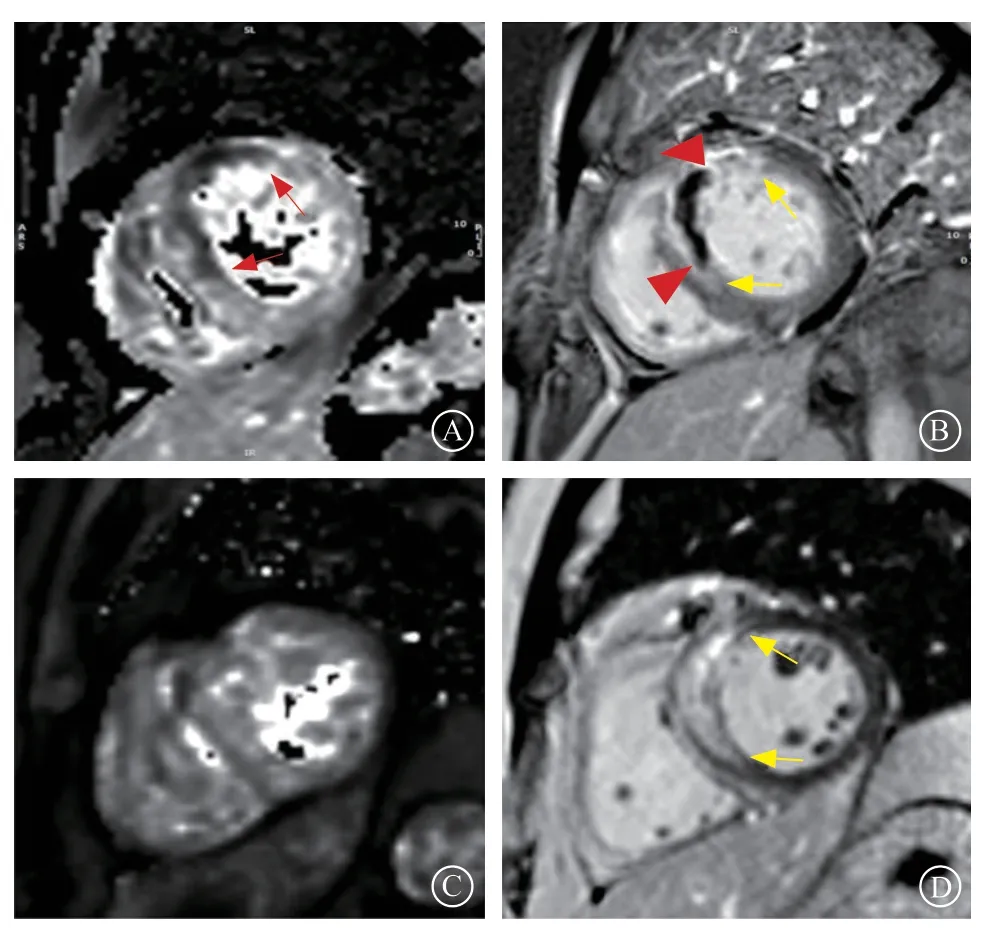
图1 典型STEMI 患者CMR 图像 A.T2*mapping 图显示左心室前壁下内膜下低信号区域(IMH),红箭头示IMH 区域;B.同层面LGE 图像显示左心室前壁见斑片LGE(梗死区)及中心的低信号区(MVO 区),红箭头示MVO 区域,黄箭头示LGE 阳性区域;C.T2*mapping 图显示左心室未见明显信号减低区域(非IHM);D.同层面LGE 图像显示左心室前壁及前间隔下内膜下见斑片LGE(梗死区),LGE 内无低信号区域,黄箭头示梗死区Figure 1 CMR images of typical STEMI patients
2.1 非IMH组和IMH组基线及影像学特征比较(表1)
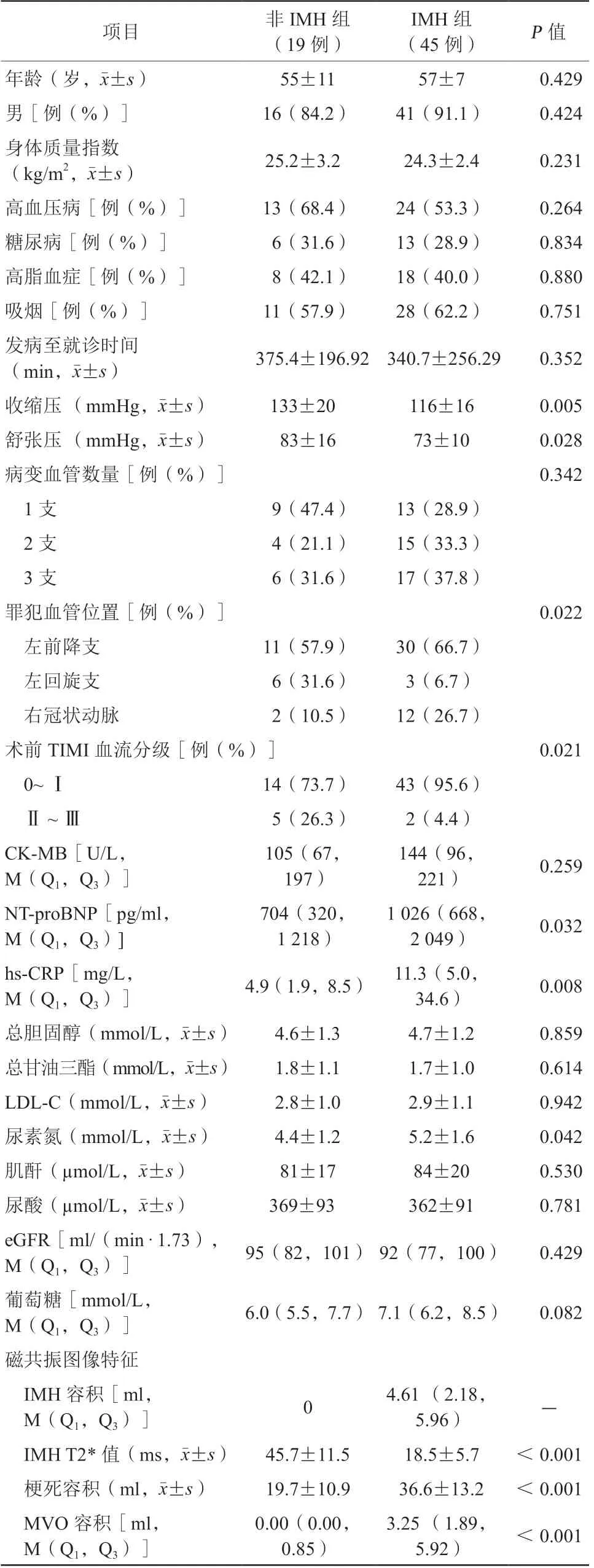
表1 两组患者基线及影像学特征比较Table 1 Baseline and imaging characteristics of patients
非IMH组与IMH组发病至就诊时间比较,差异无统计学意义,同时两组患者性别、高血压病、糖尿病、高脂血症、吸烟、总胆固醇、低密度脂蛋白胆固醇以及血糖等资料的比较,差异均无统计学意义(均P>0.05)。非IMH组入院收缩压[(133±20)mmHg比(116±16)mmHg,1 mmHg=0.133 kPa,P=0.005]及舒张压[(83±16)mmHg比(73±10)mmHg,P=0.028]均高于IMH组,而N末端B型脑钠肽前体[704(320,1 218)pg/ml比1 026(668,2 049)pg/ml,P=0.032]、超敏C反应蛋白[4.9(1.9,8.5)mg/L比11.3(5.0,34.6)mg/L,P=0.008]均低于IMH组,差异均有统计学意义。在造影结果中,罪犯病变多位于左前降支,IMH组比例高于非IMH组(66.7%比57.9%,P=0.022);同时术前罪犯病变心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级0~Ⅰ级比例更低(73.7%比95.6%,P=0.021)。在CMR结果中,IMH组IMH T2*值[(18.5±5.7)ms比(45.7±11.5)ms]低于非IMH组,心肌梗死容积[(36.6±13.2)ml比(19.7±10.9)ml]以及MVO容积[3.25(1.89,5.92)ml比0.00(0.00,0.85)ml]均大于非IMH组,差异均有统计学意义(均P<0.001)。
2.2 非IMH组和IMH组患者各时间点cTnT水平及演变
术前cTnT水平两组患者比较,差异无统计学意义(P=0.116)。IMH组患者在术后各个时间点(术后即刻、术后即刻与术前变化量、术后1 d、术后3 d及术后5~7 d)的cTnT水平均高于非IMH组患者,差异均有统计学意义(均P<0.05,表2)。
表2 IMH 组和非IMH 组患者各时间点cTnT 值水平比较(ng/ml,±s)Table 2 Comparison of cTnT values at each time point of IMH and control(ng/ml,±s)
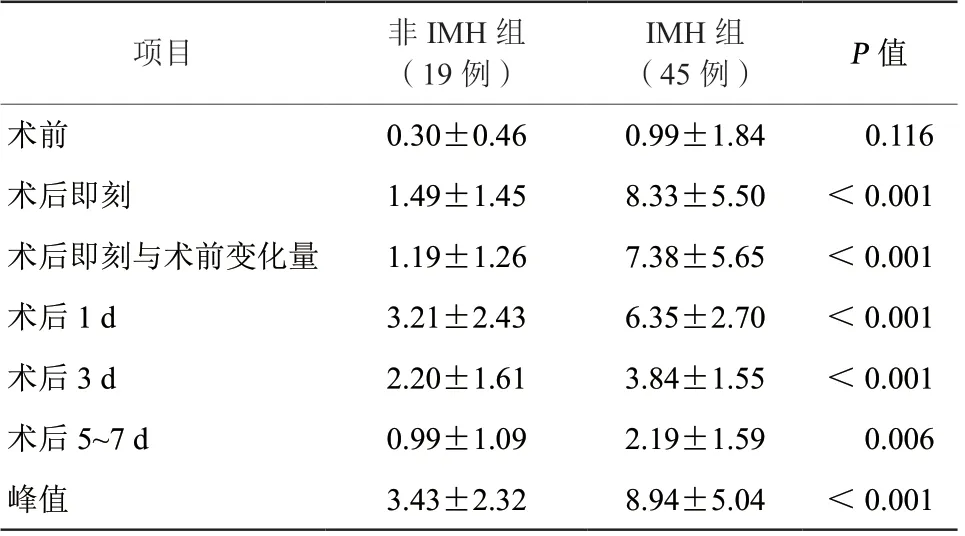
表2 IMH 组和非IMH 组患者各时间点cTnT 值水平比较(ng/ml,±s)Table 2 Comparison of cTnT values at each time point of IMH and control(ng/ml,±s)
注:IMH,心肌内出血;cTnT,心肌肌钙蛋白T。
项目非IMH 组(19 例)IMH 组(45 例)P 值术前0.30±0.460.99±1.84 0.116术后即刻1.49±1.458.33±5.50<0.001术后即刻与术前变化量1.19±1.267.38±5.65<0.001术后1 d3.21±2.436.35±2.70<0.001术后3 d2.20±1.613.84±1.55<0.001术后5~7 d0.99±1.092.19±1.59 0.006峰值3.43±2.328.94±5.04<0.001
IMH组术后即刻cTnT水平即到达峰值,之后呈线性下降趋势,且一直维持在较高水平(术后即刻、术后1 d均值均>5 ng/ml);而非IMH组患者cTnT水平在术后上升幅度较慢,在术后1 d到达峰值,且下降趋势亦较慢,但总体cTnT水平均较低(围术期各个时间点均<5 ng/ml)。
2.3 cTnT与CMR参数的相关性分析
基于不同时间点的cTnT相关性分析显示,术后即刻cTnT水平、峰值cTnT水平与CMR各参数的Spearman秩相关性最强(表3)。其中术后即刻cTnT及峰值cTnT与IMH容积呈正相关,秩相关系数分别为0.76和0.74(均P<0.001);与IMH T2*值呈负相关,秩相关系数分别为-0.68和-0.65 (均P<0.001);与梗死容积呈正相关,秩相关系数分别为0.55和0.50(均P<0.001);与LVEF呈负相关,秩相关系数分别为-0.66和-0.59(均P<0.001)。
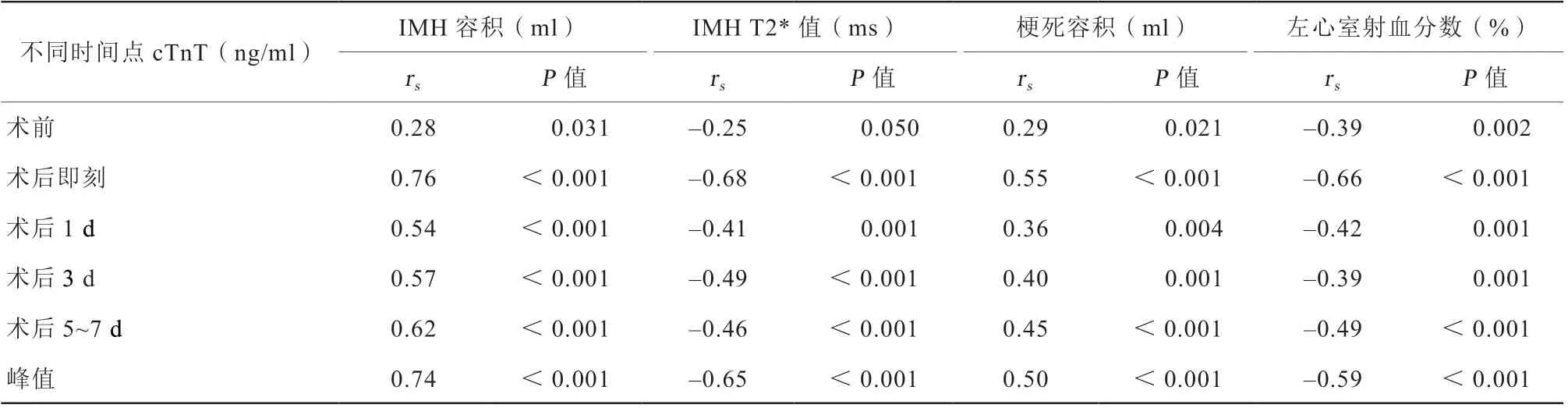
表3 cTnT 与CMR 参数的秩相关系数Table 3 Rank correlation coeffi cients between cTnT and CMR parameters
2.4 围术期cTnT在预测IMH中的价值
ROC曲线分析显示:术后即刻cTnT预测心肌梗死患者PCI术后发生IMH具有最大的AUC,为0.95(P<0.001),敏感度、特异度及准确度分别为75.6%、100.0%和82.8%,截断值为4.71 ng/ml。术后即刻cTnT预测IMH的AUC与峰值cTnT的AUC差异无统计学意义(P=0.191),而与术后1 d(P=0.025)、术后3 d(P=0.034)及术后5~7 d(P=0.018)的差异均有统计学意义(图2)。将前述单因素统计有差异的变量进一步行单变量和多变量Logistic回归分析,单变量回归分析显示,术前TIMI血流分级(OR0.65,95%CI0.45~0.90,P=0.032)、术后即刻cTnT(OR2.40,95%CI1.44~4.00,P=0.001)、梗死容积(OR1.07,95%CI1.02~1.12,P=0.003)为STEMI患者发生IMH的危险因素;进一步进行多变量回归分析显示,术后即刻cTnT(OR2.40,95%CI1.44~4.00,P=0.001)仍
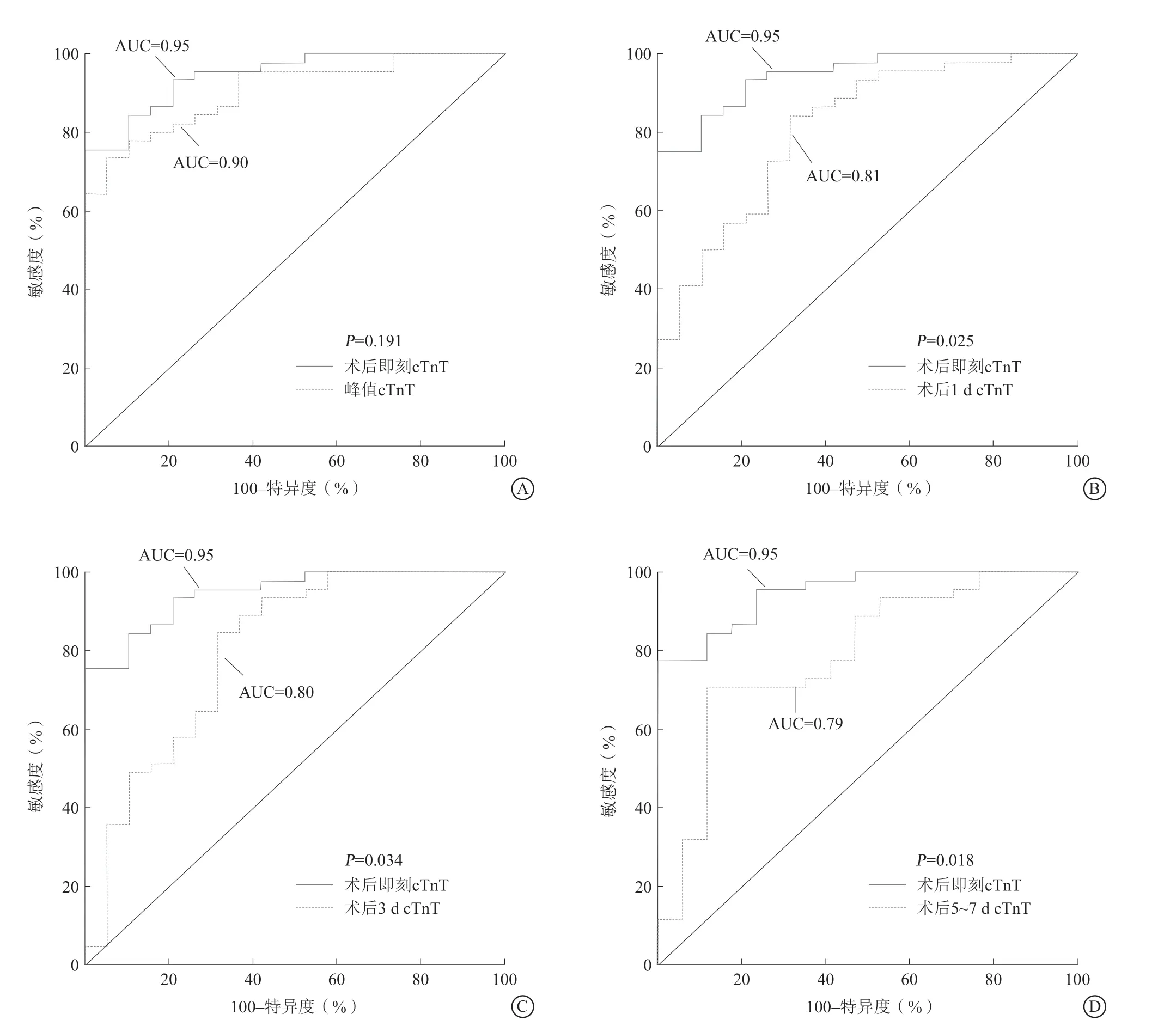
图2 围术期各时间点cTnT 在预测IMH 中的价值 A.术后即刻cTnT 预测IMH 的效能与峰值cTnT 比较;B.术后即刻cTnT 预测IMH 的效能与术后1 d 比较;C.术后即刻cTnT 预测IMH 的效能与术后3 d 比较;D.术后即刻cTnT 预测IMH 的效能与术后5~7 d 比较Figure 2 The value of cTnT in predicting IMH at each time point in perioperative period
是STEMI患者发生IMH的独立危险因素(表4)。
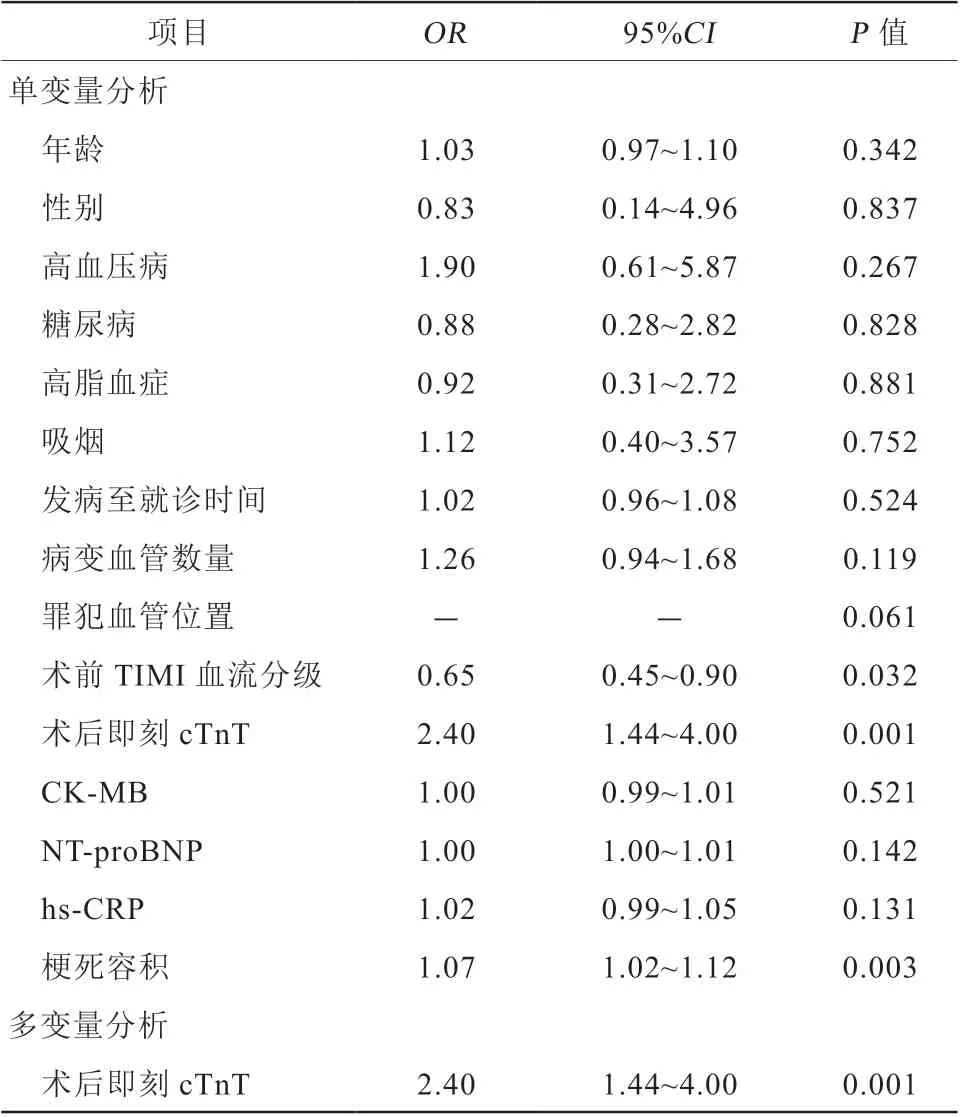
表4 单变量和多变量Logistic 回归分析IMH 的预测因子Table 4 Predictors of IMH in univariate and multivariate Logistic regression analysis
3 讨论
本研究中主要发现:(1)存在IMH的患者梗死容积较大且术后各个时间点(术后即刻、术后1 d、术后3 d及术后5~7 d)cTnT水平均较高;(2)相关性分析显示,IMH容积、IMH T2*值及梗死容积与cTnT水平显著相关;(3)通过ROC曲线分析得出,围术期cTnT水平均存在有效预测IMH的价值,其中术后即刻预测IMH的AUC值最高(0.95),最佳预测截断值为4.71 ng/ml。
目前已知再灌注损伤通过多种机制导致AMI患者再灌注治疗后发生并发症:再灌注损伤可破坏心肌微血管结构及功能,导致微血管内红细胞外渗,进而出现IMH。目前已知IMH及MVO与心肌梗死面积的扩大、左心室的心肌重构及不良心血管事件相关[10]。研究表明,STEMI患者急诊PCI术后12个月内发生MACE均与发生MVO、IMH有关,且MACE与IMH的关系较其与MVO更密切,因此IMH可为评估AMI患者预后提供更多信息[11]。
IMH中外渗红细胞内的氧合血红蛋白降解产物含铁,为顺磁性物质,使T2图像上显示为低信号,因而T2*W序列可有效诊断 IMH[12]。而基于梯度回波序列产生的T2*信号对此类顺磁性物质不均匀性较传统T2信号更敏感,更有利于评估IMH。因此,目前已经公认CMR T2*及T2* mapping定量技术是定量评估IMH的标准方法。而在真实世界的临床实践中,CMR常常因为检查时间、患者的呼吸配合、心律、心率等因素,使用上相对存在一些限制。同时,鉴于目前检查T2*mapping序列空间分辨力有限,可能需要在一个层面上多次成像,进一步延长CMR检查时间,使部分再灌注治疗后心功能不全患者难以耐受MRI。为此,本研究的目标为寻找合适临床标志物以便捷快速预测MVO及IMH发生。
研究表明,即使在再灌注后,MVO及IMH的初始区域可以继续扩展长达48 h[13]。尽管临床上观察到大面积心肌梗死伴有IMH,但IMH是否存在进一步影响心肌重构的作用至今尚在探讨中。众所周知,外渗的红细胞可通过炎症反应引起“二次水肿”,并进一步压迫血管床诱发微血管痉挛,同时外渗的红细胞释放的过量铁元素可致心肌细胞铁过载及铁死亡,导致梗死进一步扩大和心功能恶化。因此,IMH引入心肌产生的两种效应都可能导致梗死区扩大[14]。既往研究已证明MVO仍然代表着缺血后冠状动脉微血管损伤的严重程度,并显著影响左心室重构和长期预后,与梗死面积和LVEF独立相关[15]。本研究进一步提示存在IMH患者cTnT水平明显高于非IMH患者,提示MVD及IMH在心肌组织致微循环功能障碍中发挥重要作用。
值得注意的是,本次研究中IMH的阳性率为70%,高于既往研究中的报道,这可能与以下原因有关:(1)T2*加权图像容易受到非共振效应的影响,如运动或血流伪影,形成干扰;(2)患者病变较复杂,本研究中多支血管病变患者比例较既往研究高[16],多支病变出现反复缺血情况更重,患者无复流发生率、心功能受影响程度更大;(3)IMH受检查时间影响,有证据表明[17],IMH的阳性率在术后第3天达到峰值,在术后第10天明显下降。
考虑到cTnT水平在心肌梗死发生后存在动态性改变,就诊时间长度可能影响cTnT变化。而分析本次入组STEMI患者发病至就诊时间两组之间相仿[(375.4±196.9)min比(340.7±256.3)min],因此,两组cTnT水平不存在时间上的偏倚。目前临床上cTnT峰值已普遍用于间接测量梗死面积,并为临床提供再灌注治疗质量的无创性估计。但在近年来的研究中,围术期cTnT水平变化也被赋予新的临床意义,有研究已经通过增强CMR证明,接受再灌注治疗的患者cTnT升高可能反映了与梗死面积无关的大灌注缺陷[18]。在本次研究扩展之前的研究结果,证明可以分别通过术后和峰值时间cTnT有效预测IMH。同时,鉴于本研究中单点cTnT与峰值cTnT的预测价值相当,即本研究证实根据术后即刻cTnT水平即可有效预测IMH的发生,进而可有效减少过多CMR检查及监测cTnT水平变化,进而减少医疗花费及患者痛苦,使诊治IMH流程更为便捷。
本研究也存在一些不足:样本量较少,且患者均来自同一家医院,可能缺乏代表性,因此,需要更多的多中心前瞻性研究来进一步证实。
综上所述,cTnT作为临床常用的心肌酶谱标志物,是预测IMH的重要独立预测因子。本研究提示,在临床工作中,cTnT作为一种简单、经济、可重复的临床检查,可能为判断患者IMH乃至再灌注损伤提供一个方便而可靠的参考依据,将显著提高预测再灌注损伤并分析预后的效用,有助于及早发现高危再灌注损伤患者,并借此提供及时的临床指导及治疗干预。
利益冲突所有作者均声明不存在利益冲突
