Rap1GAP 激酶通过 AMPK 信号通路影响宫颈癌细胞增殖、侵袭及迁移的研究
2023-06-01李金秋王玲秦祥川阿仙姑哈斯木
李金秋,王玲,秦祥川,阿仙姑·哈斯木
新疆医科大学基础医学院/新疆地方病分子生物学重点实验室,新疆乌鲁木齐 836001
子宫颈癌(cervical cancer,CC)是常见的女性恶性肿瘤之一,同时子宫颈癌作为新疆地区的高发肿瘤之一,其发病率和病死率正在逐年增加并趋向年轻化[1-2]。宫颈癌的发生发展涉及多种机制,人乳头瘤病毒(human papillomavirus,HPV)是目前已知的引起宫颈癌的主要原因,除此之外,CC 的发生与免疫机制、家族遗传、性生活紊乱等因素有关[3]。目前,手术、放疗、化疗等治疗CC 的技术取得了很大进展,新的治疗方法也逐渐应用于临床,但无法控制淋巴结的转移仍是疾病进展、治疗失败的主要原因[4]。肿瘤细胞快速增殖和难以控制的盆腔淋巴结转移是造成晚期宫颈癌患者死亡的主要原因[5]。
Rap1 GTP 酶激活蛋白(Rap1 GTPase-activating protein,Rap1GAP)是Rap1 的GTP 酶激活蛋白,可以使与Rap1 结合的GTP 水解为GDP,从而促进蛋白失活[6]。Rap1GAP 家族作为肿瘤抑癌基因,近些年被研究者们逐渐认识。Rap1 是Ras 家族的成员之一,是一种小分子G 蛋白,可影响细胞的增殖、黏附和血管生成等生理过程[7]。Rap1存在两种构象,与GDP 结合后使其失活,与GTP结合后可发挥其生物学效应。Rap1 活性失调与肿瘤的发展密切相关,故调控Rap1 活性的Rap1GAP也参与肿瘤的恶性进展。已有研究显示,Rap1GAP抑制胃癌细胞的增殖、侵袭和迁移,进而显著抑制胃癌的进展[8]。在脑胶质瘤中,Rap1GAP 表达较低,其低表达导致患者不良预后[9]。本研究旨在探索Rap1GAP 对宫颈癌细胞生物学功能的影响以及可能的分子机制,为宫颈癌的发病机制研究及提高患者预后提供一定理论基础。
材料与方法
1 实验材料 宫颈癌SiHa 细胞、C33a 细胞购于武汉普诺赛公司,正常宫颈上皮H8 细胞购于上海细胞库。慢病毒由上海吉凯公司负责构建;一抗:Rap1GAP (19174-1-AP)、E-cadherin (20874-1-AP)、N-cadherin (22018-1-AP)和 β-actin (20536-1-AP)购于美国ProteintechGroup 公司;AMPK (2532S)和p-AMPK (50081S)抗体购于美国Cell Signaling Technology 公司;DMEM 和MEM (NEAA)培养基购于武汉普诺赛公司;Trizol 试剂和逆转录cDNA 试剂盒购于美国Themo 公司;实时荧光定量TB Green Premix Ex TaqTMⅡ (Tli RNaseH Plus)的试剂盒购于日本的TaKaRa 公司;(356234) Matrigel胶购于美国的BD 公司。
2 生物信息学分析 从UCSC (https://xenabrow ser.net)数据库中下载经统一标准化的泛癌数据集:TCGA TARGET GTEx (PANCAN,N=19 131,G=60 499),从中提取ENSG00000076864 (RAP1GAP)基因在宫颈癌样本中的表达数据,对每一个表达值进行log2 (x+0.001)变换,获得该基因在宫颈癌中的表达数据。
3 细胞培养 宫颈癌SiHa (HPV16 阳性)细胞系与正常宫颈上皮H8 细胞系使用DMEM 完全培养基,宫颈癌C33a (HPV16 阴性)细胞系使用MEM(NEAA)完全培养基,上述两种细胞所用的完全培养基均包含10%胎牛血清和1%青霉素-链霉素,培养于37℃、5% CO2培养箱内。
4 qRT-PCR检测细胞Rap1GAP、E-cadherin 和N-cadherin 的基因表达水平 使用Trizol 法从细胞中提取总RNA,随后利用逆转录试剂盒转录为cDNA 。采用试剂实时荧光定量TB Green Premix Ex TaqTMⅡ (Tli RNaseH Plus)试剂盒对cDNA 扩增分析。应用β-actin 为内参基因进行归一化处理后得到对应基因的对表达量。Rap1GAP、E-cadherin、N-cadherin 和β-actin 引物序列见表1。

表1 qRT-PCR 检测基因的引物序列Tab.1 Primer sequences of genes detected by qRT-PCR
5 慢病毒转染及分组 OE-Rap1GAP、sh-Rap1GAP慢病毒及其对照慢病毒(NC-Rap1GAP)由上海吉凯基因医学科技股份有限公司负责构建。按照公司提供的转染实验手册进行转染实验,将对数生长的细胞经胰酶消化并制成(5~ 6) × 104/mL 的细胞悬液,分别吸取1 mL 细胞悬液置于六孔板中,当细胞量达到50%时,弃去完全培养基换成无血清培养基饥饿培养,24 h 后弃去无血清培养基并换成含血清培养基依据转染手册加入对应慢病毒,转染72 h后,用1 mg/mL 嘌呤霉素筛选转染成功的宫颈癌SiHa、C33a 细胞,持续筛选时间为5~ 7 d 。将筛选存活下来的细胞使用2.5 µg/mL 嘌呤霉素继续培养。
6 Western blot 检测细胞Rap1GAP、E-cadherin、N-cadherin、AMPK 和p-AMPK 的蛋白表达水平将细胞沉淀于细胞裂解液RIPA、蛋白酶抑制剂和磷酸酶抑制剂混合物中裂解30 min,将提取的蛋白样品经10% SDS-PAGE 凝胶进行电泳分离并转移至PVDF膜。使用5%脱脂牛奶常温封闭1.5 h,室温一抗孵育1 h 40 min,随后室温二抗(稀释比1∶10 000)避光孵育1 h,并通过ECL 化学发光仪显影。抗体稀释如下:Rap1GAP (1∶800),AMPK(1∶1 000),p-AMPK (1∶1 500),E-cadherin (1∶5 000),E-cadherin (1∶4 500),β-actin (1∶10 000)。
7 Transwell 实验检测细胞侵袭与迁移能力Transwell 侵袭检测:上室加入8~ 12 mg/mL 的Matrigel 60 µL,培养箱中放置2 h,随后向上室中加入5 × 104/200 µL 的无血清细胞悬液,下室加入600 µL 完全培养基;Transwell 迁移测定:按照上述方法将2.5 × 105个细胞置于1 mL 不含血清的培养基内,吹打混匀,吸取200 µL 的无血清细胞悬液接种于Transwell 的上室内,下室为600 µL 完全培养基(含有血清)。24 h 后取出24 孔板,使用4%多聚甲醛溶液固定细胞30 min,PBS 冲洗3次,每次5 min,使用1%结晶紫工作液室温染色10 min,用PBS 清洗,倒置显微镜下观察上室底面细胞数。
8 平板克隆实验检测细胞集落形成能力 使用6 孔板进行克隆形成试验。将不同分组的细胞以2 × 103/孔的细胞密度进行培养,培养7~ 10 d 观察集落大小和数量。
9 统计学分析数据 结果 以±s表示,使 用GraphPad Prism 7 软件和SPSS 19.0 软件进行统计学评估,两组变量进行比较采用独立样本t检验,多组组间变量进行比较应用单因素方差分析,两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
结果
1 Rap1GAP 在宫颈癌组织和宫颈癌细胞中的表达水平 利用数据库观察到Rap1GAP 在宫颈癌组织和正常宫颈上皮组织中的表达。结果显示,与正常宫颈上皮组织相比,宫颈癌组织中Rap1GAP的表达显著上调(P<0.05,图1A)。Western blot 技术在蛋白水平验证Rap1GAP 在子宫颈癌细胞(C33a、SiHa 细胞)和正常子宫颈上皮细胞(H8 细胞)中的表达情况。结果显示,与H8 细胞相比,Rap1GAP 在子宫颈癌C33a 细胞中高表达,在SiHa 细胞中低表达(P<0.05;C33avsSiHavsH8:1.407 ± 0.149vs0.667 ± 0.092vs1.013 ± 0.132,F=25.236,P=0.001。图1B)。
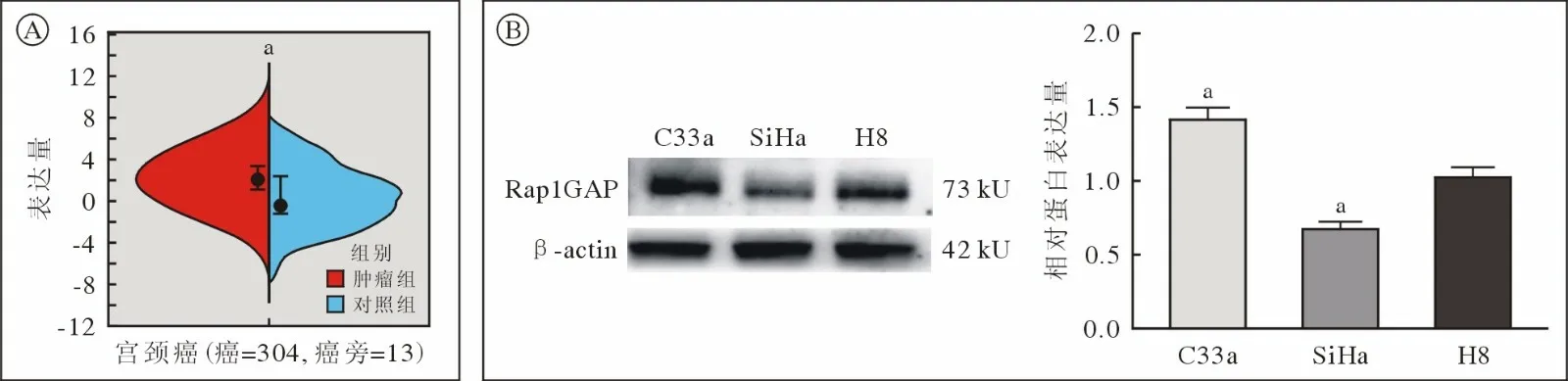
图1 Rap1GAP 在宫颈癌组织和宫颈癌细胞中的表达A:数据库中子宫颈癌组织和癌旁组织Rap1GAP 的表达水平(aP<0.05,vs N 组);B: Western blot 检测Rap1GAP 蛋白在宫颈癌C33a 和SiHa 细胞以及正常宫颈上皮细胞H8 细胞中的相对表达水平(aP<0.05,vs H8)Fig.1 Expression of Rap1GAP in cervical cancer tissues and cellsA: Expression level of Rap1GAP in cervical cancer tissues and adjacent tissues (aP<0.05,vs N group);B: Western blotting was used to detect the relative expression levels of Rap1GAP protein in cervical cancer C33a and SiHa cells and normal cervical epithelial cells H8 cells (aP<0.05,vs H8)
2 Western blot 验证宫颈癌细胞转染效率Rap1GAP 载体及对应空载体慢病毒感染C33a 和SiHa 细胞系,其中SiHa 细胞系构建OE-Rap1GAP组(Rap1GAP 高表达)与相应NC-Rap1GAP 组(空载);C33a 细胞系构建sh-Rap1GAP 组(Rap1GAP低表达)与相应NC-Rap1GAP 组(空载),Western blot 验证各组细胞Rap1GAP 蛋白表达量。结果显示,在SiHa 细胞系中,OE-Rap1GAP 组Rap1GAP表达量较SiHa 组显著增加(1.664 ± 0.081vs1.051 ±0.124vs1.047 ± 0.06,F=44.110,P=0.001);在C33a细胞系中,sh-Rap1GAP 组Rap1GAP 表达量较C33a组降低(0.396 ± 0.042vs1.058 ± 0.112vs1.103 ±0.091,F=62.614,P=0.001)(图2A)。qRT-PCR 检测结果与Western blot 结果一致(P<0.01,图2B)。
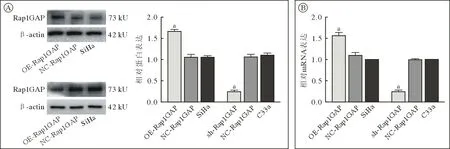
图2 慢病毒转染SiHa、C33a 细胞后各组细胞Rap1GAP 蛋白及mRNA 表达情况A:Western blot 检测Rap1GAP 蛋白表达情况(aP<0.01,vs SiHa);B:qRT-PCR 检测Rap1GAP mRNA 相对表达水平(aP<0.01,vs C33a)Fig.2 Protein and mRNA expression of Rap1GAP in SiHa and C33a cells after lentivirus transfection in each groupA: Rap1GAP protein expression was detected by Western blot (aP<0.01,vs SiHa);B: Rap1GAP mRNA relative expression level detected by qRT-PCR (aP<0.01,vs C33a)
3 Rap1GAP 表达对宫颈癌细胞增殖、侵袭和迁移能力的影响 平板克隆实验结果表明,与SiHa 组相比,过表达Rap1GAP 的OE-Rap1GAP 组细胞集落形成显著减弱(图3A)。Transwell 实验结果显示,与SiHa 组相比,OE-Rap1GAP 组细胞侵袭和迁移能力降低(图3B)。在C33a 细胞系中,与C33a 组相比,sh-Rap1GAP 组细胞的增殖、侵袭和迁移能力增强。结果表明,上调Rap1GAP 表达可减弱SiHa 细胞的增殖、侵袭和迁移能力。

图3 Rap1GAP1 的表达变化对宫颈癌细胞SiHa、C33a 恶性生物学行为的影响A:细胞平板克隆实验结果;B:侵袭实验结果(上侧)和迁移实验结果(下侧)Fig.3 Effect of Rap1GAP1 expression on malignant biological behavior of cervical cancer cells SiHa and C33aA: Results of cell plate cloning experiment;B: Invasion test results (upper side) and migration test results (lower side)
4 Rap1GAP 通过AMPK 通路调控宫颈癌细胞EMT 途径 Western blot 和qRT-PCR 检测上皮细胞间质转化(epithelial mesenchymal transition,EMT)标记物相关蛋白和基因的表达。Western blot 结果显示,与SiHa 组相比,OE-Rap1GAP 组细胞内E-钙黏蛋白(E-cadherin)表达升高,而N-钙黏蛋白(N-cadherin)的表达降低(图4A,图4C)。qRTPCR 检测结果与Western blot 结果一致(P<0.01,图4B)。Western blot 检测AMPK 通路相关蛋白的表达。结果显示,与SiHa 组相比,OE-Rap1GAP组细胞内p-AMPK 的表达降低(P<0.01,图4A,图4C),而非磷酸化AMPK 表达无变化,差异无统计学意义(P>0.05),C33a 细胞系各组结果与其相反。
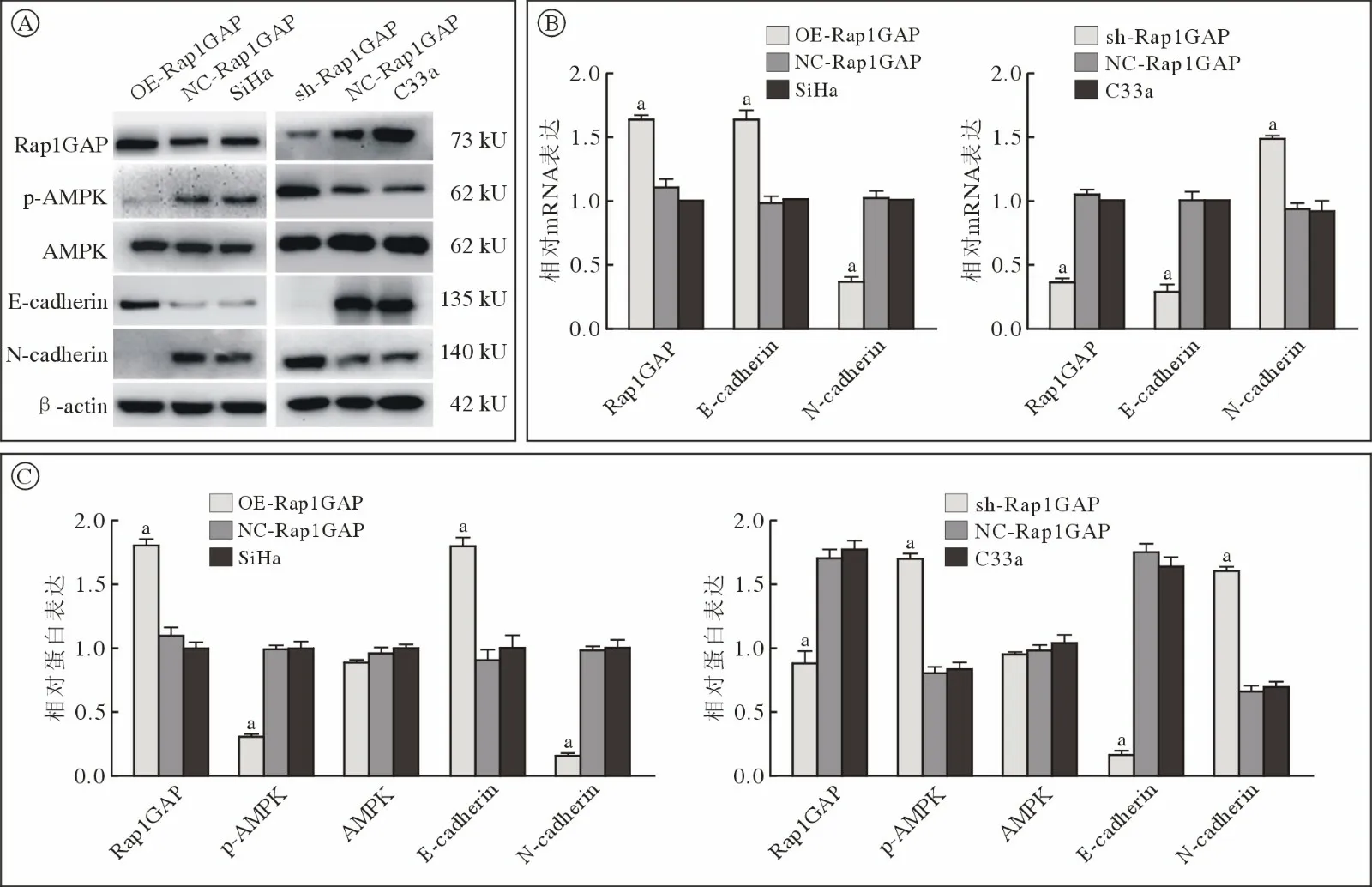
图4 Rap1GAP 表达变化对宫颈C33a、SiHa 细胞EMT 相关蛋白的影响A:Western blot 检测AMPK 通路中p-AMPK、AMPK 和EMT 相关蛋白的表达情况;B:qRT-PCR 检测各个目的基因的相对表达水平(aP<0.01,vs SiHa、C33a);C:各个目的蛋白的相对表达水平(aP<0.01,vs SiHa、C33a)Fig.4 Effect of Rap1Gap expression on EMT-related proteins and genes in cervical C33a and SiHa cellsA: Western blotting was used to detect the expression of P-AMPK,AMPK and EMT related proteins in AMPK pathway;B: Relative expression level of each target gene detected by qRT-PCR (aP<0.01,vs SiHa,C33a);C: Relative expression level of each target protein(aP<0.01,vs SiHa,C33a)
讨论
2020年宫颈癌已成为全球发病率较高的妇科生殖道恶性肿瘤,在中国女性中,其发病率呈持续上升趋势[10]。随着宫颈癌筛查方法、HPV 疫苗的普及和治疗水平的不断提升,我国宫颈癌患者5 年生存率相比以前有所提高[11]。对于宫颈癌患者而言,肿瘤的侵袭和转移性增强是治疗不良的主要原因。因此,探究宫颈癌侵袭、转移等分子机制,对于寻找新的治疗靶点,提高患者的生存率具有重要的意义。
如前文所提到Rap1GAP 作为肿瘤抑癌基因,Rap1GAP 是Rap1 的GTP 酶激活蛋白,可促使与Rap1 结合的GTP 水解为GDP,从而促进该蛋白失活。Rap1 作为小分子G 蛋白,可调控细胞的多种生物学功能,如增殖、分化和细胞黏附等[12-13]。已有研究证实,Rap1GAP 作为抑癌蛋白在甲状腺癌中呈低表达趋势,可调节肿瘤细胞的多种周期蛋白,从而抑制细胞增殖,具体机制尚不清楚[14]。另一项研究中Rap1GAP 可抑制子宫内膜癌的进展,降低Rap1GAP 表达可上调Rap1 活性,增强EAC 细胞的迁移和侵袭能力[15]。本研究利用数据库从中提取ENSG00000076864 (RAP1GAP)基因在宫颈癌样本中的表达数据,发现Rap1GAP 在宫颈癌组织中呈高表达趋势,这与上述研究结果不一致,故进一步检测Rap1GAP 蛋白在宫颈癌细胞中的表达水平,结果显示,与正常宫颈上皮细胞H8相比,Rap1GAP 在宫颈癌HPV16 阳性的SiHa 细胞中表达相对较低,在HPV 阴性的C33a 细胞中表达相对较高,提示Rap1GAP 的表达与HPV 病毒感染有关。
已有研究证明,Rap1GAP 在宫颈癌组织和细胞中的表达与HPV 感染有关。在人类乳头瘤病毒感染的细胞中,E6TP1 作为与HPV16 E6 相互作用的靶蛋白,其羧基末端存在40 个氨基酸残基与HPV16 E6 结合,发生泛素化,蛋白酶降解,激活Rap1 通路,导致肿瘤形成[16-17]。文献指出,Rap1GAP 在宫颈癌Hela 细胞中表达相对较低,增强细胞的迁移能力[18]。在本研究中,通过上调Rap1GAP 表达,导致细胞中与EMT 相关的蛋白E-cadherin 表达升高,N-cadherin 表达降低,抑制细胞的增殖、侵袭和迁移能力,该结果与文献报道一致,提示上调Rap1GAP 表达可抑制宫颈癌细胞发生EMT,但具体机制尚不清楚。AMPK 作为经典的信号转导通路,其异常活化将导致肿瘤细胞的多种生物学改变,包括促进肿瘤细胞增殖、侵袭、转移等。研究显示,子宫颈癌GJB2 高表达通过抑制AMPK 的磷酸化促进宫颈癌细胞增殖和迁移[19]。细胞因子Irisin 可通过激活AMPK 缓解高糖诱导的骨髓间充质干细胞发生[20]。三羟基异黄酮通过激活AMPK 信号通路导致宫颈癌Caski细胞周期G1 期阻滞,并诱导其凋亡[21]。可见肿瘤细胞的增殖、凋亡和转移与AMPK 通路异常激活密切相关。然而,Rap1GAP 对宫颈癌EMT 的具体调控机制鲜有报道。本研究中,上调Rap1GAP的表达后,Western blot 结果显示p-AMPK 表达显著降低;下调Rap1GAP 表达后,p-AMPK 表达显著上升,AMPK 无变化。因此推测Rap1GAP 通过改变EMT 途径影响宫颈癌细胞增殖、侵袭和迁移,该过程与异常的AMPK 信号通路有关。
综上所述,Rap1GAP 在宫颈癌组织和宫颈癌细胞中呈低表达趋势,过表达Rap1GAP 通过抑制AMPK 的磷酸化而抑制宫颈癌细胞增殖、侵袭和迁移。但本研究仍存在不足之处,缺少体内验证实验和AMPK 通路中的恢复实验,因此后续会进一步分析Rap1GAP 调控AMPK 通路的具体分子机制,为Rap1GAP 作为宫颈癌生物学行为的潜在分子标志物提供医学理论基础。
致谢 感谢UCSC (https://xenabrowser.net)数据库宫颈癌数据共享。
作者贡献阿仙姑·哈斯木:总体构思,整体设计,审读和修正;李金秋:研究构思,实验实施,分析数据,论文撰写;王玲、秦祥川:查阅部分文献,数据收集和整理。
利益冲突本文作者声明无利益冲突。
数据共享声明原始数据可通过Email:axia ngu75@126.com 向通信作者申请。
