色谱及质谱检测技术在食品真菌毒素检测中的应用研究
2023-05-31黄志强
黄志强

摘 要:为了检测食品中的真菌毒素,本文对其检测流程及步骤进行深入分析,并提出同时使用色谱及质谱检测技术对粮食承储企业稻谷的真菌毒素进行检测。研究发现,在加标量为2~800 μg·kg-1时,粮食中6种真菌毒素的平均回收率为75.5%~102.5%,批内的相对标准偏差为3.7%~9.7%,均满足食品理化检测要求。由此可知,色谱及质谱检测技术适用于对粮食中多组分真菌毒素进行定量与定性检测。
关键词:色谱;质谱检测;真菌毒素;免疫亲和柱
Abstract: In order to detect mycotoxins in food, this paper deeply analyzes the detection process and steps, and proposes to simultaneously use chromatography and mass spectrometry detection technology to detect mycotoxins in grain storage enterprises. Research has found that when adding scalars ranging from 2~800 μg·kg-1, the average recoveries of six mycotoxins in grain were 75.5%~102.5%, and the relative standard deviation within the batch was 3.7%~9.7%. All of them met the requirements of food physical and chemical detection.
Keywords: chromatography; mass spectrometry detection; mycotoxin; immunoaffinity column
真菌毒素是由真菌产生的具有毒性的次级代谢产物,其通常会影响食品或饲料的品质和安全性,因此对人们的健康有一定的影响。同时,真菌毒素也是食品、农产品、药用植物及其制剂的重要污染源之一[1]。目前,已经发现了400种以上的真菌毒素,其中有200多种产毒丝状真菌,如曲霉属、镰刀菌属和青霉属[2]。黄曲霉毒素是黄曲霉和寄生曲霉等某些菌株产生的一种毒素,含有B1、G1等羟基化代谢物,其中B1在粮食污染中较为常见,且其致癌性与毒性最强,容易导致肝癌。因此,黄曲霉素B1可作为食品安全性检验的一个重要指标。赭曲霉毒素是由鲜绿青霉、赭曲霉等代谢产生[3],其中以赭曲霉毒素A的毒性最强,容易导致肠炎、肾病,甚至会诱发肾脏癌变。伏马毒素是由串珠镰刀菌等霉菌代谢所产生的一类真菌霉毒素,其中以伏马毒素B的毒性最强[4]。单端孢霉烯族化合物是由头孢菌、镰孢菌等代谢产生的有毒代谢物[5]。玉米赤霉烯酮是一种从禾谷镰孢和其他镰刀菌属真菌中分解出来的次生产物,虽然毒性不强,但仍会对哺乳类动物产生一定的致病性。在适宜的环境下,真菌毒素会侵染农作物,对人与畜的健康造成了极大的威胁[6-7]。高效液相色谱法(High Performance Liquid Chromatography,HPLC)是一种基于传统色谱的分离分析方法,可同时实现真菌毒素的定性与定量测定。然而传统的HPLC在抗干扰能力、通用性方面上的表现较差,因此液相色谱质谱联用技术(Liquid Chromatograph Mass Spectrometer,LC-MS)技术得到了飞速发展。本文对食品中真菌毒素的检测方法进行了深入分析,旨在为食品中真菌毒素的安全风险评价监测提供理论与技术支持。
1 材料与方法
1.1 实验仪器
LC-20AT型高效液相色谱仪,日本SHIMADZU公司;API 4000 Q Trap质谱仪,配电喷雾离子源(ESI):美国ABI公司;振荡器,上海康华生化仪器制造有限公司;高速离心机,美国BECKMAN公司;N-EVAP水浴氮吹仪,美国OA公司;Milli-Q超纯水器,美国Millipore公司。
1.2 试剂与材料
黄曲霉毒素B1(Aflatoxin B1,AFB1)标准储备液、呕吐毒素(Deoxynivalenol,DON)标准储备液、玉米赤霉烯酮(Zearalenone,ZEN)标准储备液、赭曲霉毒素A(Ochratoxin A,OTA)标准储备液、伏马毒素B1(Fumonisin B1,FB1)标准储备液、伏马毒素B2(Fumonisin B2,FB2)标准储备液;甲酸﹑乙酸、甲醇和乙腈等均为色谱纯;氯化钠、氯化钾﹑磷酸二氢钾和磷酸氢二钠等均为分析纯;What-man 934-AH玻璃微纤维滤纸;6种毒素复合免疫亲和柱。
1.3 方法
1.3.1 分析条件
(1)色谱条件。流动相A(甲醇)、流动相B(将1 nL甲酸和0.0 771 g的醋酸铵加水溶解后置于1 000 mL的容量瓶中,并加入高纯水定容至刻度线即得)[8];色谱柱为C18(100 mm×2.1 mm,1.7 ?m);柱温:40 ℃;进样量:4 ?L;流速0.3 mL·min-1。
(2)质谱条件。离子源采用电喷雾离子源,其具有独特的离子碰撞反应,可以有效进行元素分析。质谱扫描方式采用多重反应监测模式,通过多个不同的反应来监测物质的存在,可以实现多元素的检测和分析。
1.3.2 样品提取
粮食中多组分真菌毒素的萃取溶液主要为甲醇和乙腈等有机溶剂与水的混合溶液[7]。实验将两种谷物混匀,使其粒度小于2 mm,选择V乙腈∶V水∶V甲醇=80∶19∶1的混合液作为提取液。称取两个25 g的粮食样品,加入100 mL的萃取剂。在10 000 r·min-1以上的速度下快速均匀2 min,或在200~300 r·min-1的摇床上猛烈振动30 min。然后以4 000 r·min-1的速度离心5 min,将试样的上清液放进洁净的容器中。分别向离心后的残渣中加入100 mL的V水∶V甲醇=20∶80的混合溶液,再次进行振荡操作。再以4 000 r·min-1的速度离心5 min,将残余物的上清移到上述的干净的容器内,混合摇匀为上清液。称取8 g NaCl、0.2 g KCl、0.2 g KH2PO4,以及1.16 g Na2HPO4·12H2O,用800 mL的超純水溶解后,将其溶液定容到1 L,作为稀释液。此外,取混合均匀的上清液10 mL加入70 mL稀释液,混合均匀,再用微型滤纸滤取后,即可获得提取物。
1.3.3 提取液净化
为了降低探测过程中的干扰,提高实验检测的准确度。在提取待测样本前需要进行净化处理。改进型固相萃取法的原理与固相萃取法相似,主要方法包括免疫亲和柱(Immunoaffinity Chromatography,ICA)与多功能净化柱(Multifunctional Column Cleanup,MFC)。ICA又被称为免疫亲和色谱法,其利用抗原-抗体反应,有选择性地将被测物从复杂的环境中分离出来,再将抗体与不溶解的固体高分子进行共价结合,填充到色谱上[8]。此次实验利用免疫亲和色谱法对样品进行纯化,取提取液32 mL上样。复合免疫亲和柱中液体排干后,上样2 mL洗脱剂,静置3 min。然后以每秒1滴的速度进行洗脱,并将其置于5 mL的离心试管中,待洗脱液在复合免疫亲和柱中放净后,取1 mL的洗脱放液,静置3 min。再以每秒1滴的速度进行洗脱,并将收集到的洗脱液置于5 mL的离心管中。按照V乙酸∶V甲醇=2∶98的混合溶液进行两次洗脱。将所采集的洗提物在50 ℃用氮气进行干燥处理,并用1 mL 50%甲醇进行定容,即可获得待测液。
2 结果与分析
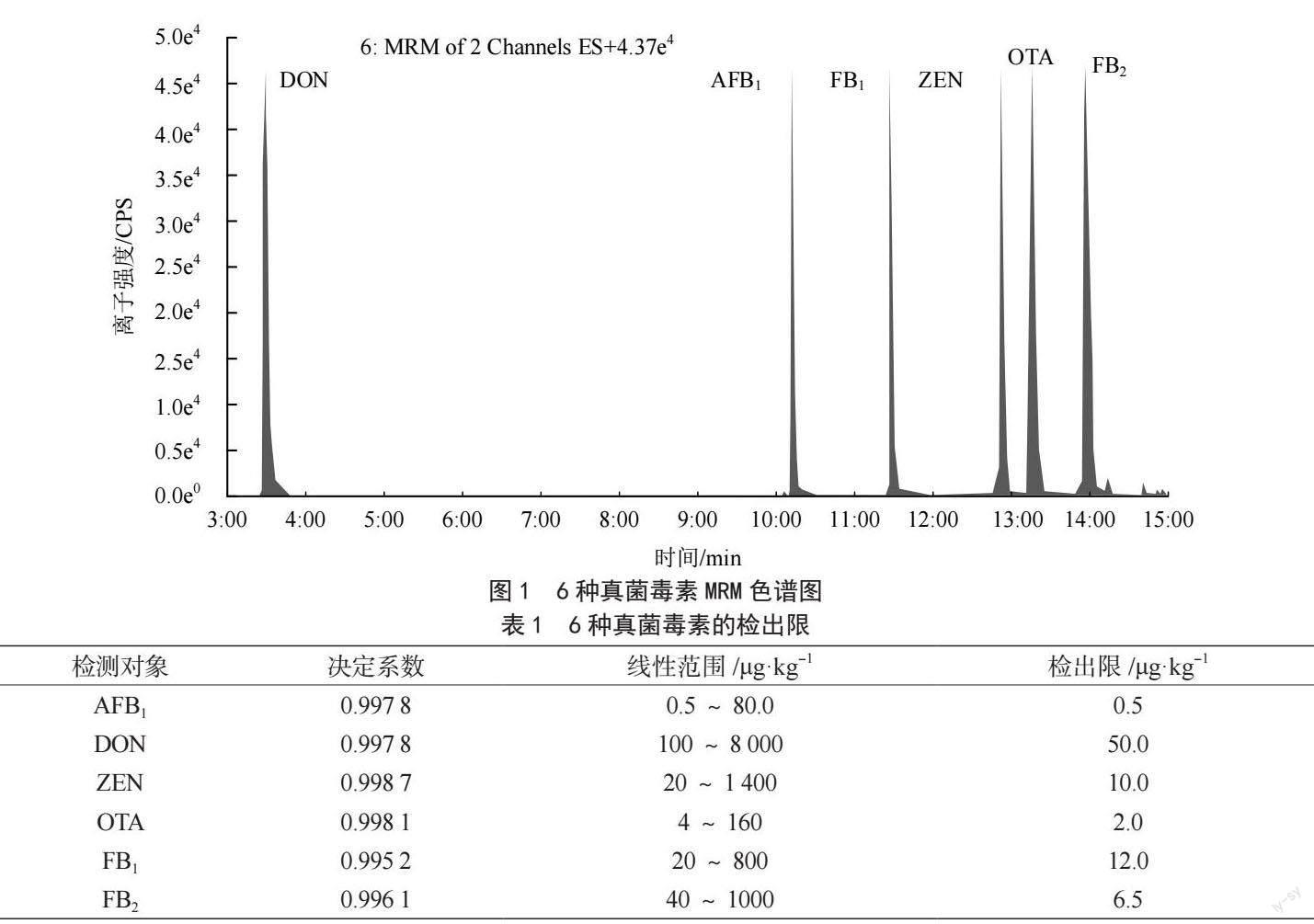
此次实验采用色谱及质谱检测技术对粮食承储企业稻谷的真菌毒素进行检测。先对样品进行预处理,用微纤维滤纸过滤,得到提取液。然后用复合免疫亲和柱对其进行净化处理,获得待测液。最后以50%甲醇为溶剂制备6种不同的混合标准液。如图1所示,为6种真菌毒素的质谱多反应监测(Multiple Reaction Monitoring,MRM)色谱图。
由图1可知,脱氧雪腐镰刀菌烯醇、黄曲霉毒素B1、伏马毒素B1、玉米赤霉烯酮、赭曲霉毒素A和伏马毒素B2这6种真菌毒素的色谱峰峰形尖锐,分离度好,适合进行定性定量。根据6种真菌毒素在质谱MRM模式下的响应强度,配制出不同浓度的混合标准溶液。按照样品前处理方法处理后,再进行测定分析。
由表1可知,脱氧雪腐镰刀菌烯醇、黄曲霉毒素B1、伏马毒素B1、玉米赤霉烯酮、赭曲霉毒素A、伏马毒素B2这6种真菌毒素的检出限为0.5~
50.0 μg·kg-1。取粮食承储企业稻谷的空白粮食样品,分别添加表1中不同浓度的6种真菌毒素混合标准溶液,按照样品处理步骤进行操作,得到的平均回收率与相对偏差值结果如表2所示。
由表2可知,此次实验检测的粮食样品中6种真菌毒素加标量在2~800 μg·kg-1时,平均回收率为75.5%~102.5%,批内的相对标准偏差为3.7%~9.7%。实验结果表明,研究采用色谱及质谱检测技术测得粮食承储企业稻谷的毒素结果满足食品理化检测要求。
3 结论与讨论
为了检测食品中的真菌毒素和代谢物的污染情况,对真菌毒素的检测流程以及各项操作步骤进行分析,提出使用色谱及质谱检测技术对粮食承储企业稻谷的真菌毒素进行检测。结果表明,AFB1、DON、ZEN、OTA、FB1和FB2這6种真菌毒素的色谱峰峰形尖锐,分离度好,适合进行定性定量分析,其检出限在0.5~50.0 μg·kg-1。6种真菌毒素加标量在2~800 μg·kg-1时,其平均回收率在75.5%~102.5%,批内的相对标准偏差为3.7%~9.7%。这表明研究采用色谱及质谱检测技术满足食品理化检测要求。
参考文献
[1]胡文尧,龙美名,胡玉斐,等.食品中真菌毒素样品前处理方法的研究进展[J].色谱,2020,38(3):307-316.
[2]李凤华,李作华,杨丽,等.药食同源中药材中16种真菌毒素的测定与分析[J].食品工业科技,2022,43(9):268-275.
[3]叶林链,王少敏,周恒,等.高效液相荧光色谱法测定坤宝丸中赭曲霉毒素A[J].中成药,2022,44(4):1264-1266.
[4]李琴珵,石洁,何康来,等.化学防控玉米蛀穗害虫对减轻拟轮枝镰孢穗腐病及伏马毒素的作用[J].中国农业科学,2021,54(17):3702-3711.
[5]沈飞,刘潇,裴斐,等.ATR-FTIR在小麦及其制品呕吐毒素污染水平快速测定中的应用[J].食品科学,2019,40(2):293-297.
[6]李波,刘秀斌,曾建国.真菌毒素与隐蔽型真菌毒素研究进展[J].饲料研究,2020,43(4):94-98.
[7]张明珠,张丽芬,陈复生,等.玉米醇溶蛋白的超声辅助酶法提取工艺及不同提取方法对其结构和功能特性的影响[J].中国油脂,2021,46(4):26-32.
[8]张媛媛,胡燕珍,黄斌,等.以离子液体为流动相添加剂在天然产物色谱分析中的应用研究进展[J].药物分析杂志,2022,42(10):1690-1696.
