ATP生物发光技术用于食品接触表面清洁效果评价的验证研究
2023-05-31赵嵩
赵嵩
摘 要:ATP生物发光技术是基于萤火虫发光原理,利用“荧光素酶-荧光素体系”快速检测三磷酸腺苷(Adenosine Triphosphate,ATP)来判断卫生状况,其具有操作简单、快速、方便的特点,ATP生物发光技术已经被广泛应用于食品接触表面清洁效果的评价。本文以某企业选择ATP卫生监测系统开展的验证实验为例,构建ATP验证方案,包括灵敏度、衰减率、重复性以及实际样本检测,可帮助企业科学有效地选择适合的ATP卫生监测系统。
关键词:生物发光技术;腺嘌呤核苷三磷酸(ATP);清洁效果;验证评价
Abstract: ATP bioluminescence technology is based on the glow principle of firefly luminescence, and uses the “Luciferase luciferin system” to rapidly detect ATP, which is used to judge the health status. It has the characteristics of simple operation, fast and convenient. ATP bioluminescence technology has been widely used to evaluate the cleaning effect of food contact surfaces. This study takes the validation of a certain brand of ATP health monitoring system as an example to build an ATP validation scheme, including sensitivity, decay rate, repeatability, and actual sample testing, which can help enterprises choose an appropriate ATP health monitoring systems more scientifically and effectively.
Keywords: bioluminescence technology; adenosine triphosphate(ATP); cleaning effect; validation evaluation
腺嘌呤核苷三磷酸(Adenosine Triphosphate,ATP)又稱三磷酸腺苷。ATP是一切生命体能量的直接来源,普遍存在于动植物、细菌、真菌细胞和食物残渣中,而无生命的碎屑物质中不存在ATP[1]。生物活性物质中的ATP含量是相对恒定的,借助“荧光素-荧光素酶”发光反应可对ATP进行定量测试,从而反映出生物细胞量的残留。ATP与荧光素反应发出的荧光强度(Relative Light Unit,RLU)与活细胞数量基本呈正比例关系[2]。荧光值越高,表明ATP的量越多,也就意味着表面的残留物越多,清洁状态越差。因此,ATP检测法就被用来快速检验物品表面是否洁净。
RLU值越高代表存在微生物污染风险的可能性越大,但ATP不能替代微生物涂抹检测,一般ATP的灵敏度可达到10-15 mol ATP标准物质(有的品牌甚至更高),以细菌为例基本也要达到103才能达到ATP的检测灵敏度[3]。研究表明,只有纯微生物培养物而没有任何食物残渣的情况下,荧光强度(RLU)和菌落数(Colony-Forming Units,CFU)呈很好的正相关关系[4]。
ATP生物发光技术由于具有操作简单、快速、方便的特点,能够简单快速验证清洁消毒效果而被广泛应用于食品、制药、医疗和养殖等行业。随着ATP生物发光技术的普及,市场也涌现了大量的ATP卫生监测系统品牌,如3M、海净纳、龟甲万、天隆、美正、巅峰、绿洲等品牌,其价格和性能差异较大,也造成了用户选择的困惑。
1 材料与方法
1.1 仪器与试剂
两个品牌ATP卫生监测系统(包括ATP荧光检测仪和表面ATP采样拭子);Pipet-lite移液枪(美国RAININ公司);sx500高压灭菌锅(日本TOMY公司);ATP标准品(Merck,货号:A1852-1VL)、金黄色葡萄球菌(ATCC 6538)、大肠杆菌(ATCC 25922)、啤酒酵母菌(ATCC 10231)。
1.2 使用方法
从2~8 ℃环境中取出ATP表面采样拭子,放置10~20 min使其恢复至室温状态。撕开包装袋,取出采样拭子。拔出含有润湿棉签的手柄,若涂抹表面,则按Z字形涂抹待测表面10 cm×10 cm的区域;若检测ATP液体标准品,则将20 μL待测标准品滴加至棉签上。后将棉签插回拭子内并按下,使其与底液接触,将检测管左右摇晃5~10 s,充分混匀后,插入对应品牌的ATP荧光检测仪,点击快速检测即可。
1.3 标准品验证方法
1.3.1 灵敏度
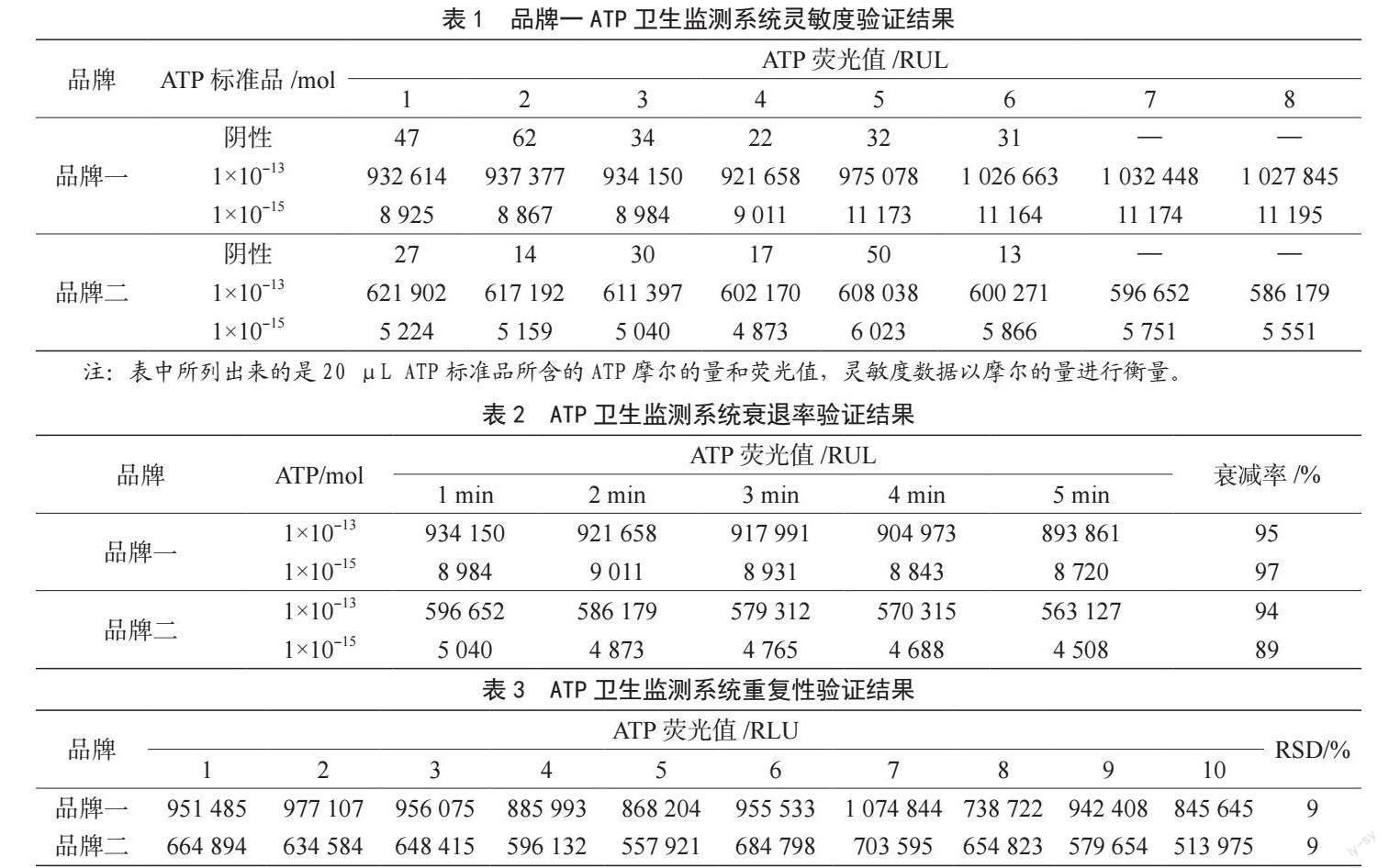
灵敏度是验证一个系统/方法的重要性能指标。先进行阴性值检测,来确定ATP的本底值。两种品牌分别取6支拭子,无需取出棉签,直接按下手柄使棉签与反应液接触,按照1.2进行操作。灵敏度验证方法为取ATP标准品,稀释多个浓度梯度,取1×10-13 mol和1×10-15 mol两个浓度,按照1.2进行分别检测,重复8次。对比不同ATP标准品浓度检测值与阴性值,与阴性有显著差异的最低检测浓度为其灵敏度。
1.3.2 衰减率
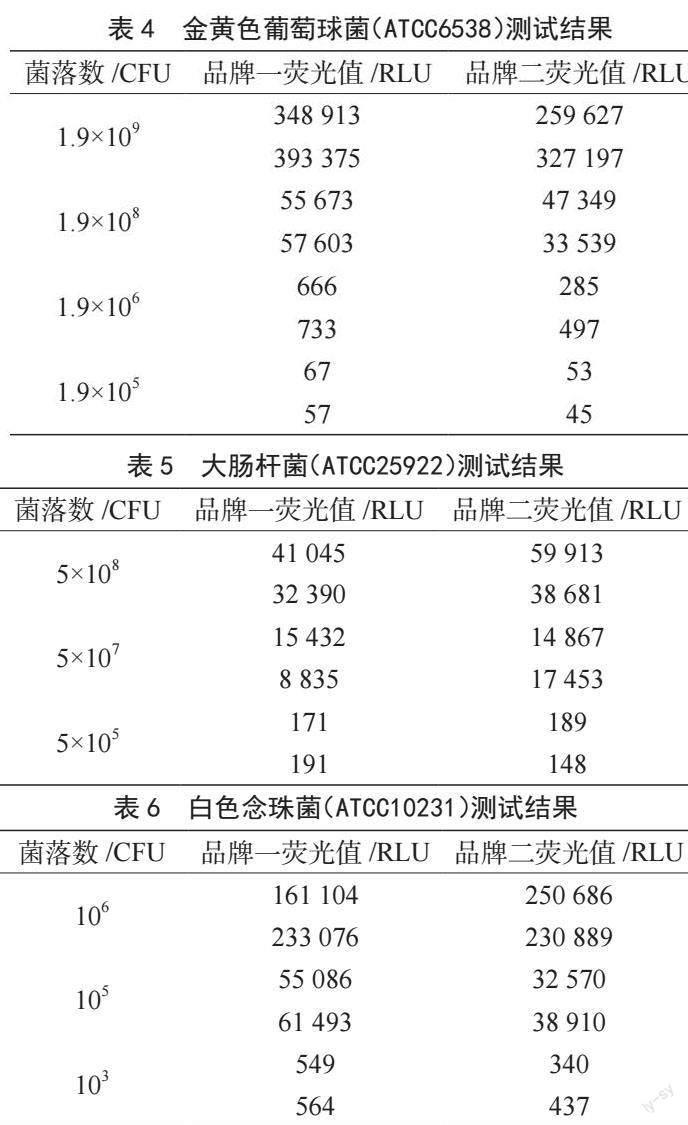
ATP反应激发后,其荧光信号会随时间的延长逐步衰减,考虑到检测人员在现场检测的过程中易受外界因素的影响,衰减过快可能会影响检测结果。衰减率的验证方法为测定拭子在5 min内的荧光检测值衰减率,吸取20 μL不同浓度梯度ATP标准品稀释液,测定两个品牌的ATP在反应开始后5 min内的荧光衰减率,分别在反应1 min、2 min、3 min、4 min和5 min时进行读值。
1.3.3 重复性
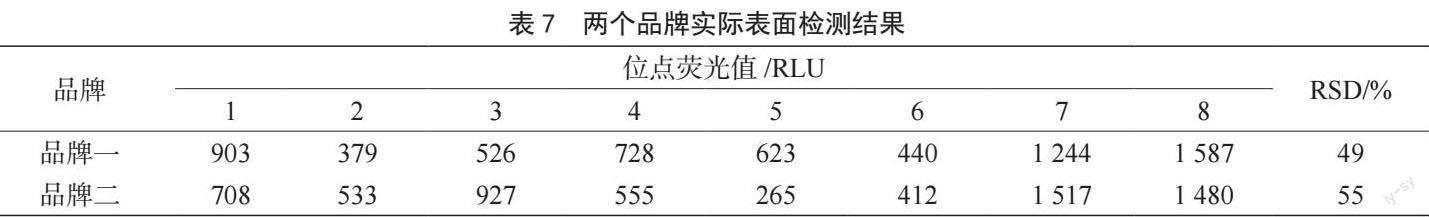
精密度是保证获得良好准确度的先决条件,一般情况下,测量精密度不好,就不可能有良好的准确度,而重复性是精密度的一个重要度量方式。取一份高浓度(1×10-13 mol)ATP标准品稀释液,分别检测两个品牌ATP在同一浓度下的重复性,检测方法参考1.2。同一浓度ATP标准品重复测试10次,计算10次结果的相对标准偏差(Relative Standard Deviation,RSD),重复性用RSD表示。
1.4 实际检测效果验证方法
1.4.1 标准菌株检测
选取较为常见的革兰氏阳性细菌(大肠埃希氏菌,ATCC 25922)、革兰氏阴性细菌(金黄色葡萄球菌,ATCC 6538)和真菌(酵母菌,ATCC 10231),分别检测两个品牌ATP对不同菌体的检测灵敏度。
取新鲜菌液,稀释至10-1、10-2、10-3、10-4和10-5梯度,从两个品牌的ATP表面采样拭子中取出棉签,用移液枪准确移取20 μL菌液滴于棉签头上,等待30 s,然后将棉签插回检测管内并按下,使其与底液接触,将检测管左右摇晃5~10 s,插入对应的ATP荧光检测仪,等待30 s,开始检测。将得到的荧光值与菌落数一一对应。把不同浓度菌液的检测荧光值与ATP拭子自身阴性值进行对比,有显著差异的最低浓度即为菌液的检测灵敏度。
1.4.2 实际表面检测
对桌面进行清洁消毒后,将桌面划分为相邻的20块10 cm×10 cm的面积,分别用2个品牌的ATP进行检测,操作方法参照1.2。
2 结果与分析
2.1 灵敏度验证结果
由表1可知,在标准品浓度为1×10-15 mol的 ATP水平上,两个品牌ATP仍能检出RLU值,且结果与阴性有显著差異;10-15 mol ATP浓度下,品牌一检测值约是品牌二的1.8倍,阴性值约为1.5倍,倍数关系基本一致,由于在10-15 mol ATP浓度的荧光值与阴性荧光值有较大差异,故二者的检测灵敏度一致,均为10-16 mol ATP。
2.2 衰减率验证结果
采用两个品牌的ATP卫生监测系统检测不同浓度ATP标准溶液,由表2可知,品牌一在浓度1×10-13 mol反应第5 min时荧光值是最高荧光值的95%;在浓度1×10-15 mol反应第5 min时,荧光值是最高荧光值的97%。品牌二在浓度1×10-13 mol反应第5 min时荧光值是最高荧光值的94%;在浓度1×10-15 mol反应第5 min时,荧光值是最高荧光值的89%。从数据上看,两个品牌的衰退率都满足实验要求(25%以内)[5],但品牌一的衰减率表现更佳。
2.3 重复性验证结果
在同浓度ATP水平下,两个品牌ATP卫生监测系统10次检测结果的RSD均为9%,偏差值小于15%,均能满足实验要求,详见表3。
2.4 标准菌株验证结果
采用金黄色葡萄球菌(ATCC6538)、大肠杆菌(ATCC25922)、白色念珠菌(ATCC10231)3种常见菌株,在不同菌株浓度下进行ATP的验证。结果显示,两个品牌的ATP卫生监测系统的检测值显示出稳定的倍数关系,具体验证结果见表4、表5、表6,且随着菌株浓度的降低,检测值均呈现较好的梯度关系。菌株在高浓度下,检测值或存在偏低情况,与低浓度不完全呈线性关系,但影响较小。
2.5 实际表面检测结果
选取同一桌面的相邻区域,分别用两个品牌的ATP表面采样拭子进行涂抹取样和检测,并计算其RSD。从表7结果可以看出,两个品牌的检测值及其趋势表现基本一致。
3 结论
通过上述验证,两个品牌的ATP卫生监测系统灵敏度一致,均为1×10-16 mol,在衰减率、重复性测试上表现基本一致,两个品牌在菌株检测和实际表面样品检测中,检测结果与线性趋势基本一致,说明两个品牌的ATP卫生监测系在菌株裂解效力和检测灵敏度上有很好的一致性。在实际验证中,用户可根据以上验证方案,选择重复性和衰减率更佳的品牌,至于灵敏度,可根据用户对洁净度要求情况来选择,此外还需要结合性能和价格综合考虑,最终筛选出最合适的ATP卫生监测系统。
参考文献
[1]侯英,吴雪琼,王兴华.ATP生物发光原理及应用研究[J].中国医药导报,2010,7(12):12-13.
[2]张凤兰,徐潇,王海燕,等.ATP生物发光法评价餐饮具的微生物污染研究[J].食品安全质量检测学报,2016,7(3):911-916.
[3]丘勒红,梁俊健,林淑仪,等.ATP生物荧光法在乳品企业清洗效果评价方面的应用[J].中国乳业,2022(10):72-76.
[4]许慧琼,王一梅,朱军生,等.ATP生物荧光法在洗手效果评价中的应用[J].中国消毒学杂志,2018,35(5):370-372.
[5]董曼曼,卫星华,孙晓,等.手持式ATP荧光检测仪性能评价[J].食品安全质量检测学报,2018,9(11):2627-2630.
