基于MRI 动态增强扫描瘤内联合瘤周影像组学列线图术前预测乳腺癌HER-2 状态的价值
2023-05-31王伟康林桂涵陈春妙应海峰胡翔华纪建松
王伟康,林桂涵,陈春妙,应海峰,胡翔华,纪建松
1.温州医科大学附属第五医院/浙江省丽水市中心医院/浙江大学丽水医院放射科,浙江 丽水 323000;2.浙江省影像诊断与介入微创研究重点实验室,浙江 丽水323000
乳腺癌是全球最常见的恶性肿瘤,也是女性癌症死亡相关的首要原因[1]。其中,15%~20%的乳腺癌表现为人表皮生长因子受体2(HER-2)阳性表达,这一机制被广泛认为与肿瘤侵袭性行为和不良预后高度相关[2]。近年来,随着抗HER-2 靶向治疗的发展,HER-2 阳性乳腺癌患者的预后得到了显著改善。研究证实,HER-2 阳性患者在使用HER-2 阻断剂曲妥珠单抗进行新辅助化疗后,可表现出良好的疗效和病理完全缓解率[3]。此外,这些患者在无病生存率和总生存率方面均有不同程度提高[4]。因此,术前准确评估HER-2 状态对乳腺癌患者的临床决策及预后预测非常重要。目前,临床主要通过免疫组织化学(immunohis tochemistry,IHC)或荧光原位杂交(fluorescent in situ hybridization,FLSH)评估乳腺癌的HER-2 状态,但由于穿刺活检的样本量不足及肿瘤的异质性,最终检测结果可能无法代表整个肿瘤[5]。影像组学可将医学图像中肉眼不可见的信息转换为高通量的定量特征,并利用这些特征直观、定量地描述病灶的病理及生理学特征,进而全面、定量评估肿瘤的异质性[6]。本研究探讨基于MRI 动态增强扫描(dynamic contrast enhanced MRI,DCEMRI)图像瘤内联合瘤周影像组学列线图术前评估乳腺癌患者HER-2 状态的价值。
1 资料与方法
1.1 一般资料
回顾性分析2019 年4 月至2021 年10 月我院经手术病理证实的女性乳腺癌患者。纳入标准:①术后病理证实为无特殊类型的浸润性导管癌;②术前2 周内行乳腺MRI 检查;③术前无放疗或新辅助化疗。排除标准:①临床资料不完整或MRI 图像质量不佳者;②术后未通过IHC 或FLSH 检测HER-2 状态,或IHC 结果为2+时,未进一步检测FLSH 者。最终纳入313 例,年龄27~78 岁,平均(50.53±10.49)岁。其中乳腺癌HER-2 阳性119 例,阴性194 例。将所有患者按7∶3 的比例随机分配至训练集218 例和验证集95 例。训练集中,HER-2 阳性83 例,阴性135 例;验证集中,HER-2 阳性36 例,阴性59 例。本研究已通过医院医学伦理委员会审核(2022-391)。
1.2 仪器与方法
采用Siemens Area 1.5 T MRI 扫描仪及8 通道乳房线圈。患者取俯卧位,两侧乳房自然悬垂于线圈中。扫描序列:频率衰减反转恢复T2WI 序列,TR 5 000 ms,TE 60 ms,矩阵336×303,层厚4.5 mm;DWI序列,TR 3 000 ms,TE 59 ms,矩阵188×186,层厚4.5 mm,b=0 或800 s/mm2;DCE-MRI 扫描采用三维快速小角度激发序列(3D-FLASH),TR 4.5 ms,TE 1.5 ms,翻转角10°,层厚1.5 mm,无间距,矩阵269×384,视野34 cm×34 cm。蒙片采集结束后,采用高压注射器经手背或肘静脉注射对比剂Gd-DTPA,剂量0.2 mmol/kg体质量,流率2.5 mL/s,后注入20 mL 生理盐水,共采集7 次,总时间约6 min 58 s。
1.3 MRI 特征评估
MRI 图像由2 名分别具有7、12 年胸部影像诊断经验的主治医师采用盲法独立评价。若意见有分歧,经协商达成共识。测量并记录乳腺肿瘤的MRI 特征,包括最长径、形状(规则或不规则)、边缘(清楚或模糊)、强化方式(均匀或不均匀)、TIC 类型及ADC 值。
1.4 图像分割和特征提取
将第2 期DCE-MRI 图像[7]以DICOM 格式导出,上传至慧影医疗科技(北京)有限公司的放射组学云平台行三维乳腺肿瘤半自动分割:瘤内区域应包括整个癌灶部分,尽量避开囊变、坏死、出血等区域;瘤周区域定义为瘤体自适应外扩5 mm,尽可能少包含正常乳腺组织及乳腺外区域(图1)。所有步骤由1 名具有5 年胸部影像诊断经验的初级职称医师完成,再由另1 名具有21 年胸部影像诊断经验的高级职称医师确认分割结果,以上步骤均在医师不知道病理结果的情况下进行,意见不一致时,经商讨达成一致。瘤内和瘤周分别提取1 409 个特征,并将其分为3 类:一阶统计量、形态特征和纹理特征。一阶统计量是定量描述MRI 图像内体素强度分布的常用指标;形态特征反映病灶区域形状和大小的三维特征;纹理特征由灰度共生矩阵(GLCM)、灰度游程长度矩阵(GLRLM)和灰度大小区域矩阵(GLSZM)计算得到。
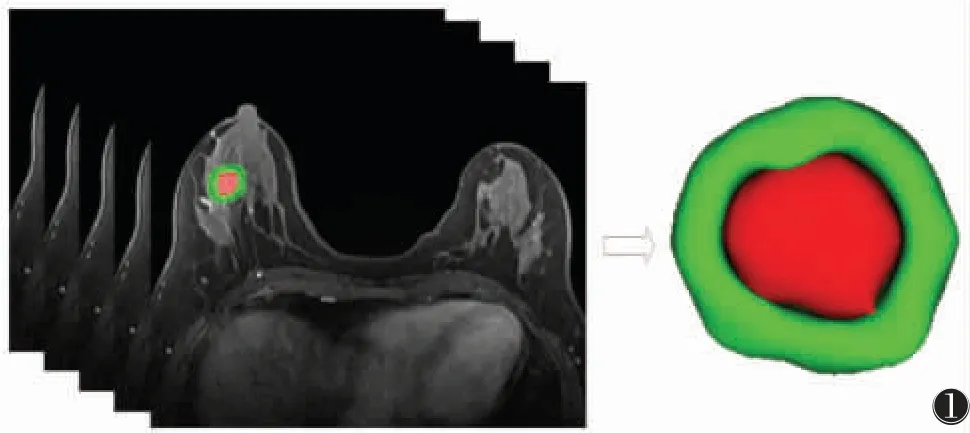
图1 乳腺肿瘤分割示意图
1.5 特征筛选
采用方差阈值、SelectKBest 方法和最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)逻辑回归进行影像组学特征的筛选。设定方差阈值法的阈值为0.8,剔除方差<0.8 的特征。在SelectKBest 方法中,保留在分类结果中P<0.05 的特征。利用LASSO 算法对特征进行10 折交叉验证,并最终筛选出回归系数非零的最优影像组学特征。
1.6 模型构建
根据各影像组学特征的系数进行加权求和,计算每个病灶的影像组学评分,并在此基础上构建影像组学模型(瘤内模型、瘤周模型、瘤内+瘤周模型)。运用单因素和多因素logistic 回归分析筛选与HER-2 状态相关的独立预测因子,构建MRI 特征模型,并结合影像组学评分建立联合模型。
1.7 病理学分析
HER-2 状态评估依据美国临床肿瘤学会/美国病理学家学会(ASCO/CAP)指南[8],当IHC 结果为0 或1+,则被定义为HER-2 阴性;当IHC 为3+,则被定义为HER-2 阳性。IHC 为2+的乳腺肿瘤,需进一步检测FLSH。一旦发生基因扩增,则被定义为HER-2 阳性。
1.8 统计学分析
使用R(版本4.1.2,https://www.r-project.org/)软件分析数据。符合正态分布的定量资料以表示,组间比较行独立样本t 检验;不符合正态分布的定量资料描述以M(Q1,Q3)表示,组间比较行非参数Mann-Whitney U 检验。定性资料的组间比较行χ2检验。并在此基础上构建影像组学模型(瘤内模型、瘤周模型、瘤内+瘤周模型),绘制相应的列线图和各模型的ROC 曲线,计算AUC、敏感度、特异度和准确率,并用DeLong 检验比较不同模型AUC 的差异。使用rms 程序包进行1 000 次重复抽样绘制校准曲线,以Hosmer-Lemeshow 拟合优度检验评估模型校准度。使用rmda 程序包进行决策曲线分析(DCA),通过计算各阈值概率下的净收益评价模型的临床价值。以P<0.05 为差异有统计学意义。
2 结果
训练集和验证集中HER-2 阳性率分别为38.1%(83/218)和37.9%(36/95),差异无统计学意义(P>0.05);在训练集及验证集中,HER-2 阳性组、阴性组强化方式、ADC 值差异均有统计学意义(均P<0.05),而最长径、形状、边缘及TIC 类型差异均无统计学意义(均P>0.05)(表1,2)。
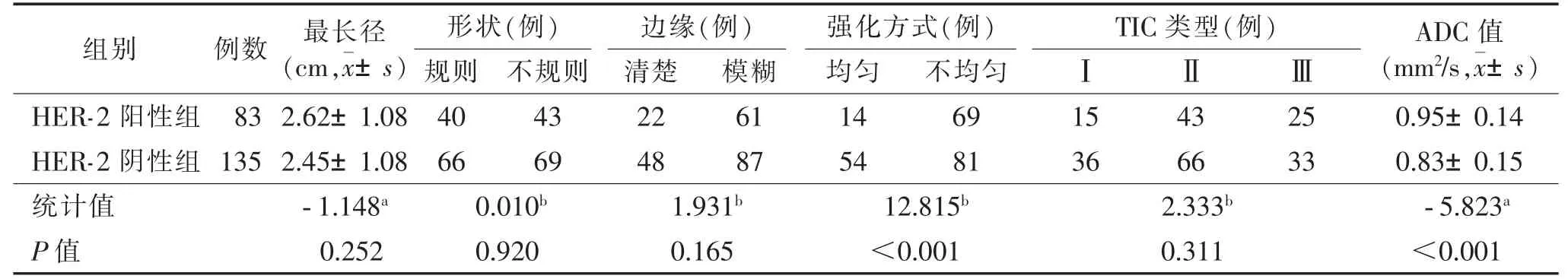
表1 训练集中HER-2 阳性和HER-2 阴性患者的MRI 特征比较
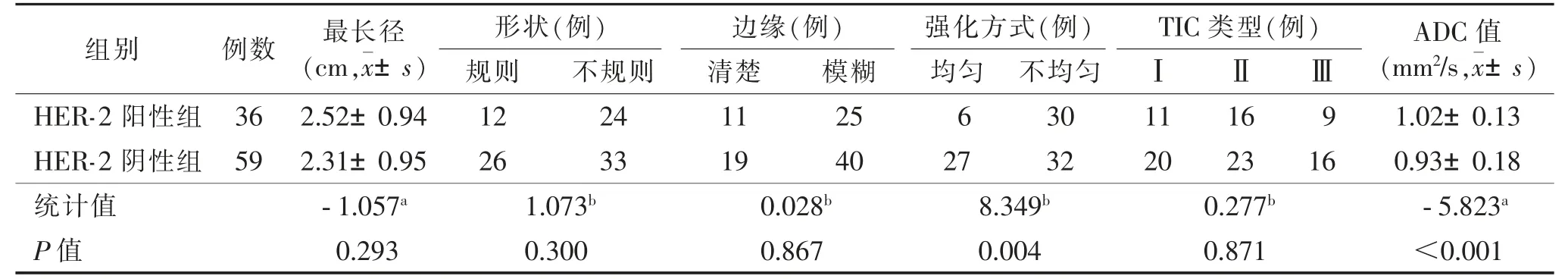
表2 验证集中HER-2 阳性和HER-2 阴性患者的MRI 特征比较
从DCE-MRI 第2 期图像上瘤内、瘤周分别提取1 409 个影像组学特征,瘤内及瘤周两者结合提取到2 818 个影像组学特征。首先对瘤内、瘤周、瘤内+瘤周提取的影像组学特征采用方差阈值法进行筛选,分别获得495、467、496 个特征;随后使用SelectKBest方法筛选,分别得到266、185、336 个特征;最后通过LASSO 回归算法筛选,分别获得13、9、20 个与HER-2相关的非零系数特征(图2)。基于筛选的特征与其对应的权重系数线性组合计算对应影像组学评分,并在此基础上构建瘤内、瘤周、瘤内+瘤周影像组学模型。瘤内模型、瘤周模型、瘤内+瘤周模型在训练集中的AUC 分别为0.821、0.791、0.842;在验证集中的AUC 分别为0.765、0.709、0.808(表3)。

表3 不同影像组学模型在训练集和验证集中预测效能的比较
单因素及多因素logistic 回归分析显示,强化方式[比值比(OR)=3.600,P=0.001]和ADC 值(OR=1.838,P<0.001)是预测乳腺癌HER-2 状态的独立危险因素,以此构建的MRI 特征模型在训练集和验证集中的AUC 分别为0.786 和0.723。进一步结合瘤内+瘤周的影像组学评分及MRI 特征构建联合模型并绘制列线图(图3),结果显示:在训练集中,联合模型鉴别乳腺癌HER-2 状态的AUC 为0.881(95%CI 0.836~0.927),敏感度和特异度分别为83.74%、81.87%,显著高于瘤内影像组学模型(Z=-5.385,P<0.001)、瘤周影像组学模型(Z=-4.650,P<0.001)、瘤内+瘤周影像组学模型(Z=4.01,P=0.001)和MRI 特征模型(Z=-7.112,P<0.001)(图4a)。在验证集中,联合模型鉴别乳腺癌HER-2 状态的AUC 为0.832(95%CI 0.750~0.914),敏感度和特异度分别为72.85%、83.37%,同样显著高于瘤内影像组学模型(Z=-2.956,P=0.003)、瘤周影像组学模型(Z=-2.188,P=0.029)和MRI 特征模型(Z=-3.587,P<0.001),而与瘤内+瘤周模型差异均无统计学意义(Z=4.64,P=0.643)(图4b)。训练集和验证集的校准曲线显示,列线图对HER-2 状态的预测概率与实际结果一致性较好,Hosmer-Lemeshow检验示训练集(P=0.082)及验证集(P=0.286)均具有较好拟合度(图5a,5b)。DCA 结果表明,与MRI 特征模型及不使用预测模型的场景相比(即全部治疗或不治疗方案),联合模型列线图的临床应用价值更高(图6a,6b)。
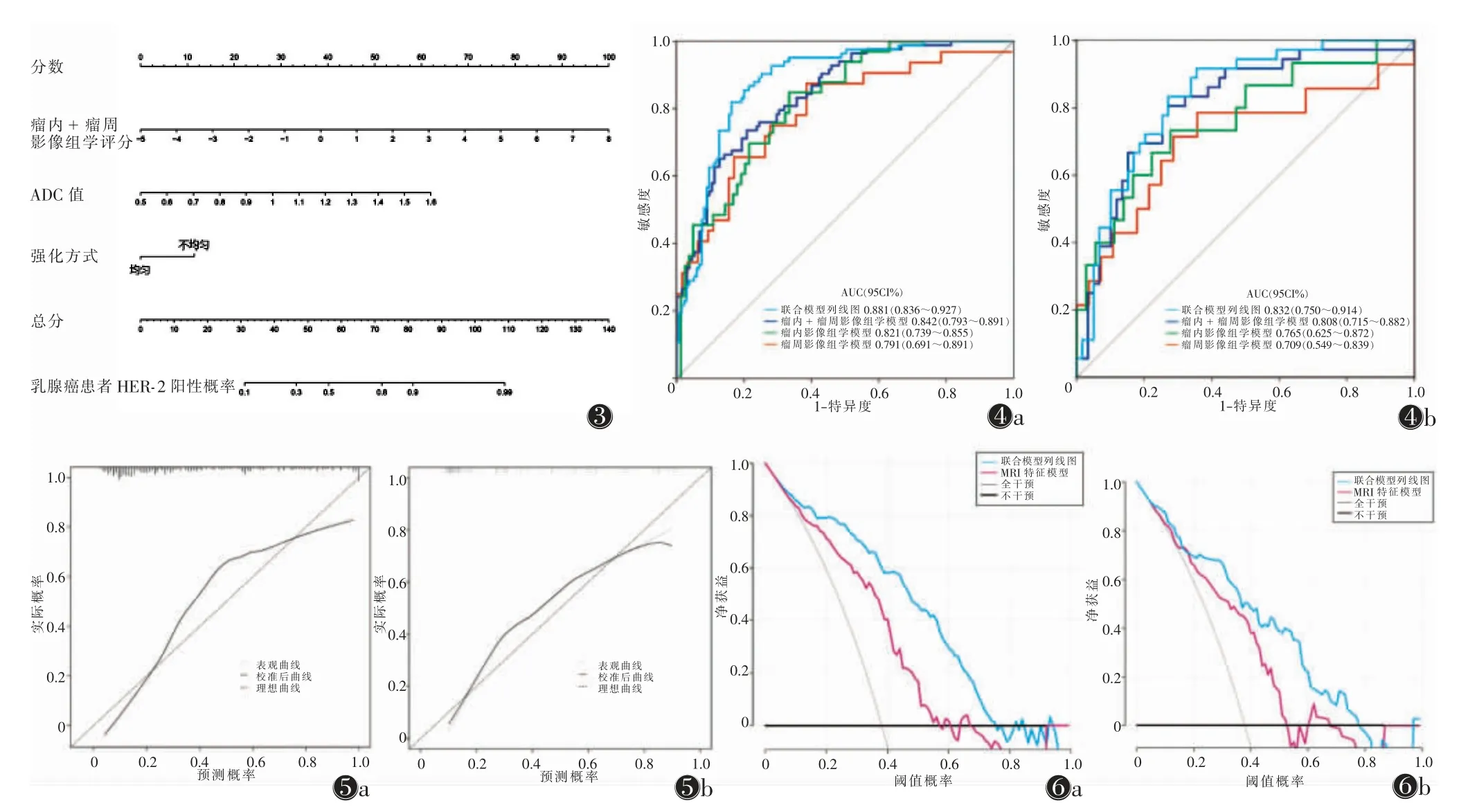
图3 联合模型列线图 图4 各影像组学模型和联合模型的ROC 曲线 注:图4a,4b 分别为训练集和验证集 图5 联合模型列线图的校准曲线 注:图5a,5b 分别为训练集和验证集 图6 联合模型列线图和MRI 特征模型的决策曲线 注:图6a,6b 分别为训练集和验证集;决策曲线分析(DCA)表明,当阈值概率在0~77%时,使用联合模型列线图预测人表皮生长因子受体(HER-2)状态与MRI 特征模型相比具有额外的临床获益
3 讨论
HER-2 状态是影响乳腺癌预后的重要指标,也是决定临床治疗策略的关键因素[9]。本研究基于DCE-MRI 图像中瘤内联合瘤周的影像组学评分和常规MRI 特征(强化方式和ADC 值)开发并验证了影像组学列线图模型,结果显示,该模型对乳腺癌患者HER-2 状态具有较高的预测效能,其在训练集和验证集的AUC 分别为0.881 和0.832,明显优于瘤内和瘤周的影像组学模型及MRI 特征模型。此外,校准曲线和DCA 结果均显示该模型具有较好的校准度及临床应用价值。
近年来,边界模糊、形状不规则、分叶状或毛刺状、强化不均匀等影像学特征均已被证实可用于诊断乳腺癌HER-2 状态[10-11]。但本研究显示,仅强化方式在2 组间差异明显,原因可能是由于MRI 特征评估主观性强,不同成像方式、设备及观察者经验等,均可导致结果的再现性低。此外,ADC 值作为MRI诊断乳腺病变最重要的定量指标之一,其可通过量化水分子扩散运动的能力,间接反映组织微观结构和细胞密度的变化[12]。在本研究中,HER-2 阳性组平均ADC 值高于HER-2 阴性组,与程雪等[13]的研究相似。推测可能是由于HER-2 阳性表达可诱导肿瘤内部新生血管生成,促进局部微循环灌注,继而导致ADC 值增加。进一步以强化方式和ADC 值构建的MRI 特征模型在训练集和验证集的预测效能均表现一般,AUC 分别为0.786 和0.723。因此,仅依赖常规的MRI 定性和定量指标可能难以识别乳腺癌HER-2 状态。
影像组学作为一种新兴方法,可将医学图像中提取到的定量特征与肿瘤基因表达谱相关联。近年来,已有多项研究基于不同成像方式构建HER-2 状态的预测模型[14]。Zhou 等[15]分析了306 例乳腺癌患者的内外斜位和头尾位X 线图像,构建HER-2 状态预测模型的AUC 仅0.735。Chen 等[16]基于217 例乳腺癌患者的PET/CT 图像构建HER-2 状态预测模型的AUC 为0.76。DCE-MRI 可通过评估肿瘤形态和血流动力学改变提供高时间、高空间和高SNR 的图像,被认为是诊断乳腺癌最有价值的影像学手段。在最近一项研究 中,Fang 等[17]基于235 例乳腺癌患者DCE-MRI 图像提取特征并筛选后共获得21 个影像组学特征,建立HER-2 状态预测模型的AUC 为0.84。尽管基于DCE-MRI 构建的模型诊断效能比其他成像方式有所提高,但仍无法满足临床精准诊断的需求。此外,上述与乳腺癌HER-2 状态相关的影像组学研究大多围绕瘤体,忽略了其周围区域的信息。有研究表明,乳腺肿瘤周围正常组织易受到癌细胞侵袭或扩散影响,继而发生细微结构变化[18]。因此,基于瘤周提取的影像组学特征也可能蕴含一些与肿瘤异质性、疾病预后等相关的重要信息。Liu 等[19]基于乳腺癌瘤内、瘤周及瘤内联合瘤周的DCE-MRI图像分别提取影像组学特征构建腋窝淋巴结转移的风险预测模型,结果显示3 种模型的AUC 值分别为0.84、0.83、0.87。姜原等[20]发现,通过瘤内联合瘤周的DCE-MRI 图像构建的影像组学模型用于鉴别乳腺原位癌与浸润癌具有较高效能,联合模型的AUC(0.922)显著高于瘤内模型(0.865),提示瘤内或瘤周区域可提供互补信息,联合瘤内和瘤周构建的影像组学模型可有效提高预测效能,与本研究结果相似。本研究将筛选得到的MRI 特征和瘤内联合瘤周特征的影像组学评分结合构建列线图模型以预测乳腺癌HER-2 状态,结果显示列线图的诊断效能显著高于MRI 特征模型和单独瘤内及瘤周影像组学模型(均P<0.05)。此外,Zhou 等[21]基于多序列影像组学特征构建的用于预测乳腺癌HER-2 状态的联合模型相比(AUC=0.857),本研究的联合模型诊断效能更佳(AUC=0.881)。
本研究存在的局限性:为单中心小样本回顾性研究,不可避免地存在部分偏倚,未来需扩大样本规模,设计多中心、前瞻性研究加以验证;仅纳入非特殊类型的浸润性导管癌患者;仅分析病灶强化最明显的DCE-MRI 第2 期图像,而其余期相的性能仍需进一步研究。
综上所述,基于瘤内及瘤周的DCE-MRI 图像构建的影像组学评分结合强化方式、ADC 值建立的联合诊断模型有潜力成为一种可靠的临床应用工具,可为术前实现无创、准确鉴别乳腺癌患者的HER-2状态提供参考。
