盐酸罗格列酮片中杂质A含量的方法学验证
2023-05-30郑媛媛聂鹏
郑媛媛 聂鹏
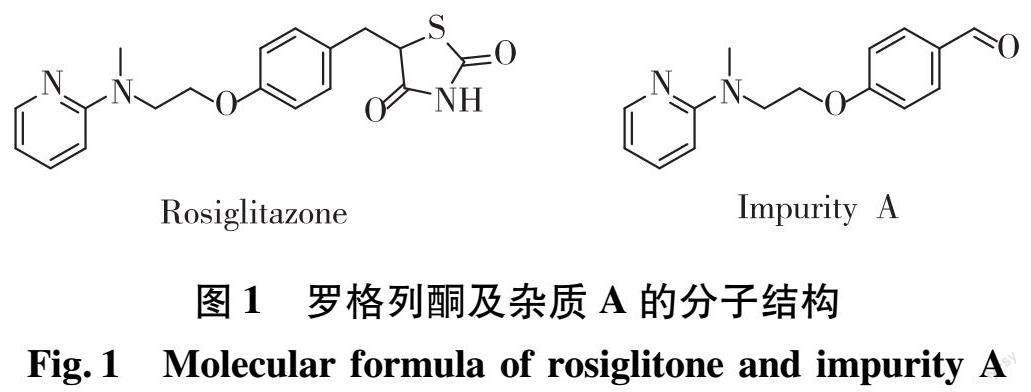
摘 要:经相关研究发现,某企业生产的盐酸罗格列酮片中含有少量的杂质A,其结构已表征和确认,为了满足人民安全用药的需求,有必要对其进行深入研究。通过高效液相色谱仪对盐酸罗格列酮片中杂质A的含量分析进行了方法学验证,其在1.13~9.06 ng范围内线性良好(r=0.999 9),重复性相对标准偏差(relative standard deviation,RSD)为1.4%,检出限为0.45 ng,定量限为1.13 ng。此方法专属性强,线性适用范围相对较宽,稳定性好,检测结果较为准确,能够较好地分析盐酸罗格列酮片中杂质A的准确含量,可有效提升该品种的质量标准。
关键词:盐酸罗格列酮;杂质A;含量;方法学
中图分类号:R917
文献标志码:A
文章编号 1000-5269(2023)03-0041-06
DOI:10.15958/j.cnki.gdxbzrb.2023.03.06
随着社会经济水平及人们生活水平的提高,近几十年来II型糖尿病患病率也在快速增长[1-2]。罗格列酮作为治疗II型糖尿病药物的一种,由葛兰素史克公司研制,其机制与特异性过氧化物酶体增殖因子激活剂的γ型受体有关,可促进间质干细胞向脂肪细胞分化,促进外周脂肪细胞脂肪生成,降低肝脏和外周甘油三酯,降低内脏脂肪细胞活性,增加脂联素,可显著改善胰岛素抵抗和代谢综合征,并具有降低胰岛素需求量的功效[3-4]。罗格列酮由于其具有潜在的心力衰竭、液体潴留以及肝损伤[5-6]等副作用被限制使用。在美国药典(USP)中,收录的品种为马来酸罗格列酮片,但是该药物尚未收录至《中国药典》2020年版。现行的国内标准中,大部分为部颁标准,也有少量为企业自行标准[7-8]。在作者报道的其他文献中,对盐酸罗格列酮片进行常规检测发现,盐酸罗格列酮片中存在包含杂质A在内的数种杂质,分析并表征了盐酸罗格列酮片中杂质A的确切结构,其分子结构见图1。经毒性预测软件对其潜在毒性进行分析,该杂质其他毒性相对较小,但具有潜在的基因毒性,并且目前尚未有公开资料报道该品种中杂质A的相关含量限制或标准修订。
由于该药物具有较好的经济性和便捷性,为了对现有药物进行更全面的安全性评价,有必要对该品种的质量标准方法学验证开展研究,论证其安全使用范围,以实现现有药物的最大化利用。本文沿用该品种现行标准中的色谱条件,使用高效液相色谱仪开展盐酸罗格列酮片中杂质A的含量方法学验证实验,研究该杂质的专属性、稳定性以及线性方程适用范围,结合加标回收率、重复性以及精密度等实验,全面论证该杂质的质量分析方法以及检查项下的含量检测分析方法,为该品种的质量分析标准提升工作打下坚实的基础。
1 仪器、试药和方法
1.1 仪器
岛津LC-20AT高效液相色谱仪(SPD检测器),LC-solution色谱工作站,Mettler AC204 电子天平,Mettler XP26 电子天平,RS-360E超声波清洗仪(上海瑞胜仪器仪表有限公司)。
1.2 试药
乙腈(批号:20025138,美国TEDIA试剂公司)、甲醇(批号:21015240,美国TEDIA试剂公司)、自制超纯水、乙酸铵(批号:20171016,成都金山化学试剂有限公司),杂质A对照品(批号:TA0097-BA1218,纯度>95%,广州爱纯医药科技有限公司),盐酸罗格列酮片(某厂家生产的3批次市售品)。
1.3 方法
1.3.1 高效液相色谱条件
0.025 mol/L乙酸铵溶液-乙腈(50∶50),流速1.0 mL/min,波长245 nm,进样体积为20 μL,色谱柱Gemini 5u C18,250 mm×4.6 mm,5 μm,柱号598582-4。
1.3.2 溶液的制备
供试品溶液:取本品细粉适量(约相当于罗格列酮4 mg),精密称定,置50 mL容量瓶中,加入少量流动相超声溶解,放冷后用流动相定容至刻度,摇匀,滤过,取续滤液作为供试品溶液,3批次药品同法操作。
对照品溶液:精密称定11.33 mg杂质A,置20 mL容量瓶中,加流动相稀释至刻度,摇匀,并精密量取该溶液1 mL至200 mL容量瓶中,加流動相稀释至刻度,摇匀,作为对照品储备液。
2 结果与分析
2.1 专属性实验
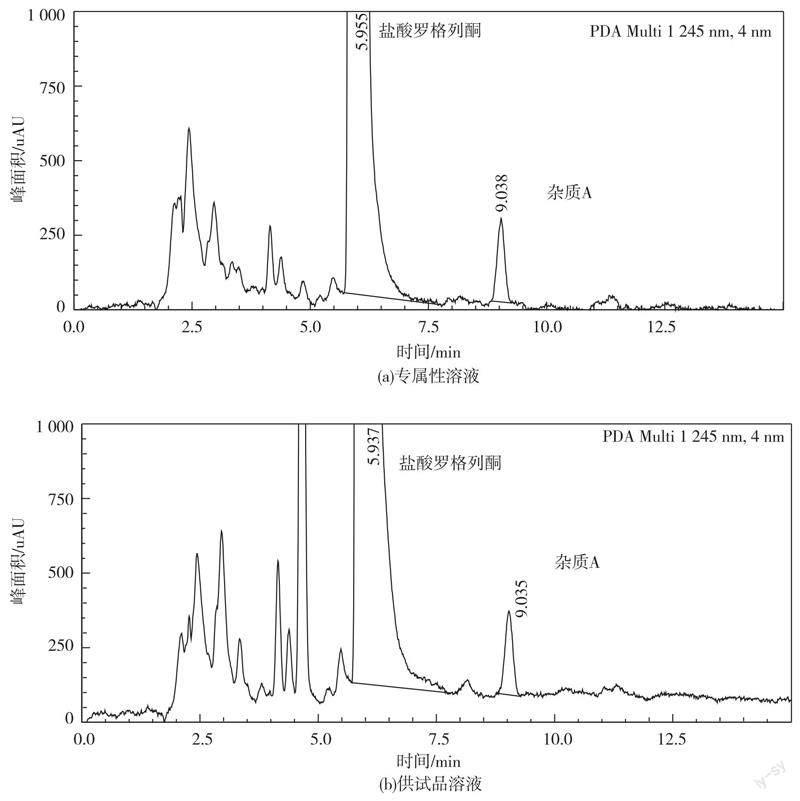
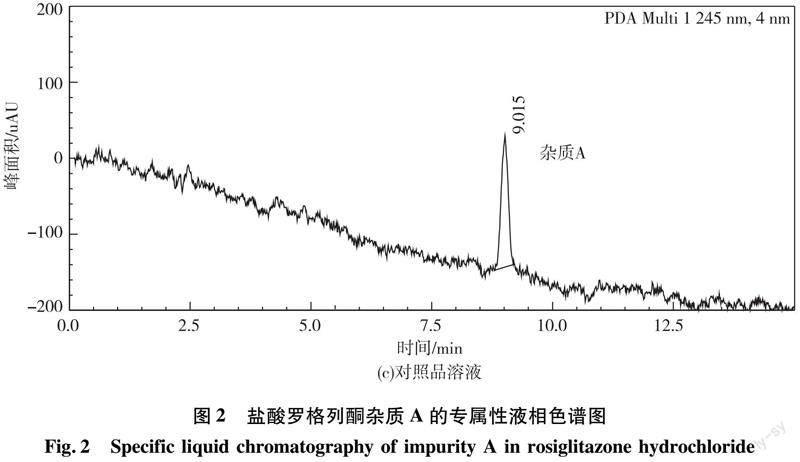
精密量取供试品溶液和对照品储备溶液各1 mL,置 50 mL 量瓶中,加流动相溶解并稀释至刻度,摇匀,与对照品溶液、供试品溶液分别取20 uL注入液相色谱仪,按1.3.1项下色谱条件检测,在图2中,专属性溶液中杂质A峰的保留时间为9.038 min,和其他组分峰分离良好,对照品溶液中杂质A峰的保留时间为9.015 min。以上两种溶液中杂质峰的保留时间均能与样品中的未知杂质峰(保留时间为9.035 min)相对应。
2.2 标准曲线
精密量取对照品储备液4 mL至50 mL容量瓶中,用流动相稀释至刻度,摇匀得标准曲线溶液。分别取该溶液5、10、15、20、30、40 uL注入液相色谱仪,进行测定。以峰面积和进样量计算线性范围。结果杂质在1.13~9.06 ng范围内线性关系良好,相关系数r=0.999 9。结果见图3。
2.3 检出限
精密量取4 mL对照品储备液至50 mL容量瓶中,加流动相稀释至刻度,摇匀,精密量取该溶液1 mL至5 mL容量瓶中,用流动相稀释至刻度,摇匀,取10 uL注入液相色谱仪,信噪比4.77,结果见图4,经计算杂质A的检出限为0.45 ng。
2.4 定量限
精密量取对照品储备液4 mL至50 mL容量瓶中,用流动相稀释至刻度,摇匀。取该溶液5 uL注入液相色谱仪,进行测定。结果见图5,经计算杂质A的定量限为1.13 ng。
2.5 重复性实验
取批号01的盐酸罗格列酮片按1.3.2项下制备6份供试液,按1.3.1项下的色谱条件测定,结果杂质A含量平均为0.059%,相对标准偏差(relative standard deviation,RSD)为1.4%,重复性良好。结果见表1。
2.6 回收率实验
分别精密称取批号01的样品(平均含量为0.024 4 mg/g):0.050 18、0.050 88、0.051 27、0.050 61、0.051 72、0.050 28 g至50 mL容量瓶加流动相(含杂质A对照 0.000 023 98 mg/mL)40 mL,超声15 min,取出,放冷,再用流动相稀释至刻度,摇匀。分别取上述溶液各20 uL注入液相色谱仪,记录色谱图,结果见表2,计算结果平均回收率为96.5%, RSD 为3.57%。
2.7 精密度实验
精密量取对照品储备液4 mL至50 mL容量瓶中,用流动相稀释至刻度,摇匀,取20 uL注入液相色谱仪。按1.3.1项下色谱条件重复测定6次,峰面积RSD为1.2%,精密度良好,结果见表3。
2.8 稳定性实验
精密称取批号为01的样品 98.6 mg,按1.3.2项下方法制备供试品溶液,分别在 0、2、4、6、8、10 h取 20 μL 注入液相色谱仪,记录色谱图,结果峰面积 RSD 为0.5%,表明在 10 h 内,杂质比较稳定。
2.9 样品测定结果
检测同一企业生产的3批次样品,按照相同的处理方法及色谱条件进行检测,其结果如表6所示,样品中杂质A的含量均在0.059%附近。结果说明,该药品质量较为稳定,该方法适用性好。
3 结论
参考《中国药典》中关于药品相关杂质研究的指导原则[9],结合化药杂质研究方法和部分文献报道[8,10],开展了盐酸罗格列酮片中相关杂质的方法学验证研究。在实验过程中,刚开始使用不同浓度大小的对照溶液进行分析,在HPLC中其对照品的保留时间会存在一定漂移,后将对照品濃度逐级稀释并检测,发现低浓度对照品溶液其信号峰的保留时间能够真实反映出对照品的特征信号,因此选用较低浓度的对照品溶液开展实验。其专属性实验结果表明,该杂质的保留时间为9.0 min,能够与样品中的相关杂质信号对应,并且保留时间附近未有其他杂质信号,与主峰之间的分离度明显,能达到中国药典相关规定,专属性强。在作者报道的其他文献中,通过液质联用仪和高效液相色谱仪表征了该杂质的确切结构和保留时间,表明样品中未知杂质的相关信号归属为杂质A,在此不再赘述。在检出限实验中,该杂质的检出限与其他化合物的数值较一致,经计算其检出限为0.45 ng,信噪比为 4.77,该结果显示杂质A的信号特征较为明显,其实验结果与其他研究中的检出限数值相当,表明本方法能够较好地通过HPLC分析仪器来检测该化合物的特征信号和分析其最低有效含量。而在定量限实验和标准曲线实验中,由于该杂质含量较低,因此选择低浓度线性方程范围开展实验,其结果显示该杂质的定量限为 1.13 ng,其线性方程范围为1.13~9.06 ng,表明能够在较低含量下对该杂质A进行表征和有效计算。同时,该线性方程相关系数r大于0.999 9,可以在此线性范围内有效地对该杂质含量进行准确计算。重复性、回收率以及精密度等分项实验结果表明,该杂质在原标准中的色谱条件下能够被较好地分析并检测,在特定色谱条件下能够有效反映出该化合物的专属信号,并且能够较好地重现分析验证结果,体现了该杂质适用方法的普适性。在稳定性实验中,该杂质溶液能够在室温下10 h内保持稳定,并经检测得到偏差RSD仅为0.5%的结果,尽管该对照品在固体条件下需-20℃保存,但该结果表明,杂质A的溶液体系体现了一定的稳定性,可在一定时间范围内通过本方法对该杂质进行分析并能得到有效数据,有力支撑了该方法学验证实验的稳定性。最后,通过该色谱条件和检测方法分析了3批次该品种的杂质A含量,结果均为0.06%,其RSD值偏差较小,符合《中国药典》收录的分析方法指导原则中的数值偏差要求,说明该厂家生产的本药品制剂加工工艺较为固定,该杂质在本药品制剂混合物体系中也较为稳定。同时也表明该方法能够有效地检测并准确分析盐酸罗格列酮片中杂质A较低浓度的含量,也能准确区分杂质A与其他未知杂质,具有较强的专属性以及范围相对较广的适用性。
综上,报道了盐酸罗格列酮片中一种确定结构的杂质A含量的方法学验证实验过程及结果。参考该部颁标准的色谱条件,本方法能够很好地指认杂质A所处的保留时间和相应的紫外光谱吸收信号,并能对其含量进行一定范围内的准确分析,反映出该方法的普适性和稳定性。本方法简单、便捷、准确且高效,能够有力支撑原标准的提升工作,因此,后续拟对该部颁标准进行修订,增加有关物质项下杂质控制的种类及含量,并可开展该杂质A的遗传毒性实验,以充分论证对该杂质限制的论据和限度。
参考文献:
[1]CHO N H, SHAW J E, KARURANGA S, et al. IDF diabetes atlas: global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2018, 138: 271-281.
[2] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中国实用内科杂志,2018,38(4): 292-344.
[3] DEEKS E D, KEAM S J. Rosiglitazone: a review of its use in type 2 diabetes mellitus[J]. Drugs, 2007, 67(18):2747.
[4] TONTONZ P, SPIEGELMAN B M. Fat and beyond: the diverse biology of PPARγ[J]. Annual Review of Biochemistry, 2008, 77(1): 289.
[5] NESTO R W, BELL D, BONOW R O, et al. Thiazolidinedione use, fluid retention, and congestive heart failure: a consensus statement from the American Heart Association and American Diabetes Association[J]. Circulation, 2003, 108(23): 2941-2948.
[6] HUSSEI Z, WENTWORTH J M, NANKERVIS A J, et al. Effectiveness and side effects of thiazolidinediones for type 2 diabetes: real-life experience from a tertiary hospital[J]. Medical Journal of Australia, 2004, 181(10):536.
[7] 郑国钢,方滢芝.RP-HPLC法测定盐酸罗格列酮含量及有关物质[J].药物分析杂志,2005,25(1):104-106.
[8] 李珏,贾飞,吴永江.高效液相色谱法测定盐酸罗格列酮片的含量及有关物质[J].药学实践杂志,2012,30(1):49-51.
[9] 国家药典委员会.中华人民共和国药典:四部[S].北京:中国医药科技出版社,2020:480-485.
[10]李珏. 呋喃唑酮和罗格列酮质量标准研究[D].杭州:浙江大学,2012.
(责任编辑:曾 晶)
Abstract: It has been found that rosiglitazone hydrochloride tablets produced in an enterprise contain small amount of impurity A ,whose structure has been characterized and confirmed. In order to meet the needs of people for safe drug use, it is necessary to conduct further research on it. The content of impurity A in rosiglitazone hydrochloride tablets was analyzed by high performance liquid chromatography. The results show that the content of impurity A in rosiglitazone hydrochloride tablets has good linearity (r=0.999 9) in the range of 1.13~9.06 ng. The RSD of repeatability is 1.4%, and the detection limit and the quantitation limit is 0.45 ng, and 1.13 ng respectively .This method has strong specificity, relatively wide linear application range, good stability, and accurate detection results; it can better analyze the accurate content of impurity A in rosiglitazone hydrochloride tablets, and effectively improve the quality standard of this variety.
Key words: rosiglitazone; impurity A; content; methodology
基金項目:贵州省科技计划项目(黔科合基础-ZK[2021]一般041)
作者简介:郑媛媛(1987—),女,主管药师,研究方向:药理毒理药包材研究,E-mail:61549743@qq.com.
*通讯作者:聂 鹏,E-mail:niepeng2001@163.com.
