猪细小病毒VP2蛋白重组杆状病毒的构建表达与鉴定
2023-05-30丁国伟李甜甜徐萍潘晨王设市魏荣荣荣雪路范娟
丁国伟 李甜甜 徐萍 潘晨 王设市 魏荣荣 荣雪路 范娟
摘 要:为构建一种能够用于开发猪细小病毒病毒样颗粒疫苗的猪细小病毒VP2蛋白的重组杆状病毒。根据GeneBank数据库中的猪细小病毒全基因组序列设计并合成了1对能扩增VP2基因的引物,采用PCR扩增猪细小病毒BJ-2株的VP2基因,并将其克隆到杆状病毒转移载体pFastBacH TA中,获得阳性质粒pFastBac-PPV VP2;测序后将该质粒转化到大肠杆菌DH10Bac感受态细胞中,获得含有VP2基因的重组杆状病毒质粒Bacmid-PPV VP2;最后将获得的重组杆状病毒质粒Bacmid-PPV VP2转染Sf9昆虫细胞,并成功拯救了能稳定表达猪细小病毒VP2蛋白的重组杆状病毒Bacmid-PPV VP2。结果发现,该重组病毒可用于稳定表达猪细小病毒VP2蛋白,并且表达的VP2蛋白可在体外自我组装形成病毒样颗粒,电镜观测其颗粒大小与猪细小病毒全病毒大小类似,且形成的病毒样颗粒与全病毒一样具有豚鼠红细胞凝集作用,凝集效价可达1∶2 048。故构建的表达猪细小病毒VP2蛋白的重组杆状病毒为研制猪细小病毒的基因工程亚单位疫苗奠定了基础。
关键词:猪细小病毒;VP2基因;重组杆状病毒;病毒样颗粒
猪细小病毒(porcine parvovirus,PPV)能导致初产母猪及血清学阴性的经产母猪发生流产、不孕以及产死胎、木乃伊胎和弱仔等[1]。断奶仔猪多系统衰竭综合征(porcine post weaning multisystemic wasting syndrome,PMWS)的主要发病原因是仔猪混合感染PPV与猪圆环病毒2型所致[2-3]。PPV具有极强的感染性和传播性,一旦猪群中的某一头猪感染PPV,猪群中其他猪在3个月内都可能会感染。另外,PPV难以被清除,尤其是在该病毒流行的猪场,由其引发的母猪繁殖障碍能持续几年甚至十几年之久[4]。PPV在环境中具有极强的存活能力,对pH和温度不敏感。除了对养猪企业的危害外,PPV也会严重危害生产猪细小病毒病疫苗的企业,在疫苗生产过程中一旦出现散毒或消杀不彻底的情况,将会极大影响后续生产。
PPV属于细小病毒科细小病毒属,无囊膜,病毒粒子呈二十面体对称,直径介于 20~25 nm。PPV的基因组为单股负链DNA,5 000 bp左右,负链上没有开放阅读框(open reading frame,ORF),正链有2个ORF。5′端编码三种非结构蛋白NS1、NS2和NS3,其中NS1蛋白与基因复制有关,其他两个非结构蛋白的功能尚不清楚[5-7]。3′端编码三种结构蛋白VP1、VP2、VP3,其中VP3蛋白由VP2蛋白水解产生,VP1蛋白与病毒复制有关,VP2蛋白在整个病毒衣壳中占据主要地位,拥有4个Loop环,抗原位点主要集中在这几个环上,位于蛋白表面。PPV很多重要的线性表位在VP2蛋白上,病毒能够利用VP2蛋白自我组装成没有核酸、不能自我复制的病毒样颗粒(virus like particles,VLPs)[8],同时诱导猪产生体液免疫和细胞免疫[9]。
目前,预防猪细小病毒病主要采用接种疫苗进行干预,市场上主要使用的猪细小病毒病疫苗为灭活疫苗。该疫苗虽然能够有效控制PPV的临床感染,但对疫苗生产企业而言,存在生物安全风险[10]。所以,研制安全、新型的猪细小病毒病疫苗对控制和彻底消灭此病具有重要意义[11]。本研究利用昆虫杆状病毒表达系统表达VP2蛋白,利用间接免疫荧光(indirect immunofluorescence assay,IFA)、透射电镜(transmission electron micrograph,TEM)、豚鼠紅细胞凝集试验等方法观察和分析VP2蛋白的表达情况,为后续研究猪细小病毒的病毒样颗粒疫苗奠定了基础。
1 材料与方法
1.1 材料
1.1.1 毒株、菌种和细胞
PPV BJ-2株由扬州优邦生物制药有限公司保存;Sf9昆虫细胞、大肠杆菌DH10Bac感受态细胞、pFastBac Ⅰ均购自Invitrogen公司。
1.1.2 主要试剂
EasyTaq DNA聚合酶、dNTPs、DNA Marker、T4连接酶、DNA凝胶纯化试剂盒、ProteinFind Anti-His单克隆抗体和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的羊抗鼠IgG均购自北京全式金公司;质粒抽提试剂盒购自Axygen公司;昆虫细胞培养基(Grace)和转染试剂Cellfectin Ⅱ购自Invitrogen公司;抗PPV阳性血清购自国生生物;FITC标记的山羊抗猪IgG购自Southern Biotechnology公司;其他常规试剂均为国产。
1.2 方法
1.2.1 引物设计与合成
设计并合成一对扩增PPV VP2基因的引物,引物序列为:
VP2-F:5-CGCGGATCCATGTCTGAGAACGTGGAAC-3,VP2-R:5-CCCAAGCTTTTAGTACAGC TTTCTAGGG-3。
其中加粗碱基为保护性碱基,上、下游引物的斜体碱基分别为BamHⅠ和Hind Ⅲ酶切位点。合成M13通用引物,引物序列为:
M13-F:5-CGCCAGGGTTTTCCCAGTCACGAC- 3,M13-R:5-CAGGAAACAGCTATGACC-3。
1.2.2 PPV VP2基因的扩增及杆状病毒转移载体的构建
以提取的PPV基因组DNA为模板扩增VP2基因。将纯化的PCR产物和转移载体pFastBacⅠ经BamHⅠ和Hind Ⅲ双酶切后分别回收目的片段并连接,构建重组杆状病毒转移载体pFastBac-PPV VP2,转化后提取质粒,取经PCR鉴定为阳性的质粒送南京金斯瑞生物技术公司测序。
1.2.3 重组杆状病毒质粒Bacmid-PPV VP2的构建及鉴定
将重组杆状病毒转移载体pFastBac-PPV VP2转化至大肠杆菌DH10Bac感受态细胞中,并涂于含有卡那霉素(Kan+)、庆大霉索(G+)、四环素(T+)、X-Gal和异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)的卢里亚-贝尔塔尼(Luria-Bertani,LB)培养基筛选平板上,37 ℃下培养24~48 h,挑取白色菌落并进行2次纯化,根据Bac to Bac表达系统说明书,提取含有VP2基因的重组杆状病毒质粒Bacmid-PPV VP2,同时转化pFastBacⅠ作为阴性对照,并提取仅含有His标签的重组质粒Bacmid-HTA,用M13通用引物进行PCR鉴定。
1.2.4 转染、收获重组杆状病毒
根据Cellfectin Ⅱ说明书将重组杆状病毒质粒Bacmid-PPV VP2转染入Sf9昆虫细胞。转染后置于27 ℃培养箱中继续培养72 h以上,直至细胞出现明显病变为止,收集细胞上清,即为P1代重组杆状病毒。P1代病毒在Sf9昆虫细胞上经2次传代扩增后,即为P3代重组杆状病毒。
1.2.5 间接免疫荧光检测VP2蛋白的表达
以P3代重组杆状病毒感染对数生长期的Sf9昆虫细胞,同时以野生型杆状病毒感染的Sf9昆虫细胞作为阴性对照,以未接种病毒的正常Sf9昆虫细胞作为空白对照,27 ℃下培养48 h以上,待接种病毒的细胞发生较明显的病变时收集上清,保留细胞,用间接免疫荧光试验分别对VP2蛋白和His标签进行检测。对VP2蛋白表达的检测:细胞用-20 ℃预冷的丙酮-乙醇(体积比4∶1)混合液4 ℃下固定30 min;PBS清洗3次,甩干后加入按1∶ 1 000稀释的抗VP2阳性血清,37 ℃下孵育 1 h;PBS清洗3次,甩干后加入按1∶200稀释的FITC标记的山羊抗猪IgG,37 ℃下孵育1 h;PBS洗3次后于荧光显微镜下观察。对His标签表达的检测:细胞用-20 ℃预冷的丙酮-乙醇(体积比4∶1)混合液4 ℃下固定30 min;PBS清洗3次,甩干后加入按1∶200稀释的ProteinFind Anti-His单克隆抗体;37 ℃下孵育1 h;PBS清洗3次,甩干后加入按1∶200稀释的FITC标记的羊抗鼠IgG,37 ℃下孵育1 h;PBS洗 3次后于荧光显微镜下观察。
1.2.6 VLPs纯化及鉴定
使用分子筛进行病毒样颗粒纯化,并收集纯化样本,经磷钨酸负染色处理,使用透射电镜观察病毒样颗粒的组装情况。
2 结果与分析
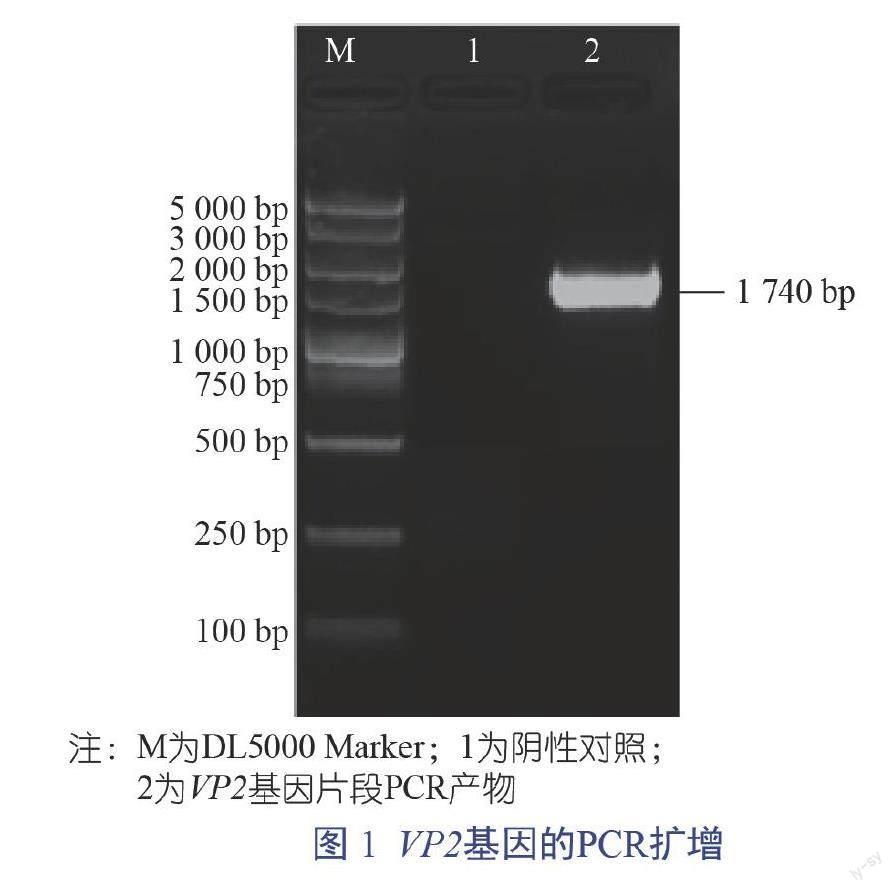
2.1 PPV VP2基因扩增与克隆
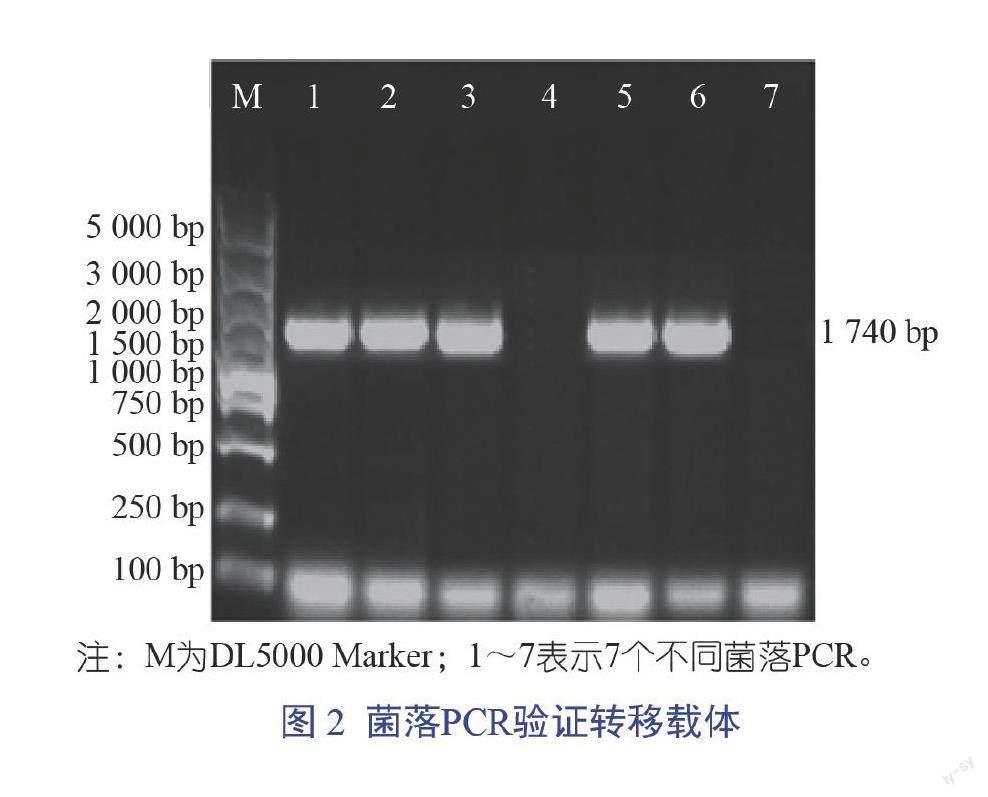
PCR扩增获得1条1 740 bp的DNA产物(图1),与预期扩增片段大小一致。由图2可知,用pFastBac F/R通用引物对重组转移载体进行鉴定,结果获得1 740 bp的目的条带,阳性克隆测序结果表明成功构建重组杆状病毒转移载体pFastBac-PPV VP2。
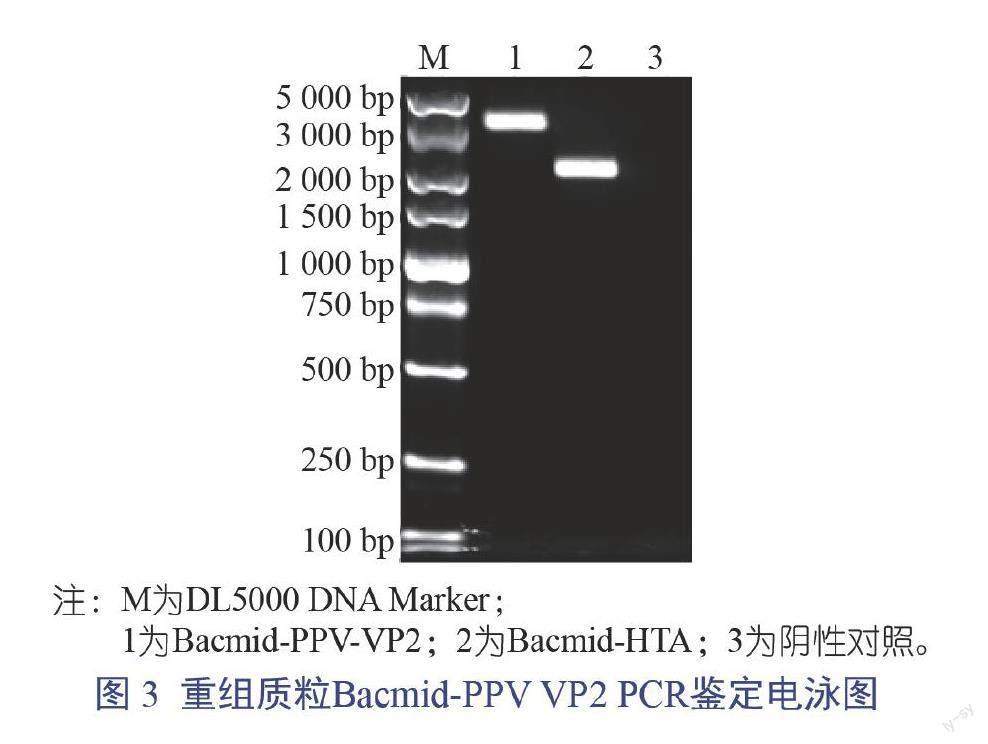
2.2 重组杆状病毒质粒Bacmid-PPV VP2的鉴定
将重组杆状病毒转移载体pFastBac-PPV VP2及空载体pFastBacH TA分别转化大肠杆菌DH10Bac感受态细胞,并通过蓝白斑筛选3次后提取质粒,经M13通用引物进行PCR鉴定,结果见图3。
由圖3可知,pFastBac-PPV VP2转化大肠杆菌DH10Bac感受态细胞后提取的质粒利用M13通用引物可以扩增出4 000 bp左右的条带,而pFastBacH TA转化大肠杆菌DH10Bac感受态细胞提取的质粒仅能扩增出2 300 bp左右的条带,从而证明了重组杆状病毒质粒Bacmid-PPV VP2构建成功。
2.3 转染和VP2蛋白表达检测
将重组杆状病毒质粒Bacmid-PPV VP2按转染试剂盒说明书转染Sf9昆虫细胞,同时设立阴性对照孔。转染72 h后,转染重组杆状病毒质粒Bacmid-PPV VP2的Sf9昆虫细胞开始变大、变圆、空泡化,结果表明已成功拯救表达VP2蛋白的重组杆状病毒rBac-PPV VP2。将成功拯救的重组杆状病毒rBac-PPV VP2在Sf9昆虫细胞上传至第3代,然后检测目的蛋白的表达情况。分别利用抗PPV阳性血清和ProteinFind Anti-His单克隆抗体作为一抗,然后利用相应的荧光二抗进行检测,结果见图4。
由图4可知,rBac-PPV VP2接种Sf9昆虫细胞后荧光检测结果均为阳性,而野生型杆状病毒感染的Sf9昆虫细胞及未接种病毒的正常Sf9昆虫细胞均未出现荧光,表明PPV VP2蛋白成功表达。
2.4 重组蛋白VP2-VLP纯化的TEM观察
通过分子筛的流穿物形成了4个波峰,第一个波峰在1/3柱体积处出峰,由于病毒样颗粒具有较大的分子量,理论上第一个波峰应该是病毒样颗粒,而其他波峰是其他杂蛋白分子(图5)。我们将第1个波峰流出的蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamidegelelectrophoresis,SDS-PAGE)电泳时发现,第一个波峰中全部为与PPV VP2大小相同的蛋白(图6),并且检测其血凝价发现,其血凝价为1∶2 048。电镜观察结果显示,第一个波峰流出的VP2蛋白自我组装形成了VLPs,该VLPs大小与PPV全病毒具有相同的直径,在20 nm左右(图7)。以上结果表明,杆状病毒表达系统可以成功表达VP2蛋白,并且表达的VP2蛋白可以自我组装成VLPs,而VLPs的形成可以有效地提高单一蛋白的免疫效果。
3 讨论
病毒样颗粒是一种近年来研究很火的安全有效的纳米材料[12]。它没有病毒核酸,不能自主复制,没有感染性,但能同时诱导动物机体产生体液和细胞免疫应答,所以,其作为一种新型疫苗进行研制具有重要的临床应用价值。具有高感染率的PPV会严重影响猪的生产性能和猪场的经济效益,给猪接种灭活疫苗虽然能够控制病毒的流行,但是存在一定的生物安全风险,所以开发新型安全的猪细小病毒病疫苗势在必行。近年来,研究人员使用不同表达系统使PPV VP2在体外组装形成了VLPs,并且对豚鼠和猪都产生了高特异性抗体水平。
作为一种蛋白表达手段,昆虫-杆状病毒系统已被广泛应用到多个领域,随着该系统的不断完善及研发成本的逐步降低,其受到兽用生物制品研发领域的关注。该系统在兽用生物制品中的应用典型例子是PCV2亚单位疫苗的生产,德国勃林格殷格翰公司生产的PCV2亚单位疫苗因其具有良好的免疫保护效果以及较短的免疫应答时间等特点得到了广泛应用。本研究基于Bac to Bac系统成功表达出了PPV VP2蛋白,并且研究发现该蛋白能够自我组装成病毒样颗粒,与天然PPV结构类似,透射电镜和动态光散射检测结果表明,制备的VLPs大小约20 nm,结构均一、形状规则,且具有血凝活性,說明该VLPs能够正确展示PPV的血凝活性表位,与前述杆状病毒表达系统中获得的VLPs结构类似,为进一步研发PPV VP2 VLPs疫苗奠定了基础。
参考文献
[1] 李斌,赵武,梁家幸,等.猪细小病毒疫苗研究进展及应用情况[J].猪业科学,2008,25(2):34-37.
[2] 李彬,马俊杰,赵静静,等.断奶仔猪多系统衰竭综合征中多病原混合感染的流行病学调查[J].华北农学报,2012,27(5):203-206.
[3] 马俊杰.断奶仔猪多系统衰竭综合征中多病原体混合感染的分子流行病学调查[D].南京:南京农业大学,2012.
[4] 祖立闯,谢金文,王文秀,等.我国猪细小病毒病的流行现状及实验室诊断技术研究进展[J].养猪,2016(6):125-128.
[5] ZEEUW E J L,LEINECKER N,HERWIG V,et al.Study of the virulence and cross-neutralization capability of recent porcine parvovirus field isolates and vaccine viruses in experimentally infected pregnant gilts[J].The Journal of General Virology,2007,88(Pt 2):420-427.
[6] ZIMMERMANN P,RITZMANN M,SELBITZ H-J,et al.VP1 sequences of German porcine parvovirus isolates define two genetic lineages[J].The Journal of General Virology,2006,87(pt2):295-301.
[7] HANSON N D,RHODE S L.Parvovirus NS1 stimulates P4 expression by interaction with the terminal repeats and through DNA amplification[J].Journal of Virology,1991,65(8):4325-4333.
[8] ZHOU HONGCHAO,YAO GUIZHE,CUI SHANGJIN.Production and purification of VP2 protein of porcine parvovirus expressed in an insect-baculovirus cell system[J].Virology Journal,2010,7:366.
[9] SEDLIK C,SARRASECA J,RUEDA P,et al.Immunogenicity of poliovirus B and T cell epitopes presented by hybrid porcine parvovirus particles[J].The Journal of General Virology,1995,76(Pt9):2361-2368.
[10] 张婉华,彭丽英,张春玲,等.猪细小病毒病疫苗研究进展[J].上海畜牧兽医通讯,2014(3):22-23.
[11] 欧阳海平,潘永飞,宋延华.猪细小病毒疫苗的研究进展[J].今日畜牧兽医,2020,36(11):48-49.
[12] 张素姣,王东亮,李萌,等.Loop EF区嵌合猪细小病毒B细胞表位对猪圆环病毒2型病毒样颗粒组装的影响[J].中国兽医科学,2019,49(2):176-182.
